2026年1月2號恰逢中國細胞治療領域迎來歷史性里程碑的一周年。2025年1月2日,中國國家藥品監督管理局(NMPA)正式批準了艾米邁托賽注射液的上市申請,成為中國首款獲得完全批準的間充質干細胞(MSC)新藥。
這一決定不僅標志著中國在細胞治療領域實現了從“跟跑”到“并跑”的關鍵跨越,也為全球再生醫學版圖增添了極具分量的中國坐標。
繼2024年12月美國FDA批準首款MSC療法Ryoncil后,中國在短短數周內迎來了本土MSC新藥的獲批,彰顯出中國在該領域積累的科研深度與監管成熟度。此次批準將進一步激活國內細胞治療產業鏈,推動從基礎研究到臨床轉化、從政策制定到市場準入的全生態升級,為全球MSC研發浪潮注入強勁的東方動能。
艾米邁托賽:為何是aGVHD?
艾米邁托賽的獲批適應癥,決定了它并非面向大眾市場,而是一款救命罕用藥。
疾病的致命性:急性移植物抗宿主病(aGVHD)是造血干細胞移植后最嚴重、最致命的并發癥之一。當患者(如白血病患者)移植了供者的造血干細胞后,供者的免疫細胞可能“反客為主”,攻擊患者的身體。其中,消化道受累的aGVHD尤為兇險,患者會出現難以控制的嚴重腹瀉、腹痛和出血,傳統一線激素治療失敗后,死亡率極高。
明確的臨床價值:艾米邁托賽作為一種異體臍帶來源間充質干細胞注射液,其核心作用在于強效的免疫調節。它像一名“調解員”,能抑制過度的免疫攻擊,控制炎癥風暴,為患者爭取生存機會。其獲批,為深陷絕境的患者和醫生提供了一款強有力的武器。
此次“附條件批準”,是基于其顯著的早期臨床療效數據。監管機構在確認其現有數據提示突出臨床價值且風險可控的前提下,允許其先上市,同時要求企業繼續完成確證性臨床研究。這條路徑兼顧了危重患者的緊急用藥需求與科學的審慎原則。
獲批之后:產業與信心的雙重激活
一款罕見病干細胞藥物的獲批,其漣漪效應遠超單一疾病領域。
首先,它驗證了中國細胞治療產品完整的產業化路徑。從細胞來源、標準化擴增、質量檢測到冷鏈運輸,艾米邁托賽的成功上市,意味著我國已初步打通了干細胞作為“藥品”而非“技術”的全鏈條生產質量管理規范(GMP)。這為后來者鋪平了技術道路。
其次,它重構了細胞治療的價值與定價認知。艾米邁托賽的單次治療定價為1.98萬元人民幣。與此前輿論猜測的“天價”不同,這個價格僅為美國同類產品Ryoncil(約140萬元人民幣/劑)的七十分之一。這一定價策略,不僅體現了可及性的巨大突破,更預示著中國創新藥在未來全球競爭中可以采取一種更靈活、更具社會價值的商業策略。
資本市場與研發管線隨之重新校準方向。投資界開始更深入地審視那些針對明確臨床空白、擁有扎實生物學機制的細胞治療項目。同時,研發熱點也不再盲目追逐“大適應癥”,而是更關注在像aGVHD這樣“小而危重”的領域實現快速突破的可能性。
艾米邁托賽注射液獲批之后,在2025年期間發生的大事件
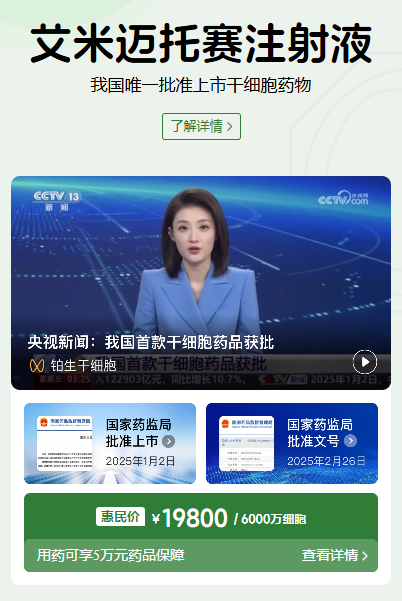
獲批上市:自2025年1月2日獲得國家藥監局附條件批準上市以來,艾米邁托賽注射液(商品名:睿鉑生)在國內的進展并非簡單的商業上市,而是一系列快速、扎實且環環相扣的里程碑事件。這些事件共同描繪了一款突破性罕見病藥物從獲批到真正惠及患者的完整軌跡,展現了中國創新藥落地的新速度。
首張處方開出:2025年初的獲批,只是一個起點。真正的突破發生在同年6月5日,由北京大學人民醫院黃曉軍院士團隊開出了全國首張處方并完成了首針注射。這標志著這款中國首款干細胞新藥正式從監管文件走向臨床實踐,開啟了拯救生命的實際應用。
商業合作達成:緊隨其后的是商業化布局的關鍵一步。在2025年6月,研發企業與阿里健康達成了全渠道獨家經銷合作。這一合作不僅關乎銷售渠道,更是通過阿里健康的藥品追溯體系和專業冷鏈物流,確保了這款活細胞藥品在全國范圍內可及、可控、可追溯,為其大規模臨床應用鋪設了基礎設施。
推出用藥保障計劃:為了解決罕見病治療中最棘手的高昂費用問題,一項創新的支付保障計劃在2025年7月2日迅速推出。阿里健康聯合眾安保險,為用藥患者提供了專項保障:在完成一個標準療程(8次輸注)后,若經評估為疾病進展,患者最高可獲得5萬元人民幣的補償。這一舉措顯著降低了患者的用藥經濟風險,體現了“讓患者用得上、用得起”的本土化創新。
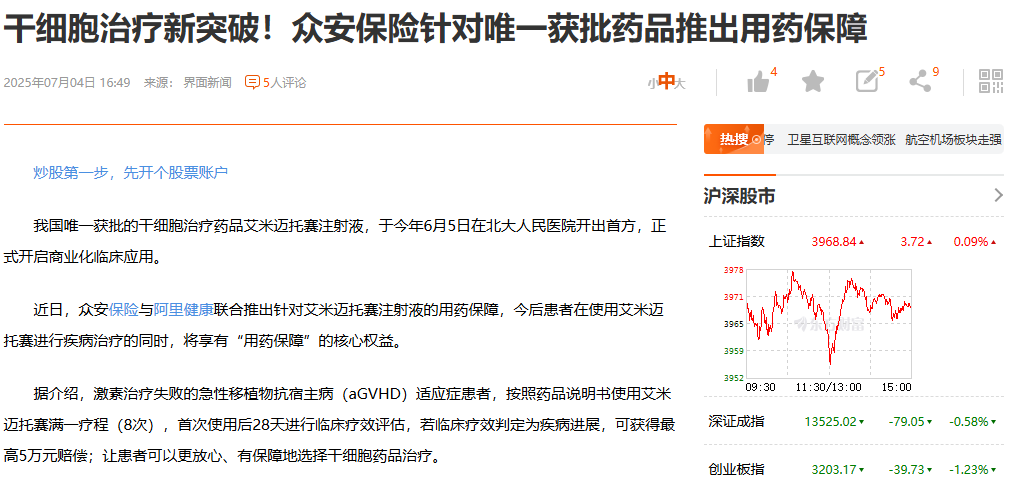
首位患者康復出院:臨床應用的真實效果很快得到了驗證。2025年9月14日,中央電視臺報道了首位接受艾米邁托賽治療的重癥腸道aGVHD患者順利康復出院的消息。這例成功的真實世界病例,為該藥的療效提供了最具說服力的早期證據,給予了臨床醫生和更多患者極大信心。
實現廣泛臨床覆蓋:在此基礎上,藥物的可及性迅速擴大。截至2025年9月,通過線上平臺的預約服務已覆蓋全國20個省份,超過20家頂尖的造血干細胞移植中心開始了該藥的應用,累計治療患者已達百余人。這一覆蓋速度在罕見病治療領域是罕見的。
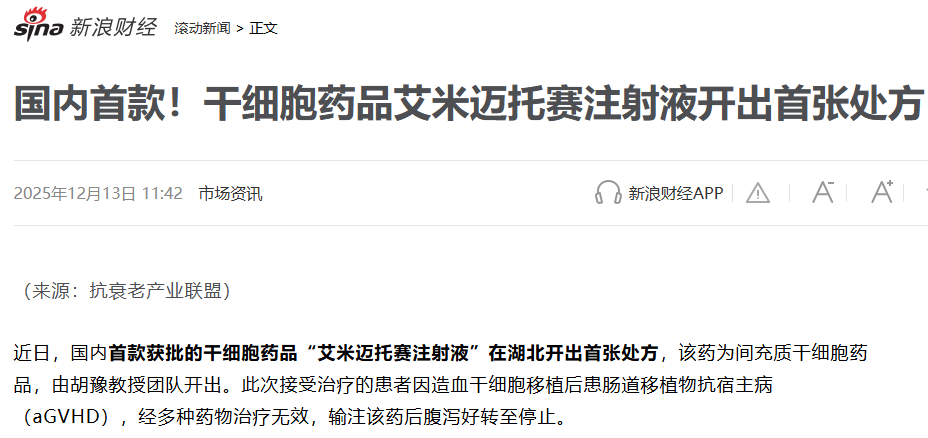
湖北首張處方落地:隨后在2025年12月12日,華中科技大學同濟醫學院附屬同濟醫院胡豫教授團隊開出了湖北省的首張處方,標志著其臨床應用正從核心醫院向全國重點醫療區域深化。
除了這條清晰的主線,兩個重要的背景信息同樣關鍵:
第一,在支付端,該藥1.98萬元/劑的親民定價(僅為美國同類藥的約1/70),以及被多地“惠民保”及商業保險納入的探索,構建了多層次支付保障。
第二,在研發端,針對糖尿病腎病、急性腎損傷等新適應癥的臨床研究已在獲批后陸續展開,預示著其未來更大的治療潛力。
全球已獲批間充質干細胞療法版圖更新:中國力量崛起
隨著艾米邁托賽注射液的上市,全球完全獲批的MSC療法數量更新為19款,地域分布如下表所示:
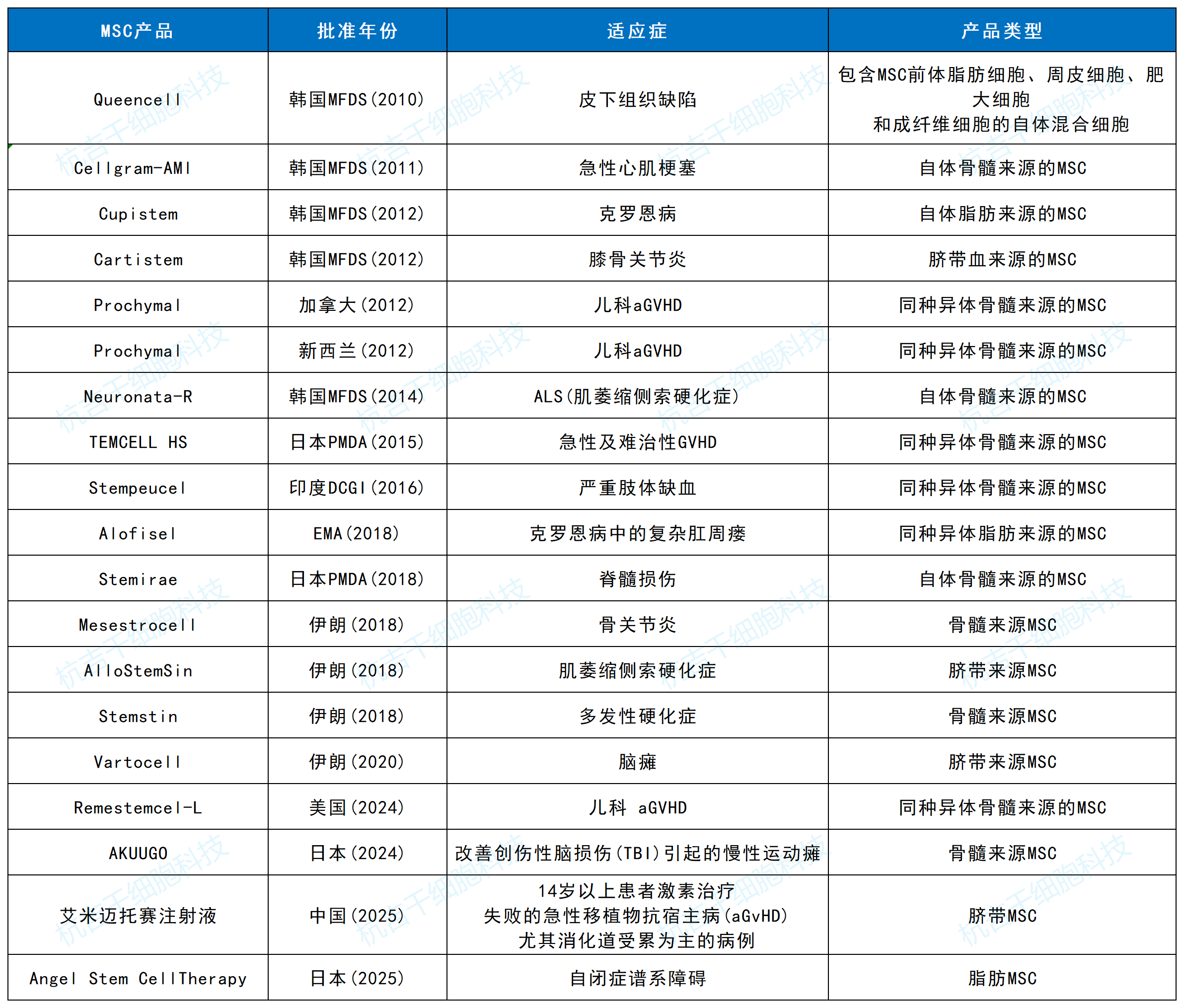
這一格局清晰表明,東亞(中、日、韓)已成為全球MSC療法商業化應用的核心區域,其中中國憑借龐大的市場潛力、快速進步的研發體系和日益開放的監管態度,正迅速成長為全球不可忽視的領導者之一。
驅動中國再生醫學浪潮的核心引擎:系統優勢的集中釋放
中國MSC領域能在短時間內取得突破性進展,源于多重內外部因素的合力:
戰略政策牽引:“十四五”生物經濟發展規劃等頂層設計將細胞治療明確為前沿生物技術重點,從國家戰略層面提供持續支持。
臨床需求迫切:人口老齡化加速,退行性疾病、免疫性疾病患者基數巨大,催生了巨大的臨床應用市場。
研發基礎扎實:中國在干細胞基礎研究領域發表論文和申請專利數量已居世界前列,積累了豐富的科學人才和知識儲備。
監管科學進步:NMPA近年來持續推進藥品審評審批制度改革,針對細胞治療等前沿產品,建立了更具靈活性且不降低標準的審評路徑,與國際監管快速接軌。
資本積極涌入:在政策鼓勵和市場前景吸引下,大量風險投資和產業資本進入細胞治療賽道,支撐了從研發到生產的長期投入。
前路:一場更復雜的馬拉松剛剛開始
獲批是終點,更是起點。艾米邁托賽面臨的挑戰極具代表性:
第一關是市場教育與臨床滲透。如何讓全國范圍內血液科的移植醫生充分認知并信任這款全新的細胞藥物,將其規范地納入診療方案,是商業化的第一道坎。
第二關是確證性臨床研究的壓力。“附條件批準”意味著企業必須如期完成更嚴格的驗證性臨床試驗,以確保持續滿足完全批準的標準。這是一場不容有失的“期中大考”。
第三關是生產工藝的極致穩定。活細胞藥品的每一劑都是“活的”。如何確保成千上萬份產品在復雜的制備過程中,其細胞活性、純度和功能毫厘不差,是生命線所在。
第四關是出海與國際認同。中國創新的終極試煉場是全球。艾米邁托賽能否以其中國數據,設計并開展符合國際標準的多中心臨床試驗,最終獲得FDA或EMA的認可,將決定它能否從“中國新藥”蛻變為“全球療法”。
結語
艾米邁托賽注射液的批準,不是關于一個熱門賽道的狂歡,而是一次關于 “臨床價值本源” 的回歸。它證明,中國的生物醫藥創新,完全有能力在最艱難、最危急的疾病陣地上,拿出世界級的解決方案。
它更像一個宣言:在全球細胞治療的第二波浪潮中,中國不僅要做參與者,更要以獨特的臨床洞察、高效的研發體系和極具競爭力的可及性策略,成為重要規則的定義者之一。
2025年,中國細胞治療的故事,從此翻開新的一頁。它的主題不再是“能否做出新藥”,而是 “我們如何定義好藥” 。艾米邁托賽注射液,正是這個新敘事的開篇。
主要參考資料:網絡資料整理
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信