當神經性疼痛如影隨形,每一分每一秒都可能成為患者難以忍受的煎熬。據統計,全球約有10%的人口飽受這種病痛折磨,從針刺般的刺痛,到灼燒般的劇痛,再到難以名狀的麻木感,嚴重影響著患者的生活質量,甚至讓許多人陷入絕望的深淵。傳統治療手段往往只能緩解一時癥狀,難以從根源上解決問題。
近年來,細胞治療策略在疼痛領域的應用取得了令人鼓舞的成果,包括臨床前研究和臨床試驗。間充質干細胞(MSCs)是來源于中胚層的多能祖細胞,具有自我更新和分化成多種細胞類型的能力,在神經再生醫學領域得到了廣泛的研究和應用。
神經性疼痛的終結者?間充質干細胞治療的科學邏輯與臨床困局
近日,南昌大學江西醫學院第二附屬醫院康復醫學科在國際期刊雜志《干細胞研究與治療》上刊發了一篇“基于間充質干細胞的神經性疼痛細胞治療進展與挑戰”的文章[1]。

該文章討論了目前神經病理性疼痛的治療策略,探討了間充質干細胞在神經病理性疼痛治療中的功能作用和機制。我們還分析了間充質干細胞在神經病理性疼痛臨床試驗中應用的當前問題和挑戰。但它從實驗室走向臨床,還有哪些進展值得關注?又面臨著怎樣的挑戰?讓我們一同深入探尋。
神經性疼痛及其治療現狀
神經系統直接或間接損傷可導致機體感覺、運動功能等功能障礙,并誘發疼痛。疼痛是機體對外在損傷或內內在疾病的反應,對個體的風險感知和風險規避至關重要。疼痛按時間可分為急性痛和慢性痛(定義為疼痛持續或消退超過3個月),而神經病理性疼痛(NPP)屬于慢性疼痛的類型,由軀體感覺神經系統病變或疾病引起,占20%–25%,在一般人群中的患病率可高達7%–8%,對生活質量有顯著影響。

神經病理性疼痛的分類:2019年國際疼痛研究協會(IASP)將NPP分為慢性周圍性疼痛性疼痛(Chronic Peripheral NPP)和慢性中樞性疼痛性疼痛(Chronic Central NPP)。前者由周圍軀體感覺神經系統病變或疾病引起,常見類型有三叉神經痛、周圍神經損傷等;后者由中樞神經系統損傷或疾病引發,如脊髓損傷、腦損傷、腦卒中、多發性硬化癥相關的疼痛等。
神經病理性疼痛的來源與臨床表現:
- 來源:創傷、壓力、免疫、腫瘤侵襲和炎癥等多種因素造成神經損傷,進而誘發NPP。
- 臨床表現:正性現象(各種疼痛癥狀、感覺異常和/或感覺障礙)與負性現象(疼痛區域神經感覺功能障礙及其他方面功能障礙,如運動、認知等,取決于病變部位)相結合。因個體差異、年齡、性別、受損神經及疼痛敏感性不同,臨床表現差異大,給臨床判斷、診斷和治療帶來挑戰。
神經病理性疼痛的診斷:
篩查工具主要是問卷,如NPP問卷、PainDetect、ID- Pain和DN4,根據患者對疼痛質量的口頭描述分類。診斷疑似NPP需特殊檢查確定疼痛是否源于神經系統,疼痛分布要與軀體感覺神經系統潛在損傷或疾病對應,電生理技術和神經活檢樣本可評估神經功能衰退和病變程度,但非侵入性診斷技術有待探索。
NPP的治療方式:
- 藥物治療:一線藥物有加巴噴丁、雙環類抗抑郁藥、選擇性甘草堿 – 去甲腎上腺素重吸收抑制劑;二線有利多卡因、辣椒素和曲馬多;三線是強效阿片類藥物和肉毒桿菌毒素A。這些藥物鎮痛效果不理想,有中樞副作用、抗膽堿能和鎮靜副作用,還會導致用藥依賴、療效降低。
- 其他治療策略:包括合理聯合治療、藥物重復使用、非藥物方法(如神經刺激技術)、物理治療、神經阻滯和個性化治療管理等,但緩解疼痛效果仍不理想,無法實現長期治療,亟需探索新的治療方法。
間充質干細胞治療鎮痛的優勢及機制概述
間充質干細胞具有多向分化、促進干細胞植入、低免疫原性和免疫調節等功能,是治療疼痛的有效替代方法。其鎮痛優勢和機制體現在促進軸突再生和髓鞘形成、分泌神經營養因子、促進血管生成、免疫調節和抗炎等方面。?
間充質干細胞促進軸突再生和髓鞘再形成
- 神經損傷修復關鍵:軸突再生與再髓鞘化是神經損傷修復的關鍵,能建立新神經網絡,降低神經沖動傳導與突觸可塑性,利于緩解疼痛,促進損傷部位軸突再生是治療神經損傷及止痛的關鍵。
- MSCs的作用:不同研究表明MSCs能促進神經損傷后的軸突再生,可替代受損組織細胞,發揮神經橋接功能,促進軸突再生與髓鞘化,增加有髓纖維數目、髓鞘厚度、軸突數量及生長因子表達,促進運動功能恢復。?
間充質干細胞分化及對鎮痛的作用
- 分化為GABA能神經元細胞:MSCs可分化成足夠數量的GABA能神經元細胞發揮鎮痛作用,cAMP反應元件結合蛋白1(EREB1)在人間充質干細胞(hMSCs)中過表達,誘導分化為GABA能神經元細胞,增強GABA能神經分化,鞘內移植轉染CREB1的hMSCs可提高神經元存活率和神經分化,增加熱痛潛伏期,減輕NPP。?
- 脊髓和臍帶MSCs移植:脊髓MSCs和臍帶MSCs移植到脊髓損傷大鼠體內,可保護神經元存活,促進功能恢復,減輕痛覺過敏,臍帶MSCs治療效果更佳。?
總結:這些研究表明MSCs可以分化神經元,保護神經元存活,促進軸突再生和髓鞘形成,達到鎮痛作用,通過促進軸突再生、保護神經元存活來取代軸突溶解脫髓鞘和神經元分化是緩解NPP的關鍵(圖1)。
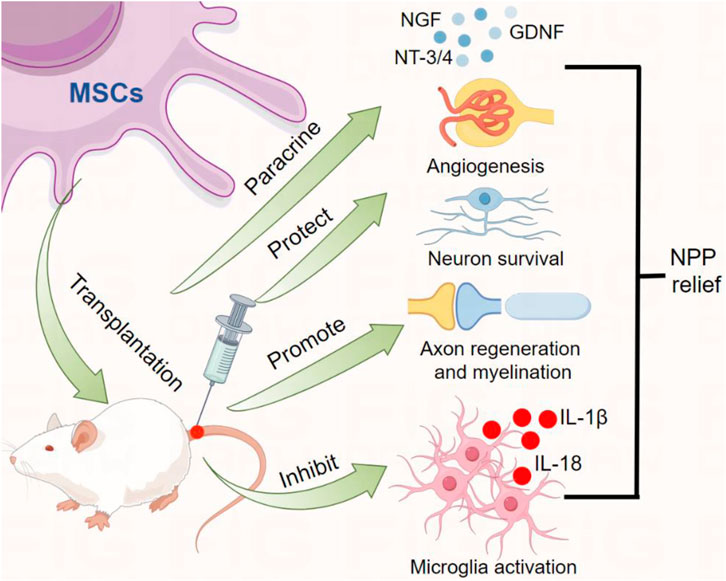
圖1:MSCs移植產生鎮痛功能效應MSCs移植入機體可通過分泌神經營養因子(如NGF、GDNF、NT3/4等)、促進血管生成、促進軸突再生和髓鞘形成、抑制炎癥細胞活化及促炎細胞因子的釋放等產生鎮痛功能效應。
間充質干細胞產生神經營養因子
- 神經營養因子作用:神經營養因子(NT)調節神經元存活、生長和程序性細胞死亡,體外促進神經元存活生長,體內神經元發育依賴其供應。外周神經損傷后,神經系統通過自分泌或旁分泌提供神經營養因子應對神經再生,其對受損感覺神經元有神經保護作用,部分神經因子通過相關受體信號傳導參與NPP潛在機制。
- MSCs的作用:MSCs移植旁分泌VEGF、CNTF、NGF和BDNF等多種神經營養因子,為神經損傷再生提供營養環境。不同來源MSCs可產生多種神經營養因子,促進神經再生、防止神經元死亡、緩解疼痛進展。MSCs聯合普瑞巴林可改善坐骨神經結構與功能,緩解NPP。此外,MSC來源外泌體富含營養因子,可產生鎮痛藥理作用。
- 下調疼痛相關因子:P2X嘌呤受體、TRPV1等蛋白受體參與NPP發生發展,MSCs移植可下調其表達緩解NPP。
間充質干細胞促進血管生成
- 血管生成的重要性:血管系統對神經發育、神經發生及維持神經系統功能穩定至關重要,血管損傷不利于組織修復,NPP過程中缺血性損傷常見,血管生成對神經元存活和NPP意義重大,促進血管生成可緩解NPP。
- MSCs的作用:MSCs移植可促進損傷部位血管生成,加速軸突再生,改善行為功能。MSCs及其分泌型外泌體可調節內皮細胞活性,促進內皮細胞增殖、遷移和血管生成,增加新生內皮細胞及神經元數量,改善功能恢復,緩解疼痛。雖MSCs促進血管生成緩解疼痛的直接證據不足,但它參與了血管生成和神經再生。
間充質干細胞的免疫調節和抗炎作用
- 炎癥與疼痛的關系:炎癥過程中免疫細胞激活和炎癥介質釋放可誘發疼痛,免疫細胞激活介導的神經炎癥反應與神經損傷后的功能恢復和疼痛密切相關,抑制炎癥反應可緩解NPP。
- MSCs的免疫調節作用:MSCs抑制先天免疫細胞和適應性免疫細胞的免疫應答,營造耐受性微環境,其免疫調節通過細胞接觸和/或分泌多種因子實現,與免疫細胞建立雙向調控機制。MSCs可降低炎癥細胞因子表達發揮抗炎作用,緩解疼痛,高劑量骨髓MSCs移植抗炎鎮痛作用更強。
- 對小膠質細胞的調節:小膠質細胞在神經系統免疫微環境和功能中起關鍵作用,MSCs可調節小膠質細胞極化和神經炎癥反應產生抗傷害作用,減輕神經炎癥,緩解NPP。
- 工程改造增強功能:一些研究對MSCs進行工程改造,如表達SIRT1、用轉化生長因子-β1治療、轉染成纖維細胞生長因子1、前腦啡肽基因工程改造等,增強其免疫和抗炎功能,產生更好的鎮痛治療效果。
- 外泌體的免疫調節作用:MSCs產生的外泌體可發揮免疫調節作用,緩解NPP和其他炎癥性疾病。
間充質干細胞移植在疼痛治療中的臨床試驗和挑戰
MSCs在臨床試驗中的應用已經取得了一定的進展,以探索治療不同疾病的安全性、可行性和治療效果,例如糖尿病、心力衰竭、急性非動脈炎性視神經病變和類風濕性關節炎等。這些臨床試驗證實了MSCs作為細胞治療應用的前景。
鑒于MSCs在基礎疼痛研究中發揮鎮痛作用,同樣,MSCs在疼痛臨床試驗中也取得了令人鼓舞的結果。一些研究人員最初從基礎研究過渡到臨床試驗。
間充質干細胞治療骨關節炎疼痛治療的臨床試驗
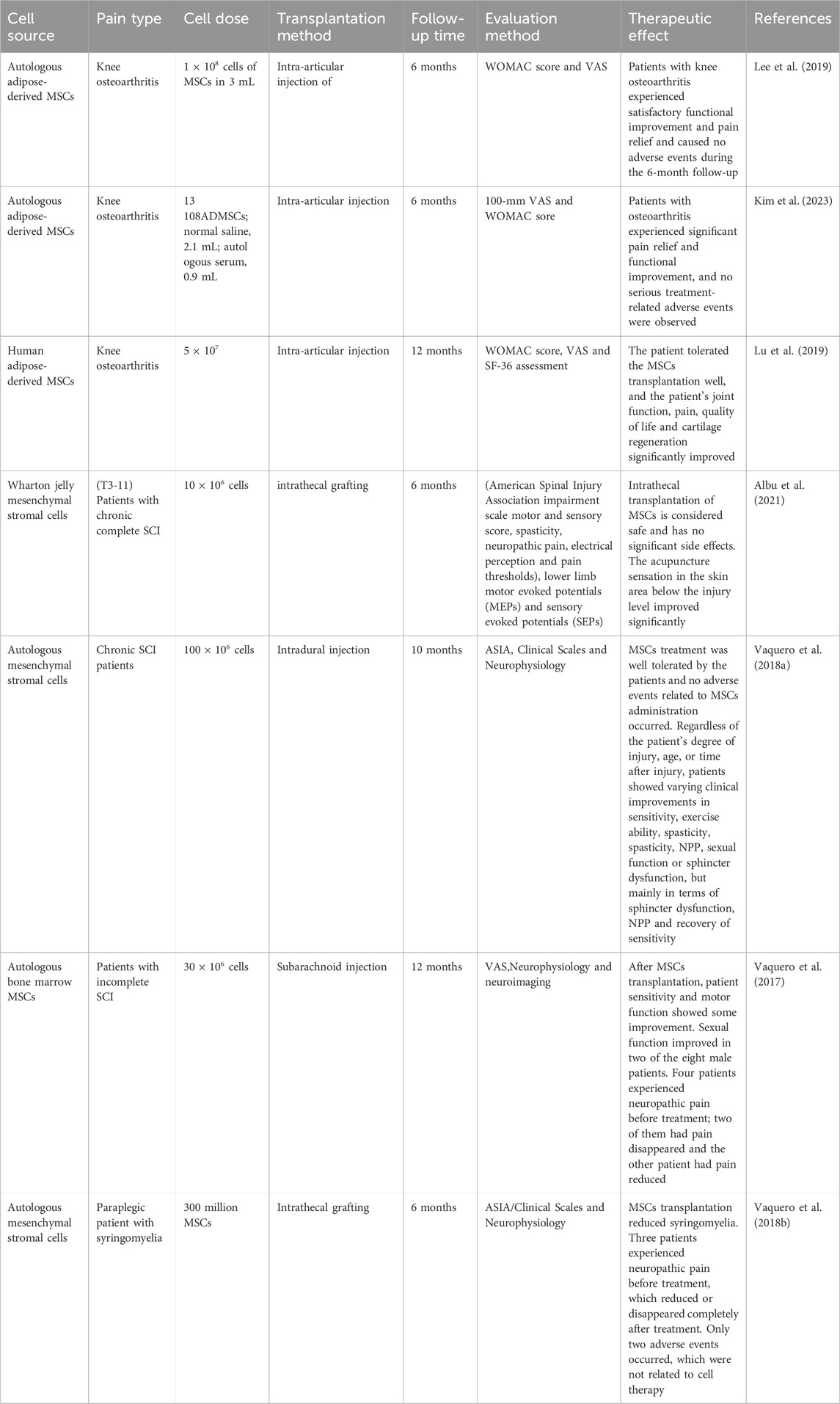
2019年,上海交通大學醫學院仁濟醫院進行了一項II期臨床試驗:將自體脂肪來源的MSCs注射到12例膝骨關節炎患者關節腔內,與12例注射生理鹽水的對照組對比。6個月隨訪發現,MSCs移植組膝關節疼痛VAS評分顯著降低,患者日常生活活動、運動和生活質量評分顯著提高,且6個月內無不良事件。

2023年,美國運動雜志發表了一篇間充質干細胞治療膝關節骨關節炎的III期多中心臨床試驗:對161例膝關節炎患者關節腔內注射自體脂肪來源的MSCs,隨訪6個月。結果顯示患者疼痛明顯緩解,功能改善,未觀察到嚴重治療相關不良事件,MRI顯示6個月時兩組軟骨缺損無明顯差異。
另一項研究:對53例骨關節炎患者關節腔內移植自體人脂肪間充質祖細胞/干細胞,隨訪12個月。結果表明患者的WOMAC、ASA、SF-36評分均明顯改善,更多患者WOMAC改善率達50%及70%,患者耐受性良好,膝關節功能、疼痛、生活質量、軟骨再生等均明顯改善。
總結:關節內注射MSCs可為骨關節炎患者緩解疼痛、改善功能,但需更大樣本量、更長隨訪時間等確定其疾病改善效果。
間充質干細胞治療脊髓損傷及并發NPP治療的臨床試驗
2021年,西班牙巴塞羅那自治大學進行了一項1/2a期臨床試驗:將Wharton jelly MSCs移植到10例慢性完全性脊髓損傷患者體內,6個月評估發現,損傷水平以下皮膚區域針刺感明顯改善,部分個體膀胱功能指標有變化,但運動功能等其他指標無變化,表明鞘內移植人臍帶來源的WJ-MSCs安全,可改善損傷部位附近節段感覺變化。

2018年,西班牙馬德里自治大學進行了一項II期臨床試驗:向11名患者硬膜內注射MSCs,10個月隨訪分析安全性。結果顯示MSCs治療耐受性良好,無相關不良事件,患者在敏感性、運動能力、痙攣、NPP、性功能或括約肌功能障礙等方面有不同程度臨床改善,部分患者神經生理學指標改善,提示MSCs療法安全有效。
另一項臨床試驗:10例不完全性SCI患者接受自體骨髓MSCs移植,隨訪12個月。結果顯示患者敏感性和運動功能改善,4例NPP患者中2例疼痛消失,1例減輕,多數患者出現亞病變肌電圖,提示肌肉神經支配活躍,MSCs移植后患者血清中多種神經營養因子平均值略有升高但無統計學差異,表明MSCs移植耐受性良好,可逐步顯著改善不完全脊髓損傷患者生活質量。
又一項Ⅱ期臨床試驗:將MSCs移植到6例脊髓空洞癥截癱患者體內,6個月隨訪。結果顯示部分患者肛門直腸壓力測量值、神經生理學研究、誘發電位改善,部分患者敏感性和神經源性腸功能障礙改善,3名NPP患者治療后疼痛減輕或消失,僅發生2起與細胞療法無關的不良事件(表1)。
間充質干細胞移植在治療神經疼痛中的挑戰
雖然這些臨床數據表明間充質干細胞移植對緩解疼痛具有功能性作用。但是,這些研究獲得的數據和結果仍然缺乏足夠的直接證據和更好更可靠的數據來充分支持MSCs在疼痛治療中的廣泛發展和應用。這也與間充質干細胞移植治療目前面臨的一些問題和挑戰有關。
細胞來源問題
- 來源局限與挑戰:臨床試驗中MSCs多來自自體脂肪和骨髓,體外擴增和純化系統不完善,培養過程的基因不穩定性可能引發副作用與潛在風險。
- 解決方向:可通過優化MSCs分離、增殖、體內制備,以及合理選擇使用劑量并針對個體調整來應對。
治療方案標準化缺失
- 多種因素影響療效:使用不同劑量的MSCs、選擇不同移植時間及方法(靜脈、鞘內或局部移植),會導致治療結果差異。如靜脈移植可能因難以在受傷部位定植,降低移植細胞數量與存活率,影響治療效果與安全性。
- 缺乏指導標準:目前尚無標準指導和實施這些治療方案,阻礙臨床試驗廣泛開展。
基礎研究待加強
- 機制探索需求:盡管MSCs臨床止痛成果令人鼓舞,但需更多臨床試驗直接證明其安全性、可行性與有效性。同時,需要更多基礎研究和動物模型,深入探索MSCs體內止痛的具體機制。
- 模型與評價體系完善:人與動物生理及發育存在差異,動物模型結果不能直接用于臨床,且目前對MSCs生物學特性及鎮痛有利因素認識不足,需完善NPP動物模型的標準和評價體系。
聯合治療研究空白:需了解MSCs與常用鎮痛藥(阿片類與非阿片類)在止痛各方面的差異及相互作用,包括聯合使用的治療效果,探索在鎮痛藥基礎上聯合MSCs增強療效、降低劑量與副作用的潛力。
寫在最后:江西醫學院二附院在《干細胞研究與治療》上發表的成果,無疑是干細胞治療神經痛領域的一座里程碑。它不僅為無數深受神經痛折磨的患者點亮了希望之光,更激勵著全球科研工作者在這一前沿領域不斷探索前行。
相信在不久的將來,隨著研究的深入和技術的完善,干細胞治療將徹底攻克神經痛這一醫學難題,為人類健康事業書寫嶄新的篇章,讓更多人擺脫病痛的陰霾,擁抱健康美好的生活。
參考資料:[1]:Zhang W-J, Pi X-W, Hu D-X, Liu X-P and Wu M-M (2025) Advances and challenges in cell therapy for neuropathic pain based on mesenchymal stem cells. Front. Cell Dev. Biol. 13:1536566. doi: 10.3389/fcell.2025.1536566
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信