概述
卵巢的正常功能和性激素的分泌是維持女性性征、促進(jìn)卵泡發(fā)育和排卵的最重要的內(nèi)分泌因素之一。卵巢早衰(POI)是女性不孕癥的常見原因。定義為40歲之前卵巢功能喪失。
POI的特點(diǎn)是月經(jīng)紊亂,包括閉經(jīng)和月經(jīng)推遲,并伴有促性腺激素水平升高和雌二醇水平降低。炎癥衰老是衰老研究領(lǐng)域的一個(gè)新概念。它是指隨著年齡的增長(zhǎng)而發(fā)生的慢性、低度促炎狀態(tài)。炎癥衰老與多種疾病密切相關(guān),因?yàn)檫^度的炎癥會(huì)誘發(fā)身體某些器官的炎癥病變。
近年來研究表明,炎癥衰老在POI的發(fā)病機(jī)制中發(fā)揮著重要作用。本文從炎癥性衰老的發(fā)病機(jī)制入手,全面總結(jié)炎癥性衰老與卵巢早衰的關(guān)系,并探討POI的新診斷和治療方法。

簡(jiǎn)介
由于環(huán)境污染、巨大的生活和工作壓力等因素,女性不孕癥和卵巢早衰(POI)已成為備受關(guān)注的全球性問題。POI是一種在40歲之前卵巢功能停止、雌激素水平下降、促性腺激素水平升高的疾病。既往研究表明,40歲之前女性POI的發(fā)病率約為1%,30歲之前女性其發(fā)病率為1‰。此外,大約10%至28%的女性經(jīng)歷過原發(fā)性閉經(jīng),大約4%至18%的女性表現(xiàn)出繼發(fā)性閉經(jīng)。近年來研究表明,炎癥衰老與POI密切相關(guān)。此外,POI患者的卵巢活檢顯示淋巴細(xì)胞浸潤(rùn)和其他卵巢免疫反應(yīng)。因此,炎癥在卵巢功能退化中的作用,以及延緩卵巢衰老、改善卵巢功能的治療方法,是目前生殖領(lǐng)域研究熱點(diǎn)。本文將討論炎癥衰老的機(jī)制及其與POI的關(guān)系。
炎癥衰老機(jī)制
機(jī)體的自然衰老是一個(gè)長(zhǎng)期而復(fù)雜的生物過程,是機(jī)體退化時(shí)期內(nèi)在因素和外在因素相互作用的結(jié)果。老化的特點(diǎn)是結(jié)構(gòu)退化;內(nèi)部環(huán)境失衡;功能衰退;以及適應(yīng)性、彈性和抵抗力的喪失。隨著科學(xué)的飛速發(fā)展,衰老研究正進(jìn)入新的研究階段;然而,迄今為止,衰老的確切機(jī)制尚未得到徹底闡明。
近年來,越來越多的研究發(fā)現(xiàn)炎癥與衰老的發(fā)生有關(guān);在衰老的過程中,身體的組織和器官都伴隨著慢性、進(jìn)行性的促炎癥狀態(tài)。炎癥老化是Franceschi等人首先創(chuàng)造的術(shù)語。2000年。目前,炎癥衰老的機(jī)制可以用圖1所示的假設(shè)來說明。
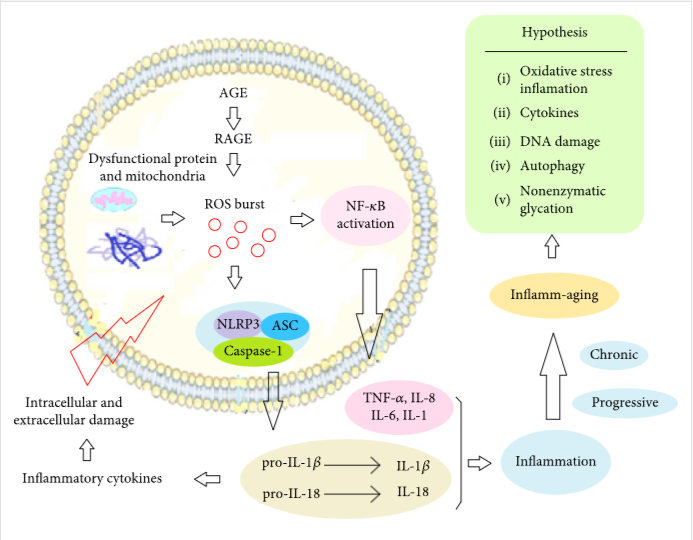
由于多種因素,體內(nèi)的ROS增加。
它引起氧化應(yīng)激以及由NLPR3和NF- κB激活的一系列炎癥反應(yīng)。現(xiàn)總結(jié)為:氧化應(yīng)激炎癥、細(xì)胞因子、DNA損傷、自噬和非酶糖化。
氧化應(yīng)激和炎癥
氧化應(yīng)激是指體內(nèi)氧化與抗氧化之間的不平衡,容易氧化而導(dǎo)致中性粒細(xì)胞炎癥浸潤(rùn)。氧化應(yīng)激是由過多的活性氧(包括氧自由基)引起的,在慢性炎癥引起的機(jī)體炎癥衰老中發(fā)揮著重要作用。20世紀(jì)90年代,Sohal和Weindruch注意到自由基理論的缺陷,基于氧化應(yīng)激與衰老的密切關(guān)系,提出了氧化應(yīng)激的概念。奧塔維亞尼和弗蘭切斯基研究了一系列不同物種,從無脊椎動(dòng)物到人類,發(fā)現(xiàn)免疫-應(yīng)激-炎癥形成了機(jī)體的防御網(wǎng)絡(luò),證實(shí)應(yīng)激是炎癥衰老的原因之一。此外,抗氧化劑已成功應(yīng)用于減少氧化應(yīng)激損傷并提高個(gè)體的壽命,這也證實(shí)了氧化應(yīng)激炎癥的假說。
促炎細(xì)胞因子與衰老
炎癥因子的過度表達(dá)會(huì)導(dǎo)致體內(nèi)處于高度促炎狀態(tài),這是炎癥衰老的重要因素。大量研究表明,衰老器官血清中IL-6、IL-8、TNF-α、PGE2等炎癥因子水平顯著升高。薩爾維奧利等人檢查了所有年齡段的正常個(gè)體和患有與衰老相關(guān)的疾病(例如阿爾茨海默病和2型糖尿病)的患者,并確定促炎細(xì)胞因子水平升高在衰老中發(fā)揮重要作用。
DNA損傷
正常人體的DNA修復(fù)機(jī)制可以修復(fù)受損的DNA,但隨著年齡的增長(zhǎng),DNA損傷不斷累積,最終導(dǎo)致細(xì)胞死亡。Bonafe等人的研究證明,身體的炎癥衰老是由于DNA損傷造成的;隨著干細(xì)胞和基質(zhì)成纖維細(xì)胞的分化,促炎細(xì)胞因子的過度表達(dá)被觸發(fā),從而瓦解多殼細(xì)胞因子網(wǎng)絡(luò)。
自噬
Christian de Duve教授在20世紀(jì)60年代提出了自噬的概念,積累的證據(jù)表明自噬在真核細(xì)胞中普遍存在,在維持細(xì)胞穩(wěn)態(tài)和延緩衰老方面發(fā)揮著至關(guān)重要的作用。薩爾米寧等人發(fā)現(xiàn),在衰老過程中,自噬清潔能力逐漸下降,功能失調(diào)的蛋白質(zhì)和線粒體積累,導(dǎo)致活性氧(ROS)水平升高和氧化應(yīng)激。ROS激活NOD樣受體3(NLRP3)并引起一系列炎癥反應(yīng),例如IL-1β分泌水平增加和IL-18。反過來,這些細(xì)胞因子還通過抑制自噬引起的炎癥加速衰老過程。
糖化
糖化是內(nèi)源性衰老機(jī)制之一。高級(jí)糖基化終產(chǎn)物(AGE)是非酶糖基化的終產(chǎn)物,隨著年齡的增長(zhǎng)在體內(nèi)積累。許多學(xué)者所接受的糖基化衰老理論認(rèn)為,糖基化會(huì)引起蛋白質(zhì)的交聯(lián)損傷,使結(jié)構(gòu)正常的蛋白質(zhì)轉(zhuǎn)變?yōu)楫惓@匣牡鞍踪|(zhì)。
研究表明,AGE受體RAGE(晚期糖基化終產(chǎn)物受體)通過結(jié)合和轉(zhuǎn)導(dǎo)多種炎癥配子,如AGEs、S100鈣調(diào)蛋白、高遷移率基團(tuán)等,調(diào)節(jié)炎癥、細(xì)胞凋亡、自噬、衰老等重要細(xì)胞過程。 box-1 蛋白 (HMGB.1)。中島等人注意到,在比較紅細(xì)胞膜上熒光物質(zhì)標(biāo)記的糖基化蛋白和膜蛋白的數(shù)量時(shí),老年個(gè)體紅細(xì)胞的熒光程度明顯高于年輕個(gè)體。非酶糖基化產(chǎn)品還可以通過一系列變化加速身體衰老,例如增強(qiáng)脂質(zhì)過氧化。
炎癥性衰老和卵巢早衰(POI)
根據(jù)歐洲人類生殖與胚胎學(xué)會(huì)的新指南,POI被定義為女性在40歲之前卵巢活性喪失,且促性腺激素升高和雌激素減少。
POI的診斷需要同時(shí)出現(xiàn)月經(jīng)異常和生化異常:月經(jīng)稀發(fā)/閉經(jīng)至少4個(gè)月且FSH升高IU/L兩次(相隔4周)。患者包括40歲以下的女性(包括特納綜合癥患者)和40歲以上的女性,但老年患者必須在40歲之前受到影響。
主要臨床表現(xiàn)為閉經(jīng),還伴有潮熱、出汗、性欲減退等更年期癥狀。嚴(yán)重者甚至?xí)?dǎo)致不孕,極大影響女性生殖功能。
POI的病因和發(fā)病機(jī)制非常復(fù)雜。涉及大量外源因素,如手術(shù)、藥物、環(huán)境,以及內(nèi)源因素,如染色體連鎖缺陷、自身免疫反應(yīng)、心理壓力、遺傳傾向和先天性酶缺乏。國(guó)內(nèi)外大量研究證實(shí)TNF-?α和IL-6可能在卵巢功能中發(fā)揮作用,因此炎癥因子可能是POI的重要原因。因此,本文將從以下幾個(gè)角度探討炎癥衰老與POI的關(guān)系。
炎癥細(xì)胞因子和抗炎因子導(dǎo)致卵巢變化
近年來,炎癥衰老在卵巢疾病中的作用引起了人們的高度關(guān)注,其中卵泡破裂被認(rèn)為是一種炎癥反應(yīng),而IL-1和TNF-α是參與這一過程的主要細(xì)胞因子。
有報(bào)道稱,女性生殖道黃色肉芽腫性炎癥的異常表現(xiàn)是一種POI。這表明炎癥衰老可能是POI的原因之一。Th1細(xì)胞(T輔助細(xì)胞的一種)介導(dǎo)的免疫反應(yīng)通常與炎癥反應(yīng)相關(guān)。抑制素-α對(duì)實(shí)驗(yàn)性自身免疫性卵巢炎癥的靶向作用是由 CD4 (+) Th1T細(xì)胞啟動(dòng),通過刺激B細(xì)胞產(chǎn)生抑制素-α中和抗體,直接介導(dǎo)POI并將疾病轉(zhuǎn)移至初始受體。
許多參與免疫反應(yīng)和炎癥反應(yīng)的分子均受核因子-κ基因結(jié)合(NF-?κB)的調(diào)節(jié),其中包括TNF-?α、IL-1β?、?IL-2、IL-6和集落刺激因子。
因此,炎癥細(xì)胞因子水平升高和抗炎細(xì)胞因子水平降低在POI中發(fā)揮著關(guān)鍵作用(圖2)。
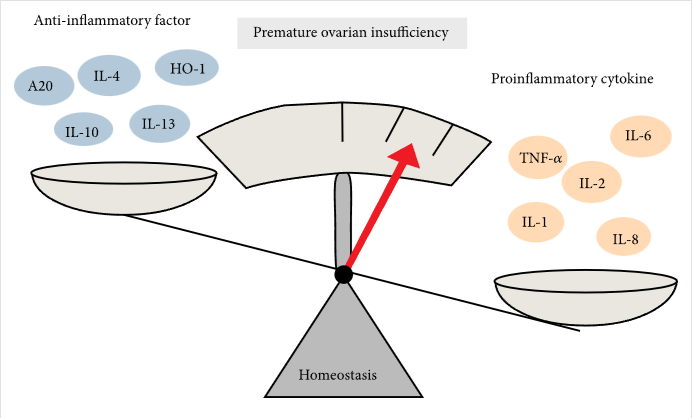
卵巢早衰的病理性炎癥是由炎癥細(xì)胞因子網(wǎng)絡(luò)失衡引起的。
卵巢衰老和逆轉(zhuǎn)過程中炎癥因子的變化
納茲等人利用ELISA檢測(cè)POI患者和正常女性的炎癥因子水平,發(fā)現(xiàn)POI患者TNF-α的值低于正常女性。Wang等人與此結(jié)果一致。研究表明,POI患者的透明帶抗體(AzpAb)水平顯著高于正常對(duì)照,且TNF-α和IL-2水平顯著下降,而INF-γ顯著升高。POI組血清中TNF-α、IL-2水平顯著低于正常組,可能與TNF-?α有關(guān)由淋巴細(xì)胞和粒細(xì)胞分泌,而POI患者由于卵巢組織萎縮和粒細(xì)胞減少,血清中相關(guān)炎癥因子水平降低。這證實(shí)了POI與炎癥衰老之間的關(guān)系。
因此,修復(fù)受損的卵巢功能后,炎癥因子的水平應(yīng)該會(huì)降低。最近的研究表明,滑膜間充質(zhì)干細(xì)胞(SMSCs)可能在恢復(fù)卵巢卵泡微環(huán)境中受損的卵巢中發(fā)揮作用。當(dāng)SMSCs用于治療小鼠時(shí),RT-PCR結(jié)果顯示促炎細(xì)胞因子的表達(dá)水平,如TNF-?α、TGF-?β、IL-8、IL-6、IL-1和IFNγ,顯著低于未治療對(duì)照組的卵巢。當(dāng)POI發(fā)生時(shí),某些炎癥因子的表達(dá)水平升高,而當(dāng)受損的卵巢功能修復(fù)時(shí),炎癥因子的水平相應(yīng)降低,這足以說明炎癥衰老與POI密切相關(guān)。
通過治療慢性炎癥來治愈卵巢早衰
顯然,炎癥衰老在POI的發(fā)病機(jī)制中起著重要作用,這表明我們可以通過抗炎來預(yù)防卵巢功能不全。賽義德等人發(fā)現(xiàn)白藜蘆醇通過增加血清抗米勒激素(AMH)水平和減輕卵巢炎癥來恢復(fù)卵巢功能,主要是通過上調(diào)過氧化物酶體增殖物激活受體和SIRT1(sirtuin-1)的表達(dá)來抑制NF-?κB?B誘導(dǎo)的炎癥細(xì)胞因子。這些發(fā)現(xiàn)表明炎癥因子如 IL-6 和 IL-8 的表達(dá)。這種機(jī)制可能是調(diào)節(jié)衰老信號(hào)的新方法:使用抗炎化合物來治療大腦,這可能能夠減緩與卵巢衰老相關(guān)的退化。
他等人研究了人參皂苷Rg1作用于D-半乳糖(D-gal)誘導(dǎo)的POI的作用和機(jī)制,發(fā)現(xiàn)Rg1可以增強(qiáng)抗炎和抗氧化作用。它還可以減少衰老信號(hào)通路蛋白的表達(dá),從而減少對(duì)卵巢的損傷,提高POI小鼠的生育能力。這項(xiàng)研究表明,控制炎癥衰老的發(fā)展可能是治愈 POI 的方法之一。目前,許多炎癥標(biāo)志物已被鑒定,如血漿腫瘤壞死因子、白細(xì)胞介素家族、血漿炎癥蛋白等,可用于監(jiān)測(cè)卵巢功能和治療POI。
干細(xì)胞被喻為“萬能細(xì)胞”,近年來頗為火熱,成為科學(xué)家們探索難治性疾病的新選擇。多項(xiàng)干細(xì)胞技術(shù)干預(yù)女性卵巢早衰的臨床結(jié)果表明:干細(xì)胞或可讓卵巢早衰女性恢復(fù)生育能力,改善更年期癥狀。
干細(xì)胞靶向修復(fù)卵巢的應(yīng)用機(jī)理
- ①干細(xì)胞定植于受損傷部位并進(jìn)行分化,部分補(bǔ)償或替代修復(fù)其功能;
- ②干細(xì)胞可通過修復(fù)卵巢間質(zhì),防止卵巢纖維化,從而對(duì)受損卵巢起到保護(hù)作用;
- ③干細(xì)胞自身可分泌多種細(xì)胞因子(如血管內(nèi)皮生長(zhǎng)因子、肝細(xì)胞生長(zhǎng)因子、類胰島素一號(hào)增長(zhǎng)因子等),抑制細(xì)胞凋亡,修復(fù)受損組織細(xì)胞;
- ④通過免疫調(diào)節(jié)作用,抑制機(jī)體免疫反應(yīng),促進(jìn)受損組織的自身修復(fù);
- ⑤干細(xì)胞進(jìn)入損傷卵巢后可能直達(dá)損傷部位,并部分分化成血管內(nèi)皮細(xì)胞,提供營(yíng)養(yǎng)支持。
南京大學(xué)醫(yī)學(xué)院附屬鼓樓醫(yī)院在臍帶間充質(zhì)干細(xì)胞復(fù)合膠原卵巢移植的方式治療卵巢早衰所致的不孕癥的研究結(jié)果表明:膠原/臍帶間充質(zhì)干細(xì)胞移植能夠改善患者的卵泡活化和卵泡生長(zhǎng),并有助于卵巢功能的長(zhǎng)期恢復(fù),包括卵巢血流和雌二醇水平。而且,有2例患者在移植后成功受孕。
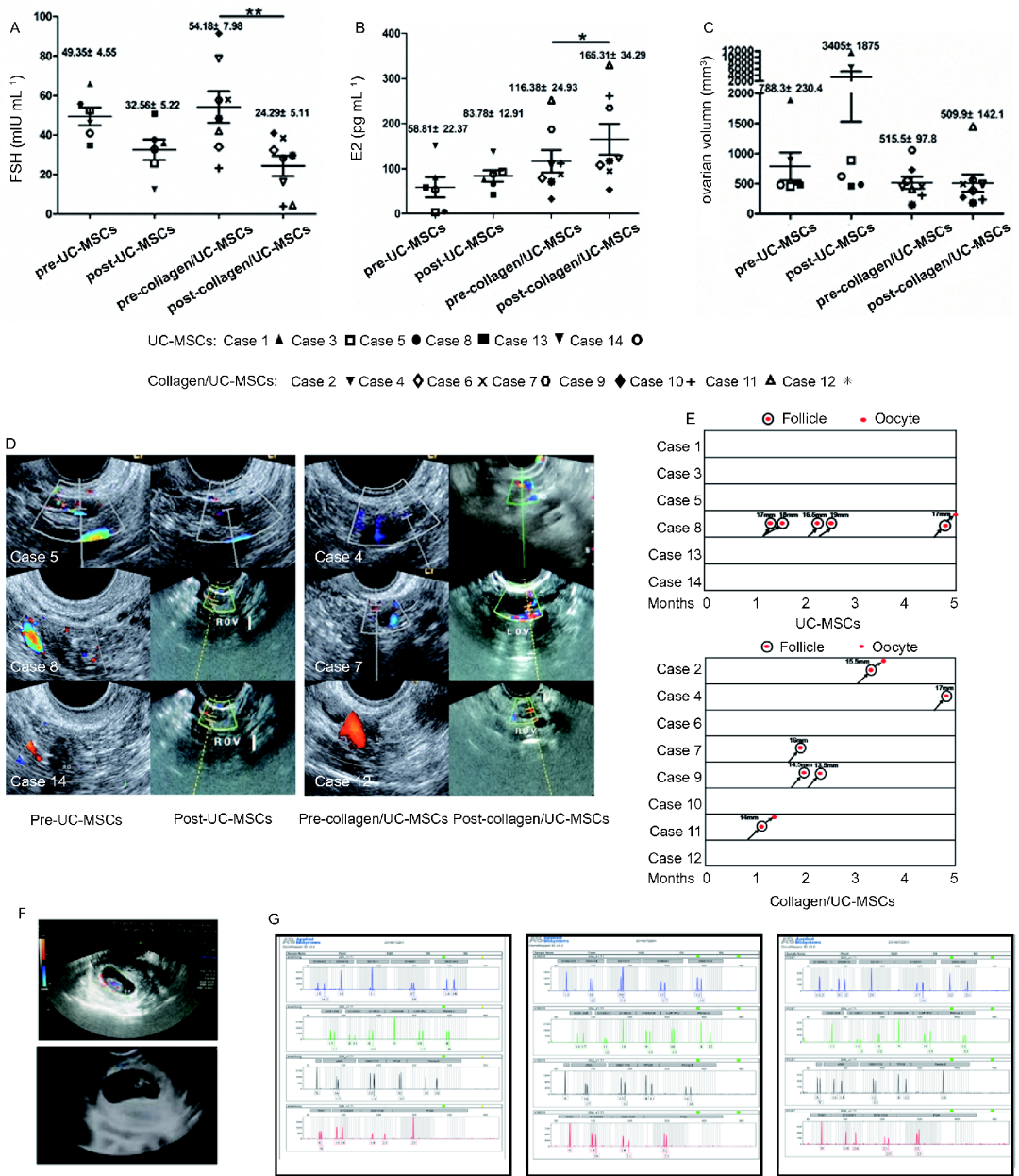
然而,由于POI的發(fā)生還有很多其他原因,其發(fā)病機(jī)制尚不清楚。有哪些抗炎治療或其他治療方法可以取得更顯著的效果?對(duì)于具有POI遺傳易感性的個(gè)體,抗炎治療的效果如何?POI可以通過抗炎治療來預(yù)防嗎?干細(xì)胞可以治療卵巢早衰嗎?所有這些問題都需要通過進(jìn)一步的研究來回答。
結(jié)論
POI不僅導(dǎo)致女性生殖內(nèi)分泌功能下降(甚至喪失),還可能影響女性的心理狀況和其他器官的功能。專家們?cè)谘装Y和生殖領(lǐng)域取得的成果,提高了我們對(duì)POI病因和發(fā)病機(jī)制的認(rèn)識(shí),也為保護(hù)卵巢功能、延緩衰老、提高女性生育能力提供了有用的信息。然而,炎癥介導(dǎo)的衰老的調(diào)節(jié)機(jī)制仍不清楚,需要進(jìn)一步研究來解決一些問題,特別是一些抗衰老物質(zhì)(如GnRH)的機(jī)制。
綜上所述,未來的研究應(yīng)重點(diǎn)解決幾個(gè)問題:(1)如何確定炎癥衰老的具體調(diào)控機(jī)制?(2)如何確定炎癥衰老引起的POI的調(diào)控網(wǎng)絡(luò)和關(guān)鍵節(jié)點(diǎn)?(3)如何預(yù)防炎癥老化的發(fā)生?如何制定針對(duì)性的治療方法來治療慢性炎癥并預(yù)防卵巢早衰?(4)POI的遺傳易感性可以通過抗炎治療來治療嗎?(5) 抗炎藥預(yù)防 POI 的效果如何?有什么不良影響嗎?
隨著生殖醫(yī)學(xué)的發(fā)展,POI的發(fā)病機(jī)制和機(jī)制將會(huì)得到更好的了解。此外,預(yù)防POI和恢復(fù)女性生殖功能也將成為國(guó)內(nèi)外研究者的研究熱點(diǎn)。無論如何,抗炎衰老將成為預(yù)防和治療POI的重要策略。
參考資料:
Yaoqi Huang, Chuan Hu, Haifeng Ye, Ruichen Luo, Xinxin Fu, Xiaoyan Li, Jian Huang, Weiyun Chen, Yuehui Zheng, “Inflamm-Aging: A New Mechanism Affecting Premature Ovarian Insufficiency”,?Journal of Immunology Research, vol. 2019, Article ID 8069898, 7 pages, 2019. https://doi.org/10.1155/2019/8069898
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。




 掃碼添加官方微信
掃碼添加官方微信