卵巢早衰(POF)作為全球女性生殖健康面臨的重大挑戰,其高發性與年輕化趨勢已引發廣泛關注。傳統治療策略長期依賴激素替代療法和輔助生殖技術,但其療效受限且伴隨長期用藥風險。近年來,隨著再生醫學、精準醫療及多組學技術的突破性進展,卵巢功能修復技術正邁入精準化、個性化的新紀元。
本文系統梳理截止到2025年10月底卵巢早衰的5種最新治療方法進展,涵蓋:干細胞治療、富血小板血漿技術、生物靶向治療、人工智能與生物標志物以及輔助生殖技術這5種前沿臨床突破。這些技術為POF患者提供了從“癥狀緩解”到“功能重建”的全新解決方案,為卵巢早衰患者帶來新的治愈希望。
2025卵巢早衰前沿治療指南:5種最新治療方法搶先看
一、干細胞療法的臨床轉化
1.1 人羊膜上皮干細胞移植治療
2024年8月,海交通大學醫學院附屬國際和平婦幼保健醫院賴東梅教授團隊在《eClinicalMedicine》在線發表題為人羊膜上皮干細胞經卵巢動脈移植治療卵巢早衰患者的安全性和有效性:單臂1期臨床試驗的研究成果。[1]
本研究是一項早期探索性單臂階段臨床試驗,證實了通過卵巢動脈進行人羊膜上皮干細胞(hAECs)移植在治療卵巢早衰患者是安全的、耐受性良好,并顯示初步有效性,是卵巢功能下降患者的潛在新的療法。

臨床試驗入組了35例POF受試者,每名受試者經雙側卵巢動脈共接受了單次6×107hAECs注射,并在治療后不同時間間隔進行隨訪評估,包括治療后大約1個月、3個月和5個月。
安全性與不良反應:研究顯示,5個月隨訪期內未出現嚴重不良反應。最常見的輕微不良反應包括局部血腫(20%)、盆腔疼痛(11.43%)、發熱(5.71%)等,均通過治療緩解。
干細胞給藥首次嘗試了卵巢動脈注射新途徑,相比傳統方法(如原位注射),該方式不受卵巢大小或硬度限制,安全性良好。
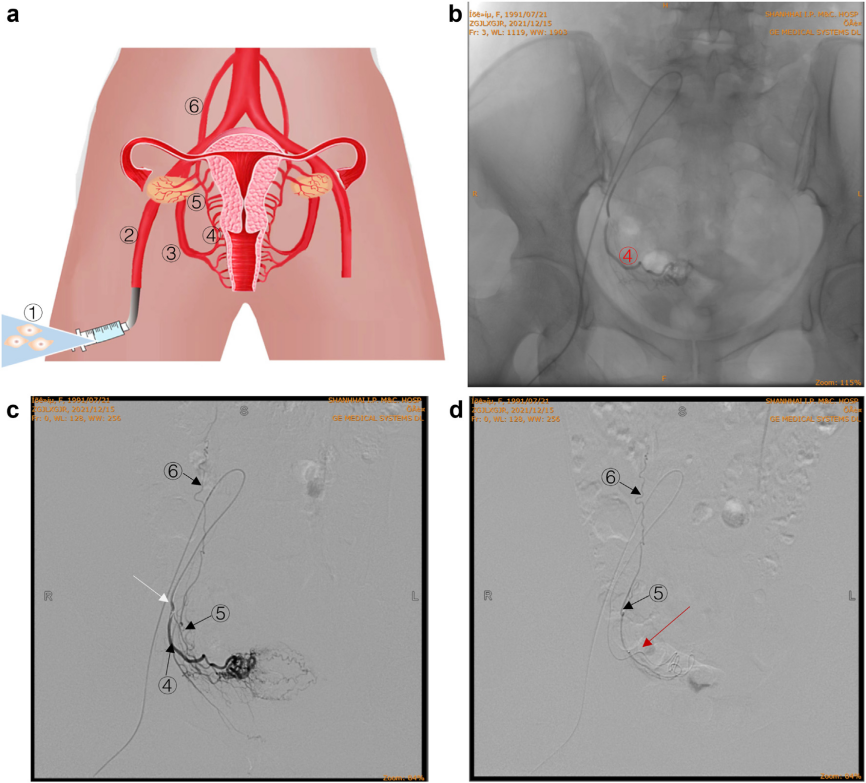
臨床療效:hAECs移植后,患者子宮內膜厚度、卵巢體積、激素水平(FSH/E2)及生活質量評分(MENQOL)顯著改善。37.14%患者恢復月經,7例實現規律月經。治療后1個月,有效組的AMH(卵巢功能關鍵指標)等核心指標均明顯提升。
此外,研究團隊開發了超敏AMH檢測方法(UD-AMH),可精準追蹤極低水平AMH變化。結果顯示,患者基線卵巢儲備(AMH水平)可能影響治療效果。盡管樣本量較小、隨訪時間有限,但該研究為卵巢早衰(POF)患者提供了安全有效的新型治療方向,未來需更大規模試驗進一步驗證。
1.2 間充質基質細胞治療
2025年4月12日,國際期刊《Stem Cell Research & Therapy》上發表了一篇關于《卵巢內注射自體月經血來源的間充質基質細胞:一種安全且有前景的提高卵巢反應不佳者妊娠率的方法》的文章顯示:向卵巢注射間充質干細胞可改變患者的生育結局,在這項涉及105位患者的研究里,干細胞成功讓超過三分之一的女性懷孕,每次妊娠活產率高達74.42%。[2]

本次研究納入了包括2018年8月至2021年9月之間接受自體干細胞給藥的105位患者。接受注射時她們的平均年齡為37.91歲。
在接受隨訪期間(平均時間為3.72年),共有38人成功懷孕,其中27人自然受孕,占比為25.7%,概率是PRP療法的三倍以上!13人通過IVF受孕(兩人通過不同方式懷孕),自然受孕的中位時間為治療后3個月,IVF受孕的中位時間為注射后5.5個月,最終一共誕生了32名嬰兒(其中一例為雙胞胎),每次懷孕活產率高達74.42%,且未發現嬰兒先天性異常或死亡的情況。
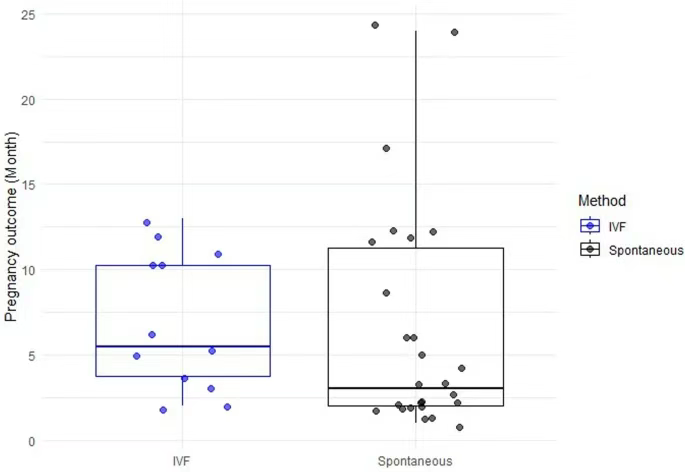
研究人員認為:年齡是其中的關鍵影響因素,在這100多位參與者當中,35歲以下的女性妊娠率為52.17%,35歲以上為31.7%。
安全性方面,近4年的隨訪時間里沒有發現明顯的長期問題,僅記錄了一例妊娠期間的卵巢囊腫,但未經干預就已經自行消退了,沒有發現子宮內膜異位癥、卵巢惡性腫瘤、扭轉、盆腔炎、異位妊娠或自身免疫性疾病的實例。
這些發現表明,對于卵巢反應不佳的女性而言,向卵巢注射經血來源的干細胞可能是一種安全且有效的的治療選擇。
相關閱讀:2025年干細胞療法治療卵巢早衰最新臨床進展匯總(截至5月)
二、富血小板血漿(PRP)技術的精準應用
富血小板血漿(PRP)治療卵巢早衰是一種利用患者自身血液中的活性成分(富含血小板的血漿)來改善卵巢功能的新技術。
2.1 富血小板血漿治療早發性卵巢功能不全
2025年7月14日, 印度尼西亞科研人員在《國際醫學病例報告雜志》上發表了一篇關于《富血小板血漿治療早發性卵巢功能不全:一系列IVF結果病例》的研究成果。[3]

案例1:一位25歲的未產婦,有宮外孕史,抗苗勒氏管激素 (AMH) 水平低于1 ng/mL,于月經周期第7至12天接受了兩次PRP注射。第一次注射后,她的AMH水平保持在<0.5 ng/mL。第二次注射PRP后,她的AMH水平升至>0.5 ng/mL。冷凍胚胎移植成功,并成功妊娠并誕下健康新生兒。
案例2:一位36歲的未生育女性,已婚七年,在接受相同的PRP和IVF方案后,也出現了POI,且AMH水平<1 ng/mL。經過兩次PRP治療后,她的AMH水平有所改善,與病例1類似。盡管最初懷孕,但患者還是經歷了流產。
研究結果表明,PRP可能改善接受IVF治療的原發性卵巢功能不全 (POI) 女性的卵巢反應。值得進一步研究。
2.2 富血小板血漿在卵巢復原中的功效
2025年1月18日,《國際醫學科學雜志》上發表了一項關于富血小板血漿 (PRP) 在卵巢復原中的功效的研究成果。[4]

本研究采用前瞻性觀察性設計,納入30名確診為卵巢早衰(POF)的女性。受試者接受自體PRP卵巢組織注射,并在六個月內監測其激素水平、竇卵泡計數(AFC)、排卵率和妊娠結局。
結果顯示,促卵泡激素(FSH)水平顯著降低,抗苗勒氏管激素(AMH)水平升高(平均升高20%)。60%的受試者卵泡發育得到改善,40%的受試者出現自然排卵,妊娠率為15%。
這些研究結果強調了PRP作為一種微創卵巢復原療法的潛力,為卵巢早衰(POF)女性帶來了希望。然而,療效的差異性凸顯了需要進行更大規模的隨機試驗來優化治療方案并確定其長期安全性和有效性。這項研究為PRP在生殖醫學中的應用提供了越來越多的證據,為不孕不育管理的創新解決方案鋪平了道路。
三、生物靶向治療的臨床突破
3.1 外源性褪黑素
2025年7月23日,《npj regenerative medicine》發表研究揭示了外源性褪黑素(Mel)通過調節顆粒細胞自噬緩解卵巢早衰(POF)的新機制。[5]

研究團隊通過D-半乳糖誘導的小鼠模型,結合網絡藥理學與分子對接技術,發現外源性褪黑素(Mel)能激活雌激素受體1(ESR1)介導的PI3K-AKT-mTOR信號通路,顯著提升卵巢雌激素分泌水平并改善組織病理狀態。實驗顯示Mel處理可增強顆粒細胞線粒體功能,上調自噬標志物LC3-II/LC3-I和Beclin1表達,同時降低促凋亡因子p62水平,從而促進細胞自噬并抑制凋亡。
機制研究進一步揭示,Mel通過上調ESR1表達并抑制PI3K、AKT、mTOR蛋白的磷酸化活性,精準調控自噬相關通路關鍵節點。交叉靶點篩選與富集分析證實ESR1是Mel作用的最適靶點,其調控作用在GO和KEGG分析中均呈現顯著富集特征。該研究為POF治療提供了”自噬調控-信號通路干預”的新策略,并闡明了Mel通過多靶點機制改善卵巢功能的分子基礎。
3.2 CCDC134-INHA軸
2025年3月5日,山西醫科大學附屬兒童醫院牽頭在期刊《Apoptosis》上發表了一篇關于《CCDC134 通過與卵巢早衰小鼠模型中的INHA直接相互作用來增強卵巢儲備功能和血管生成》的研究成果。[6]

研究利用順鉑誘導的POI小鼠模型,發現患者及模型動物卵巢顆粒細胞中CCDC134表達顯著下調。通過AAV介導的卵巢特異性CCDC134過表達治療,不僅恢復了卵泡發育各階段形態,還逆轉了AMH/E2水平下降和FSH/LH異常升高的激素失衡狀態,同時通過抑制Caspase-3/Bax促凋亡通路并激活Bcl-2抗凋亡基因,顯著減少顆粒細胞凋亡。
機制研究進一步表明,CCDC134可直接與抑制素α亞基(INHA)結合形成復合物,通過上調INHA表達促進血管生成通路活化,表現為CD34/vWF標志物表達增強、內皮細胞活力提升及VEGF水平恢復。
該研究首次揭示CCDC134-INHA軸在維持卵巢儲備和血管生成中的核心作用,為POI治療提供了新型靶向干預策略,其通過雙重調控凋亡與血管生成的協同機制具有重要臨床轉化價值。
四、人工智能與生物標志物的精準監測
4.1 miRNA療法
2025年7月15日,廣西中醫藥大學在《Stem Cell Research & Therapy》上發表了一篇關于《卵巢早衰的潛在 miRNA 療法:新的挑戰和機遇》的研究成果。[7]

研究表明,miRNA療法通過多靶點調控為卵巢早衰(POF)提供了新思路,尤其外泌體miRNA(如miR-21-5p)和干細胞來源miRNA(如miR-126)在抑制卵泡凋亡、調節微環境方面表現出顯著潛力。
然而,其臨床應用面臨三大難題:安全性風險(脫靶效應、免疫反應)、遞送效率低(難以精準靶向卵巢)及模型與人類差異(動物模型無法完全模擬復雜病因)。
研究認為,結合多組學數據與新型遞送技術,miRNA療法有望成為卵巢早衰個性化治療的重要突破口,為女性生育力保存提供革新性方案。
4.2 腸道菌群
2025年7月15日,吉林大學第二醫院在《Front. Microbiol》上發表了一篇關于《腸道菌群:卵巢早衰的新興生物標志物和潛在治療方法》的研究成果。[8]

研究發現,GM功能紊亂不僅加速卵泡耗竭進程,還與患者精神心理障礙、骨質疏松及自身免疫性疾病等并發癥密切相關。通過分析GM代謝產物及其信號通路,團隊提出GM可通過調節炎癥反應、激素代謝和免疫穩態影響卵巢功能,為精準干預提供了理論依據。
該研究為POF診療提供了從“腸道-卵巢軸”切入的創新路徑,但需進一步臨床試驗驗證其療效與安全性。
4.3 可預測卵巢功能AI模型
2025年7月20日,日本東京大學發布新聞公報稱,該校研究人員參與的團隊成功開發出一款可預測卵巢功能的人工智能(AI)模型,能夠通過簡單的問診和少量采血數據預測女性卵巢功能,有望為備孕和不孕癥治療提供支持。[9]
卵巢功能低下是導致不孕癥的重要原因之一,目前廣泛使用抗繆勒管激素檢查來評估女性卵巢儲備功能、反映剩余卵泡數量。
東京大學等機構的研究人員開發的AI模型通過分析年齡、月經周期等問診信息及一次少量采血的血液檢測數據,可同時預測卵泡數量與質量。在卵泡數量預測方面,其準確度比抗繆勒管激素檢查要高。這種AI模型首次實現了對卵泡質量的預測,填補了該領域臨床評估手段的空白。
公報說,這種AI模型可幫助備孕女性提前了解卵巢功能,做好孕前保健,也可為不孕癥患者制定適合個人情況的最優治療方案,提升輔助生殖成功率。研究人員未來計劃推動這種AI模型的臨床應用。
五、輔助生殖技術的智能化升級
新型輔助生殖體系
2025年2月18日,廣東省人民醫院生殖醫學科廣灣新址正式啟用,其備受關注的全國首創”卵巢功能提升門診”在開診半年后同步遷入新址。該中心通過智能化升級構建新型輔助生殖體系,顯著提升卵巢早衰診療效能。[10]

中心配備動態胚胎培養箱(每5分鐘自動記錄胚胎發育影像)、AI環境污染物預警系統及激光輔助孵化儀(千分之一秒級精準操作),實現胚胎發育全程實時監測與個性化干預。創新推出”掌上胚胎可視化”服務,患者可通過專屬平臺實時查看胚胎發育進程。
占地3000平方米的智能化生殖中心整合國際級胚胎實驗室和多系統診療設備,通過一站式流程設計(涵蓋B超、抽血、取藥等環節)將卵巢功能檢測效率提升至2小時內完成。該體系為18-48歲卵巢早衰患者提供精準化、高效化的生殖健康管理方案,標志著輔助生殖技術向智能化、精細化方向邁出關鍵一步。
結語
2025年的卵巢早衰治療研究呈現出多維度突破:干細胞療法通過修復受損組織實現卵巢功能再生,PRP技術以微創手段激活休眠卵泡,生物靶向藥物精準調控細胞信號通路,AI模型與多組學監測實現治療方案動態優化,而輔助生殖技術的智能化升級進一步提升臨床轉化效率。
值得關注的是,這些進展不僅體現在療效提升,更通過機制創新和技術融合,為個性化治療奠定基礎。盡管部分技術仍需更大規模驗證,但整體趨勢已清晰展現:卵巢早衰治療正從“單一干預”走向“生物-智能-再生”的整合體系,為全球千萬患者帶來生育希望與健康重塑的可能。未來,隨著各種政策落地,這些前沿技術有望加速惠及臨床。
參考資料:
[1]Safety and efficacy of allogenic human amniotic epithelial cells transplantation via ovarian artery in patients with premature ovarian failure: a single-arm, phase 1 clinical trialWeng, Lichun et al.eClinicalMedicine, Volume 74, 102744
[2]Zafardoust, S., Didar, H., Ganagard, M.G. et al. Intra-ovarian injection of autologous menstrual blood-derived-mesenchymal stromal cells: a safe and promising method to improve pregnancy rate in poor ovarian responders. Stem Cell Res Ther 16, 171 (2025). https://doi.org/10.1186/s13287-025-04278-6
[3]https://www.tandfonline.com/doi/full/10.2147/IMCRJ.S527318?scroll=top&needAccess=true
[4]https://mdlearn.us/index.php/ms/article/view/39
[5]Zhou, Gh., He, Yf., Wang, Hl. et al. Exogenous melatonin alleviates premature ovarian failure by regulating granulosa cell autophagy. npj Regen Med 10, 35 (2025). https://doi.org/10.1038/s41536-025-00422-1
[6]Cui, X., Li, H., Zhu, X. et al. CCDC134 enhances ovarian reserve function and angiogenesis by directly interacting with INHA in a mouse model of premature ovarian insufficiency. Apoptosis 30, 1311–1330 (2025). https://doi.org/10.1007/s10495-025-02092-2
[7]Xinyue, W., Hongli, L., Chunhui, G. et al. Potential MiRNA therapies for premature ovarian failure: new challenges and opportunities. Stem Cell Res Ther 16, 364 (2025). https://doi.org/10.1186/s13287-025-04514-z
[8]https://www.frontiersin.org/journals/microbiology/articles/10.3389/fmicb.2025.1606001/full
[9]https://news.cctv.com/2025/07/21/ARTItYZ5NHkZCb2fJkYwmUAn250720.shtml
[10]https://www.toutiao.com/article/7472762837232779776/?upstream_biz=doubao&source=m_redirect
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信