1型糖尿病是一種自身免疫性疾病,患者體內的免疫系統會錯誤地攻擊并摧毀胰腺中負責生產胰島素的β細胞。由于胰島素是調節血糖的關鍵激素,β細胞的永久性損傷導致患者必須終身依賴外源性胰島素注射。然而,傳統的胰島素替代療法并不能根治疾病,患者仍面臨各種并發癥的風險。
近年來,隨著再生醫學的飛速發展,干細胞治療技術為1型糖尿病的根本性治療帶來了突破性的曙光。那么,干細胞究竟是如何修復受損的胰島β細胞呢?本文將為您詳細解讀其的機制、臨床實踐及其未來前景等方面,讓您清楚了解其在1型糖尿病治療中的潛力。
一、什么是胰島β細胞?它為什么對1型糖尿病非常重要?
胰島β細胞是位于胰腺內的特殊細胞群,主要分布在胰島(Langerhans氏島)中。它們的核心功能是感知血糖變化并分泌胰島素,胰島素是調節血糖水平的關鍵激素。簡單來說,β細胞就像人體的“血糖調節器”,負責讓血糖保持在安全范圍內。
在1型糖尿病中,患者的免疫系統錯誤地攻擊和破壞胰島β細胞,導致胰島素嚴重缺乏或完全喪失。沒有足夠的胰島素,血糖無法被有效降低,患者就必須依賴外源性胰島素注射來維持生命。β細胞的永久性損傷是1型糖尿病發病的根本原因,因此,保護或修復β細胞功能被認為是治愈1型糖尿病的關鍵目標。
換句話說,β細胞健康與否,直接決定了血糖控制能力和糖尿病并發癥的風險。恢復β細胞功能,才能從根本上改變1型糖尿病患者的生活。
二、干細胞治療是什么?
干細胞是一類具有自我復制能力并能分化為多種細胞類型的“萬能細胞”。根據來源不同,干細胞可分為胚胎干細胞(ESC)、誘導多能干細胞(iPSC)以及成體干細胞。
在疾病治療中,干細胞不僅可以替代受損細胞,還能通過分泌生長因子和免疫調節分子,改善組織微環境,促進損傷組織的修復和功能恢復。
在1型糖尿病治療中,干細胞的應用不僅僅局限于單純替換受損的β細胞。它們還能通過調節患者體內的免疫環境,減少自身免疫對β細胞的攻擊,為長期治療創造條件。正是這種雙重作用,使得干細胞在1型糖尿病研究中備受關注。
三、干細胞治療是如何修復β細胞的?
干細胞修復β細胞的機制主要可以分為以下3個方面:
1.分化為功能性β細胞:在實驗條件下,干細胞可以被誘導分化為具有胰島素分泌功能的β樣細胞。這些新生成的β細胞能夠感知血糖水平并分泌胰島素,從而部分替代受損的內源性β細胞功能。這一過程類似于“補充缺失的工廠”,為患者恢復血糖調節能力提供了可能。
2.免疫調節作用:干細胞能夠分泌多種免疫調節分子,抑制自身免疫反應。這意味著它們不僅修復β細胞,還能降低免疫系統對新生成β細胞的攻擊風險,從而延長治療效果。
3.促進內源性修復:干細胞還能釋放多種生長因子和細胞外囊泡,激活殘余的β細胞再生潛力,改善胰腺微環境。這種“激活自身修復”的機制,使得干細胞不僅是替代者,更是修復和促進內源功能恢復的助力者。
通過以上三種方式,干細胞在理論上可以同時解決β細胞缺失和自身免疫攻擊兩個關鍵問題,為1型糖尿病的治療提供了全新的思路。
四、臨床實踐:從基礎研究到臨床轉化
間充質干細胞治療對1型糖尿病胰島β細胞的結構和功能恢復研究
印度尼西亞科研人員曾在《Veterinary World》雜志上發表過一篇名為《間充質干細胞條件培養基誘導1型糖尿病胰島β細胞的結構和功能恢復》的研究成果。[1]該研究旨在評估人臍帶間充質干細胞來源的條件培養基(CM)對1型糖尿病胰島β細胞的修復作用。

實驗結果顯示,首次注射CM后,1型糖尿病的胰島數量有所減少,胰島素水平也偏低。然而,隨著CM注射次數的增加以及誘導時間的延長,胰島的數量和大小逐漸恢復,免疫組化分析顯示胰島素陽性細胞的數量和染色強度明顯增強。同時,血液中胰島素水平也顯著上升,顯示其功能得到改善。
綜合來看,這項研究提供了有力證據,證明人臍帶間充質干細胞來源的CM不僅能夠在結構上促進胰島β細胞的恢復,還能在功能上改善胰島素分泌,從而為1型糖尿病的干細胞衍生治療提供了重要實驗依據。
臨床實踐:干細胞修復1型糖尿病胰島β細胞的突破性案例
2024年9月,國際權威期刊《細胞》刊登了一項突破性成果:中國研究團隊利用化學重編程干細胞技術,成功讓一位1型糖尿病患者實現 “功能性治愈”。這項由沈中陽、鄧宏魁團隊主導的臨床研究,為全球糖尿病治療撕開了一道希望的裂縫。[2]

這位25歲的天津女性患者,自14歲確診1型糖尿病后,便陷入了與胰島素深度綁定的生活。
11年間,她的血糖如同過山車,嚴重低血糖發作成了家常便飯。更曲折的是,她先后經歷了兩次肝移植(2014、2016 年)和一次全胰腺移植(2017年),卻因血栓并發癥不得不切除胰腺,只能重新依賴胰島素注射。長期的免疫抑制治療和血糖失控,讓她的生活布滿陰霾。
2023年,患者進行了干細胞治療手術,將化學重編程的多能干細胞分化成胰島β細胞,植入她的體內。
奇跡發生了,在移植后75天開始實現持續的胰島素依賴。患者的血糖達到目標范圍時間從基線值的43.18%增加到移植后第4個月的96.21%,同時糖化血紅蛋白 (長期全身血糖水平處于非糖尿病水平的指標) 下降。
此后,患者的血糖控制穩定,血糖達到目標范圍時間>98%,糖化血紅蛋白約為5%。1年后,臨床數據符合所有研究終點,未發現移植相關異常。
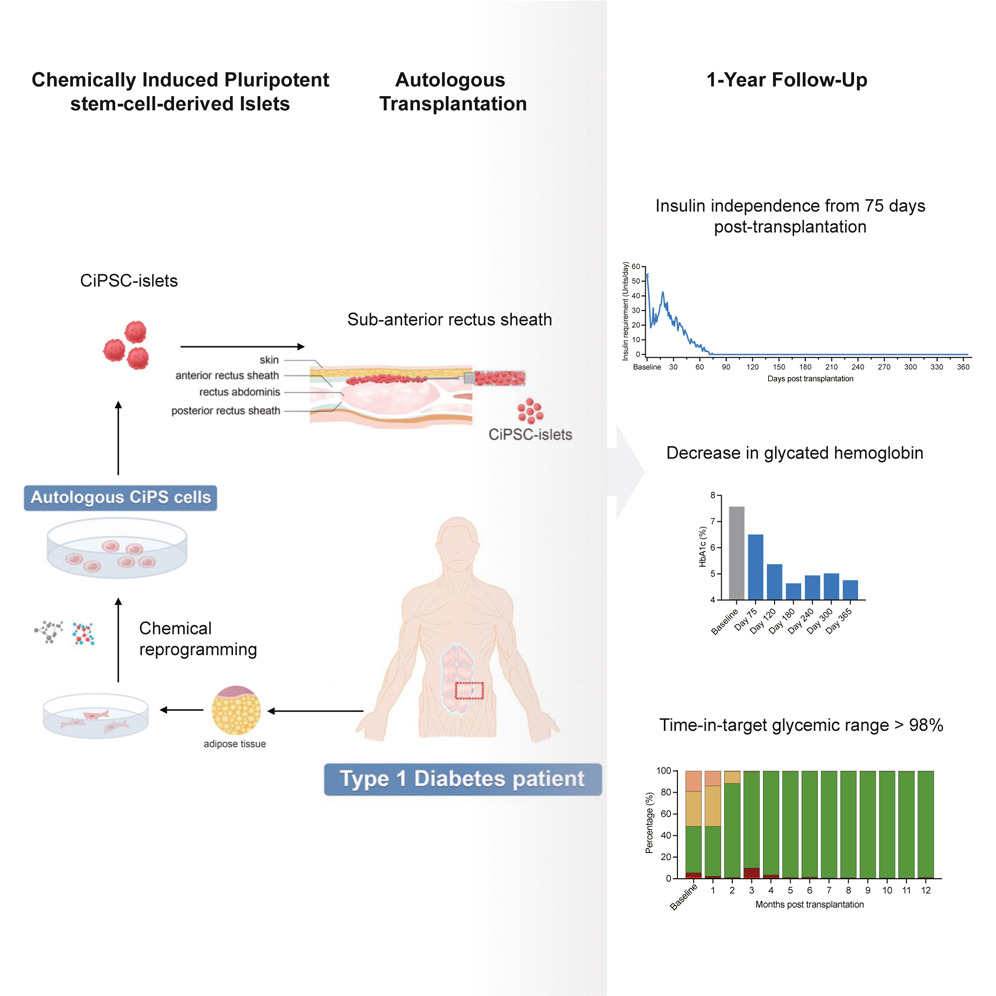
研究表明,化學誘導多能干細胞衍生的胰島β細胞能夠有效修復受損的胰腺功能,實現糖尿病患者體內胰島素自我分泌的恢復。
這不僅是科學上的突破,更為患者帶來了生活質量的根本改善。患者本人在接受采訪時表示:“我現在可以自由飲食了,尤其喜歡火鍋。”這場干細胞治療不僅重建了她的胰島功能,也徹底消除了對糖尿病并發癥的恐懼,為她的人生帶來了全新的開始。
五、未來前景
隨著干細胞技術和基因編輯技術的不斷進步,未來1型糖尿病的干細胞治療有望實現更為理想的目標:
完全替代胰島素治療:通過干細胞衍生β細胞或修復內源性β細胞,實現自主胰島素分泌,從根本上解決血糖控制問題。
個性化治療方案:利用患者自身細胞生成iPSC,可減少免疫排斥,提高療效,使治療更加精準化。
聯合療法發展:將干細胞治療與免疫干預、基因療法相結合,有望形成1型糖尿病根治的新模式,開啟全新的治療時代。
隨著研究的深入與技術的成熟,這一領域的突破或將徹底改變1型糖尿病的治療格局,為患者帶來真正的“治愈”希望。
結語
干細胞治療為1型糖尿病提供了前所未有的治療思路。從實驗室研究到早期臨床嘗試,干細胞在修復β細胞、調節免疫及改善血糖控制方面展現出巨大的潛力。雖然距離廣泛臨床應用還有一定距離,但隨著技術成熟與安全性驗證,干細胞療法有望成為1型糖尿病患者的新希望,實現從血糖管理到疾病根治的跨越。
參考資料:
[1]Nugroho WS, Kusindarta DL, Susetya H, Fitriana I, Mulyani GT, Fibrianto YH, Haryanto A, Budipitojo T. The structural and functional recovery of pancreatic β-cells in type 1 diabetes mellitus induced mesenchymal stem cell-conditioned medium. Vet World. 2016 May;9(5):535-9. doi: 10.14202/vetworld.2016.535-539. Epub 2016 May 29. PMID: 27284233; PMCID: PMC4893728.
[2]Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patientWang, Shusen et al.Cell, Volume 187, Issue 22, 6152 – 6164.e18
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信