阿爾茨海默病、帕金森病和亨廷頓病等神經退行性疾病目前影響著全球數千萬人。不幸的是,隨著世界人口的老齡化,許多此類疾病的發病率將持續上升,預計到2050年將增加一倍以上。盡管開展了大量研究,人們對疾病發病機理的認識也在不斷加深,但目前只有少數幾種療法可供選擇,而且所有這些療法都只能帶來短暫的益處。因此,我們迫切需要開發新型的疾病改變療法,以預防這些使人衰弱的疾病的發生或延緩其進展。
越來越多的臨床前研究表明,移植神經干細胞(NSCs)可為神經變性提供一種前景廣闊的新療法。雖然人們最初對這一策略的興奮點主要集中在利用神經干細胞替代退化的神經元,但最近的研究表明,神經干細胞介導的神經營養素變化是一種主要的療效機制。
神經干細胞治療神經退行性疾病:神經營養支持的作用
在這篇綜述中,我們將討論最近的研究成果,這些成果研究了在神經變性模型中,神經干細胞移植為受疾病影響的神經元群和突觸提供營養支持的能力。然后,我們還將討論神經干細胞移植在神經退行性疾病療法轉化為潛在臨床試驗之前仍然存在的一些關鍵挑戰。
神經干細胞移植是治療神經退行性疾病的可行方法嗎?
研究人員最初假設,只有在涉及相對局灶性神經變性的疾病中,才有可能實際開發出神經干細胞治療方法。
例如,帕金森病的主要特征是黑質底部多巴胺能神經元的喪失,它是開發神經元替代范例的絕佳候選疾病。雖然這種方法的發展仍在繼續,但神經元替代的概念已被證明比最初預期的要復雜得多。例如,移植的干細胞需要在成人大腦中存活,并從最初的小注射點遷移到目標區域。然后,它們需要高保真地分化成適當的神經元亞型,如多巴胺能神經元。也許最具挑戰性的是,這些移植細胞需要投射到適當的靶神經元,并形成適當的突觸連接。
在帕金森病領域,這導致大多數研究將細胞移植到多巴胺能神經支配的目標紋狀體,而不是受疾病影響的神經元通常所在的黑質。其他神經退行性疾病的病理變化更為廣泛,多個腦區的不同神經元亞型都會缺失,如AD,因此這種神經元替代范式變得更具挑戰性。那么,神經干細胞如何才能成為治療這些更復雜的神經退行性疾病的合理療法呢?
正如我們將討論的,最近的研究表明,臨床前模型中神經干細胞移植后一些最深刻的恢復可能是通過神經營養系統的調節來介導的。事實上,越來越多的研究發現,神經干細胞分化成支持性神經膠質亞型,例如星形膠質細胞,可以產生關鍵的生長因子,影響突觸可塑性和神經元功能,并調節腦血管化和能量學,可能在功能恢復中發揮重要作用。圖1)。
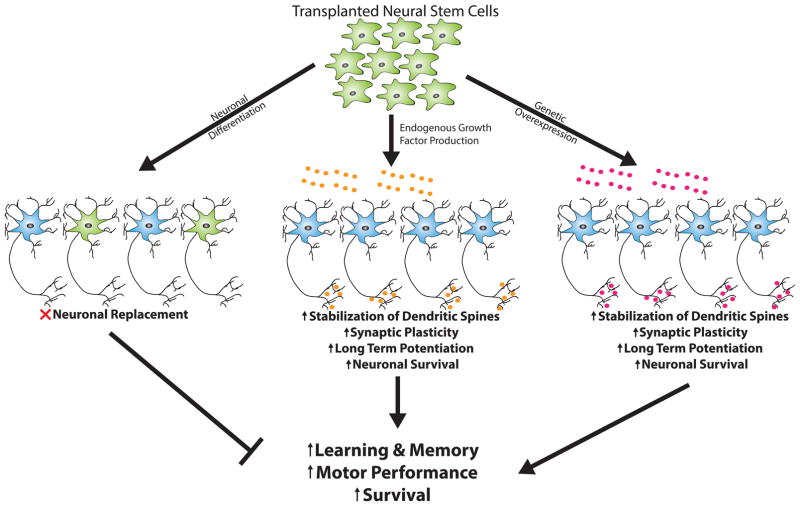
最初,許多人嘗試使用神經干細胞進行神經元替代,理論上認為神經元分化(神經元;綠色)后的細胞將與宿主神經元回路(藍色)整合,以替代在AD、PD或其他神經退行性疾病過程中死亡的神經元。然而,事實證明,實現這一目標的工作具有挑戰性,而且結果好壞參半。
最近的研究表明,神經營養因子(BDNF、GDNF、IGF-1、NGF)的內源性分泌(中心,橙色)或基因過度表達(右側,紫色)可能為基于神經干細胞的治療提供另一種可能更有前景的方法。移植的分泌神經營養因子的神經干細胞能夠增加突觸可塑性,增強長期增強作用,并促進神經元存活,從而改善認知和運動表現。
中樞神經系統疾病中的神經營養因子及潛在的治療方法
從半個多世紀前發現第一個神經營養因子–神經生長因子(NGF)開始,研究人員已經發現了大約50種能夠影響中樞和周圍神經系統細胞生長、存活和平衡功能的神經營養因子。在對中樞神經系統神經營養因子的研究中,最突出的是NGF、腦源性神經營養因子(BDNF)、膠質細胞系衍生神經營養因子(GDNF)和胰島素樣生長因子1(IGF-1)。這些神經營養素及其受體在人類和嚙齒類動物的中樞神經系統中均高度表達,研究表明這些因子在樹突棘的生長和穩定、突觸可塑性、長期電位、神經元和神經膠質細胞的存活以及學習和記憶等方面起著至關重要的作用。
許多最常見的神經退行性疾病都存在神經元和突觸缺失、認知障礙和炎癥等共性問題,因此研究人員推測,基于神經營養的療法可能會成功治療這些衰弱性疾病。然而,如果從外周給藥,這些神經營養因子中的許多都不能有效穿過血腦屏障,而且直接注射神經營養肽或通過基因療法過度表達神經營養肽迄今為止都存在重大缺陷和挑戰。由于間充質干細胞能產生多種神經營養因子并能廣泛遷移,許多研究小組已開始研究將其用作神經營養素的潛在遞送載體。
神經干細胞移植治療阿爾茨海默病
阿爾茨海默病是與年齡相關的神經變性的最常見病因,僅在美國就有500多萬人受到影響。阿茲海默癥的特征是記憶和認知能力逐漸喪失,導致無法進行日常活動,最終導致死亡。盡管阿爾茨海默病普遍存在,且早在100多年前就已被發現,但目前仍沒有針對阿爾茨海默病的疾病調節療法,目前批準的藥物只能緩解輕微癥狀,而不會顯著改變疾病的進程。
從病理學角度看,注意力缺失癥的特征是廣泛的突觸和神經元缺失、炎癥和兩種標志性蛋白質聚集,即由β-淀粉樣蛋白(Aβ)組成的斑塊和由高磷酸化tau組成的神經纖維纏結。目前流行的阿爾茨海默癥認為,淀粉樣蛋白的過度產生或清除障礙導致的淀粉樣蛋白聚集引發了一連串的病理事件,包括tau過度磷酸化、炎癥性膠質細胞病變以及突觸和神經元喪失。
盡管AD病理在整個大腦中廣泛存在,但某些對學習和記憶很重要的區域,如海馬體、內嗅皮層和基底前腦,比其他區域受到的影響更嚴重。重要的是,在AD患者和動物模型中觀察到神經營養蛋白表達減少和神經營養蛋白軸突運輸受損,并且可能在突觸和神經元損失中發揮重要作用。因此,恢復這些丟失的神經營養素是一個有吸引力的治療目標,特別是考慮到神經營養素在突觸可塑性、神經元健康以及學習和記憶中的既定作用。
我們的小組是最早證明神經干細胞移植在AD小鼠模型中提供神經營養支持方面的潛在益處的小組之一。我們發現將神經干細胞移植到老年阿爾茨海默病小鼠的海馬體中可以挽救海馬依賴性學習和記憶。我們進一步證明神經干細胞移植改善了海馬突觸密度,為改善認知提供了潛在的結構基礎。有趣的是,神經干細胞移植后淀粉樣蛋白和tau蛋白的水平沒有變化,這表明神經干細胞移植可能針對AD神經元功能障礙的下游方面,但也意味著這種方法可能為患有嚴重現有病理的患者帶來益處。
神經營養素與帕金森病
帕金森病是一種使人衰弱的神經退行性疾病,其特征是運動功能受損。患者經常表現出標志性運動表型,包括震顫、運動緩慢或過度僵硬以及啟動運動困難。不幸的是,高達70%的PD患者在病程中還會發展為帕金森病癡呆 (PDD)。雖然LevaDOPA等PD療法比目前可用于AD的療法要有效得多,但仍然沒有針對PD的疾病緩解療法,并且L-DOPA療法的有效性通常會隨著時間的推移而減弱,并導致越來越嚴重的副作用。
從病理學角度來說,PD的特點是黑質內多巴胺 (DA) 神經元的缺失,黑質是投射到紋狀體的中腦核,在運動的啟動和控制中發揮著不可或缺的作用。
由于帕金森病神經元缺失的相對局灶性,這種疾病被認為是干細胞療法的理想候選者,其目標是使用神經干細胞替代死亡和垂死的多巴胺神經元。
與AD類似,帕金森病的特征還在于關鍵大腦區域內神經營養因子支持的喪失。據報道,PD患者黑質內BDNF和GDNF均缺失,并且重要的是,BDNF和GDNF都與發育、生存和功能有關。中腦多巴胺神經元在 PD中退化。
其他一些研究也探討了將過表達GDNF或其他神經營養素的神經干細胞單獨移植到帕金森病動物模型中可能產生的有效療法。其中一項研究使用了類似的帕金森病病變模型,發現過表達GDNF的小鼠神經干細胞移植可防止黑質中DA神經元的退化,并減少行為障礙。為了將這些早期努力轉化為臨床試驗,Clive Svendsen及其同事領導的一系列研究還考察了經修飾以過度表達各種神經營養素的胎源性人類神經干細胞是否能夠保護DA神經元并挽救運動障礙。
總而言之,來自多巴胺細胞死亡動物模型的證據無疑支持產生神經營養素的神經干細胞治療帕金森病的潛在用途。然而,這些模型都沒有概括大多數人類患者中發現的α-突觸核蛋白病理學,而這些病理學可能在PD的發展中發揮重要作用。令人鼓舞的是,我們實驗室最近在突觸核蛋白病動物模型中發表的一份報告進一步支持了神經干細胞移植為帕金森病和其他突觸核蛋白病輸送神經營養素的潛在用途。
在這項研究中,我們發現移植產生BDNF的小鼠神經干細胞可以改善突觸核蛋白病轉基因模型中的運動和認知缺陷,并且BDNF的產生對于這些改善是必要的。
神經營養與亨廷頓氏病(HD)
亨廷頓舞蹈癥是一種顯性遺傳的進行性神經退行性疾病,會導致認知和運動功能受損,最終導致死亡。HD是由亨廷頓基因內三聯體重復 DNA序列的擴展引起的,導致產生含有擴大的致病性多聚谷氨酰胺束的突變蛋白 。HD癥狀通常在35-40歲左右開始,并不斷進展,最終導致癥狀出現后15-20年死亡。從病理學上講,HD患者表現出神經元和突觸損失,影響紋狀體的中型多刺GABA能中間神經元,但隨著疾病的進展,也會導致皮質和其他大腦區域的退化。
鑒于HD中發生的最初區域特異性變性,研究人員推測神經干細胞移植可能提供一種可行的治療方法。甚至在人類HD患者中進行了與PD類似的胎兒組織移植。然而,這些臨床研究的結果再次好壞參半,再次表明神經元替代范例仍然極具挑戰性。與PD和AD一樣,HD患者大腦中神經營養因子的表達顯著降低。此外,在HD神經毒素模型中,神經營養因子被發現對于紋狀體神經元的存活至關重要。
與在PD模型中測試的策略類似,在移植到HD動物模型之前,有幾個組在NSC系中過度表達了神經營養因子。
一項此類研究比較了過度表達NGF或BDNF的神經干細胞在亨廷頓舞蹈癥模型中挽救紋狀體神經元變性的能力。這項研究發現,表達NGF的神經干細胞可以挽救中型棘狀中間神經元和膽堿能紋狀體中間神經元,并減少炎癥跡象。
在本研究中,BDNF過度表達的神經干細胞對這些終點幾乎沒有影響。另一組使用亨廷頓舞蹈癥轉基因模型的報告發現,利用過表達GDNF的NSC得到了類似的結果。這項研究的作者發現,與未修飾的神經干細胞相比,過表達GDNF的神經干細胞不僅可以挽救紋狀體神經元的損失,而且還可以防止運動功能的下降。表明神經干細胞介導的神經營養因子的傳遞可以為HD提供有希望的潛在治療方法。
主要挑戰
最大的挑戰之一是所使用的方法和細胞的巨大差異。這一挑戰絕不是干細胞領域所獨有的,而是由于干細胞療法的復雜性以及不同干細胞系之間的許多固有差異而加劇。
結論
總而言之,本綜述中討論的研究已經開始深入了解神經干細胞移植作為多種神經退行性疾病的潛在療法的功效。許多神經干細胞移植研究最初集中于替代死亡或垂死的細胞,然而,越來越多的工作現在表明,神經干細胞介導的神經營養支持調節可能提供許多額外的重要益處。
盡管仍然存在許多挑戰和問題,但這篇綜述中詳細介紹的工作為 神經干細胞移植有一天可能為這一毀滅性的神經退行性疾病提供一種真正的疾病修飾療法帶來了希望。
參考資料:Marsh SE, Blurton-Jones M. Neural stem cell therapy for neurodegenerative disorders: The role of neurotrophic support. Neurochem Int. 2017 Jun;106:94-100. doi: 10.1016/j.neuint.2017.02.006. Epub 2017 Feb 20. PMID: 28219641; PMCID: PMC5446923.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信