引言:糖尿病療法的演進與挑戰
胰島素治療、胰島移植與干細胞療法代表了糖尿病管理的三種不同策略。自1921年胰島素問世以來,外源性胰島素注射已成為生存基石,但無法恢復生理性血糖調節,患者需終身應對低血糖風險與經濟負擔(美國年均支出$4,800-$6,000)。胰島移植雖能部分恢復內源性胰島素分泌,卻受限于供體短缺、需終身免疫抑制及高昂成本(單次>$100,000)。
干細胞療法的核心價值在于:通過分化功能性β細胞或免疫調節,靶向疾病根源。當前臨床數據顯示:
- 可減少或替代外源性胰島素(早期試驗中20%患者停用胰島素≥1年)
- 避免全身免疫抑制(微囊化技術達80%細胞存活率)
- 成本逐步優化(iPSC工藝使治療費降至$25,000-$50,000)
然而,其長期安全性及標準化生產仍是產業化關鍵瓶頸。
那么干細胞療法跟胰島素、胰島移植治療糖尿病有什么區別呢?
一、治療本質:對癥、替代與再生的根本差異
| 療法 | 作用機制 | 目標 | 臨床現狀 |
|---|---|---|---|
| 胰島素治療 | 外源性補充胰島素 | 控制血糖,預防急性并發癥 | 臨床金標準(百年應用) |
| 胰島移植 | 移植尸體來源胰島β細胞 | 部分恢復內源性胰島素分泌 | 實驗性治療(受限開展) |
| 干細胞療法 | 分化干細胞為功能性β細胞或調節免疫 | 重建胰腺功能,實現血糖自主調節 | 臨床研究階段(II/III期) |
核心差異:胰島素僅作為“生物替代品”緩解癥狀(治標),而干細胞與胰島移植致力于恢復人體自身血糖調節能力(治本)。但干細胞憑借無限擴增潛力,從根本上解決胰島移植的供體短缺問題。
二、療效對比:短期控制vs長期緩解
胰島素療法的困局
- 無法模擬生理性調節:需人工監測血糖+注射,即便使用智能泵仍存在15%低血糖風險;
- 并發癥延緩但未阻斷:微血管病變發生率仍達32%(DCCT研究);
- 經濟毒性:美國患者年均支出$4,800-6,000,14%人群耗竭40%以上收入購藥;
胰島移植的突破與局限
部分患者擺脫胰島素:移植后5年胰島素獨立率約50%(CIT Consortium數據)。
免疫排斥雙刃劍:需終身服用免疫抑制劑,機會性感染風險增加3倍;5年內移植胰島功能衰退率超60%。
干細胞療法的潛力
功能性治愈可能:臨床研究顯示移植干細胞可分化為葡萄糖響應性β樣細胞。
免疫豁免優勢:封裝技術避免全身免疫抑制(如ViaCyte的PEC-Direct裝置);間充質干細胞通過調節Treg細胞誘導免疫耐受。
三、成本效益分析:終身支出vs一次性投入
| 費用類型 | 胰島素治療 | 胰島移植 | 干細胞療法 |
|---|---|---|---|
| 初期治療成本 | 年均$5,000 | $100,000+ | $25,000-50,000 |
| 長期附加成本 | 持續監測/并發癥費用 | 終身免疫抑制劑 | 潛在二次輸注 |
| 中低收入國家可及性 | 僅13%患者用得起類似物 | 幾乎不可及 | 本地化生產后$8,000-12,000 |
經濟學悖論:干細胞療法雖初始成本高,但若實現5年以上胰島素獨立,成本將低于10年胰島素治療(按貼現率5%計算)。
四、技術瓶頸與創新方向
胰島移植的先天缺陷
- 供體危機:1例移植需3-4個尸體胰腺,全球年實施量不足千例;
- 肝內移植弊端:門靜脈栓塞風險達10%,胰島存活率低于30%;
干細胞療法的破局路徑
分化技術革新:CRISPR編輯提升PDX1/MAFA基因表達效率,生成葡萄糖敏感性β細胞
免疫保護方案:藻酸鹽微膠囊(如Sigilon的Afibromer?)阻斷抗體攻擊
可規模化生產:誘導多能干細胞(iPSC)實現“現成型”細胞庫
五、未來展望:三療法共存的精準醫療時代
2030年糖尿病治療格局預測:
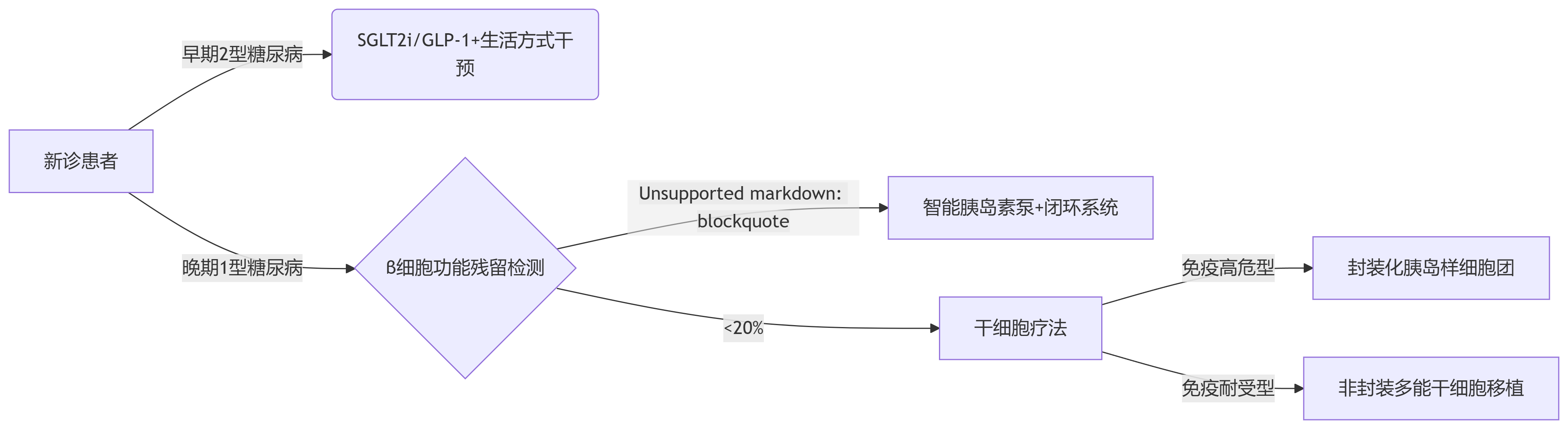
專家共識(根據ADA 2025白皮書):干細胞療法將優先用于C肽陰性、頻發低血糖的1型糖尿病患者,5年內有望替代30%的胰島素強化治療;而對胰島素敏感且控制良好的2型糖尿病患者,干細胞治療仍需長期安全性驗證。
核心結論
干細胞療法代表糖尿病治療的第三次革命——從胰島素的外部替代(1920s)、胰島移植的短期修復(2000s),邁向功能性治愈的新紀元。盡管當前面臨成本與標準化挑戰,其再生醫學本質已為根治糖尿病提供唯一可行路徑。隨著CRISPR基因編輯、細胞封裝技術的突破,2030年或將成為“擺脫胰島素針筒”的歷史轉折點。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信