糖尿病與干細胞治療前景:糖尿病 (DM) 是一種慢性代謝性疾病,其特征是由于胰島素生成或作用缺陷導致的持續性高血糖。
其主要類型為1型糖尿病 (T1DM,自身免疫性β細胞破壞) 和2型糖尿病 (T2DM,胰島素抵抗伴β細胞功能障礙),影響著全球數百萬患者,并導致嚴重并發癥。當前的胰島素替代療法和對癥管理無法解決潛在的細胞功能障礙,這推動了對再生醫學策略的探索,干細胞療法因此成為研究熱點。

最有希望的干細胞候選者包括具有免疫調節和再生潛力的間充質干細胞 (MSC),以及能分化為功能性β細胞的多能干細胞 (PSC)。
近年來,細胞重編程、分化方案和封裝技術的進步顯著改善了臨床前效果。盡管存在免疫排斥、細胞存活和安全性的挑戰,但正在進行的人體試驗,特別是針對MSC的研究,展現出將糖尿病管理從控制癥狀轉向潛在治愈的希望。基因編輯和組織工程等新興技術有望進一步提升療效。
干細胞治療糖尿病有效嗎?17項薈萃分析超8000+患者數據證實顯著降低血糖、減少胰島素依賴
2025年7月,國際著名期刊雜志《Tissue and Cell》發表了一篇“間充質干細胞治療糖尿病:綜述”的文章綜述[1]。

綜述研究結果表明:該綜述納入了17篇系統綜述和薈萃分析,涵蓋超過8,000名患者。MSC療法顯著改善了血糖控制,尤其是在2型糖尿病(T2DM)中,糖化血紅蛋白(HbA1c)降低(最高可達1.45%),胰島素需求量降低(最高可達2.05單位/千克/天)。
在1型糖尿病(T1DM)中,間充質干細胞療法改善了C肽水平和糖化血紅蛋白(HbA1c),但對胰島素依賴性的影響各不相同。華通氏膠衍生的MSC和骨髓衍生細胞表現出優異的療效,而臍帶血衍生的MSC療效較差。不良事件通常較輕(例如發燒、注射部位反應),嚴重事件罕見,且與聯合療法有關。
研究目的與方法
本綜述系統整合間充質干細胞(MSC)療法治療糖尿病的有效性及安全性證據,重點剖析其臨床療效、作用機制及突破傳統治療局限的潛力。本綜述整合了截至2025年7月30日的相關系統綜述與薈萃分析(傘狀綜述)。研究依據PRISMA指南檢索PubMed/MEDLINE、Scopus及Web of Science數據庫。
納入標準限定為評估MSC療法治療T1DM/T2DM的系統綜述與薈萃分析,核心結局指標包括血糖控制(HbA1c)、β細胞功能(C肽)及安全性。采用AMSTAR-2工具評價納入研究的方法學質量,并通過三重框架(研究重疊性、臨床結局、安全性)整合證據。
文獻篩選與納入研究特征
初篩獲得86項記錄,去重后保留71項進行標題/摘要篩選,18項進入全文評估。最終17項系統綜述/薈萃分析符合標準(篩選流程圖見圖1),形成了本綜述的核心證據基礎,覆蓋超過8,000名糖尿病患者。

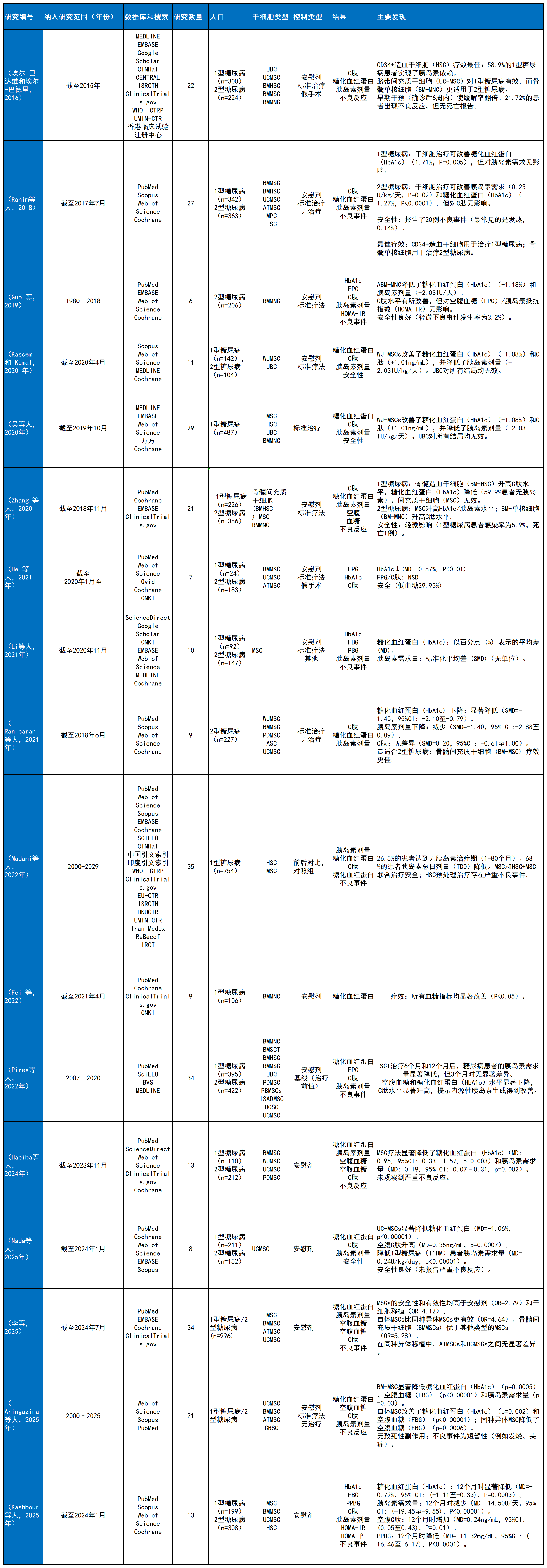
每項納入的綜述分析了6至35項原始研究,評估的干細胞類型包括:間充質干細胞(MSC)、臍帶間充質干細胞(UC-MSC)、骨髓來源干細胞(BM-MNCs/MSC)、脂肪干細胞(ASC)和造血干細胞(HSC)。對照組主要為安慰劑、常規治療或其它靶向治療(詳見表1研究特征總結,表2偏倚評估)。
表1和表2全面概述了綜述的特征,包括人群、干預措施、對照、結果和偏倚。
方法學質量評價結果
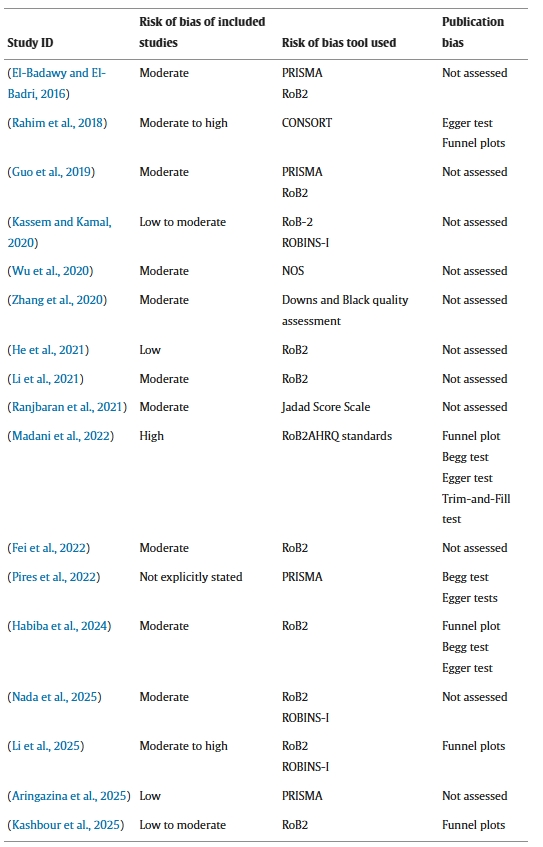
AMSTAR-2評估表明,所有綜述均在其研究問題中恰當地納入了PICO要素。大多數研究采用了重復研究篩選流程,并使用適當的統計方法進行了定量綜合。然而,盡管所有進行薈萃分析的綜述都充分解決了異質性問題,但部分綜述盡管進行了定量綜合,卻未能調查出版偏倚。
圖2顯示了所有評估項目的AMSTAR-2合規率,每篇綜述的完整評分詳情見補充文件表S2。
納入系統評價與薈萃分析的重疊分析
研究篩選與重疊量化:本分析納入17項薈萃分析涉及的309項原始研究引文,經去重后獲得113項獨特研究。量化評估顯示,不同綜述間的原始研究重疊率為10.84%(校正覆蓋區域,CCA),顯著低于預設的15%冗余閾值。基于三項高影響力研究(Carlsson et al., 2015; Hu et al., 2013, 2016)的先驅性價值(首次證實干細胞糖尿病療效)、方法學嚴謹性(隨機設計/長期隨訪)及排除后對獨立性影響微弱(CCA僅降至8.01%),予以保留(詳見圖S1)。
策略性取舍與證據完整性:針對最顯著的重疊案例(El-Badawy et al., 2016與Rahim et al., 2018共享22項研究),我們優先保留后者——因其額外包含5項獨特研究。該決策通過排除重復度高但新增證據少的綜述(El-Badawy),在保證證據庫完整性的同時(圖3),有效控制了方法學冗余(圖4),實現了全面性與嚴謹性的最優平衡。


干細胞治療糖尿病的臨床結果
臨床結果總結于表3中。
干細胞治療1型糖尿病的臨床療效:在T1DM患者中,間充質干細胞療法持續改善血糖控制指標,C肽水平顯著改善,HbA1c降低1.71%(p=0.005),盡管每日胰島素需求量保持不變。使用MSC和造血干細胞 (HSC) 的聯合療法提供了更好的結果,高達26.5%的患者實現了胰島素依賴。
| 項目 | 主要成果 |
|---|---|
| 2型糖尿病 | HbA1c 下降最多1.45% 胰島素劑量↓2.05U/kg/天 |
| 1型糖尿病 | C肽↑ HbA1c↓1.71% 對胰島素需求的影響各不相同 |
| 性能最佳的MSC來源 | 華通氏膠間充質干細胞 (WJ-MSCs) 骨髓單核細胞 (BM-MNCs) |
| 最不有效的MSC來源 | 臍帶血來源的 MSCs (UCB-MSCs) |
干細胞治療2型糖尿病的臨床療效:在2型糖尿病 (T2DM) 患者中,MSC療法始終表現出強大的療效,可將糖化血紅蛋白 (HbA1c) 降低高達1.45%,并顯著降低胰島素需求量(高達2.05U/kg/天)。沃頓膠衍生的MSC尤其有效,可顯著降低糖化血紅蛋白 (HbA1c) 并提高C肽水平。
MSC來源至關重要:沃頓膠MSC (WJ-MSCs) 和骨髓單核細胞 (BM-MNCs)在多項研究中均表現出最優療效。相反,臍帶血來源的MSC (UCB-MSCs) 效果較差,甚至可能增加胰島素需求(表3總結了主要臨床結果和MSC來源比較)。
討論:間充質干細胞治療糖尿病的核心治療潛力、挑戰
這項綜述的結果支持了間充質干細胞療法作為輔助治療糖尿病的潛力,尤其強調了其對2型糖尿病的療效。糖化血紅蛋白(HbA1c)的顯著降低和胰島素需求的減少,凸顯了MSC療法在顯著改善疾病管理方面超越傳統療法的潛力。
疾病類型差異與聯合策略:在1型糖尿病(T1DM)中,MSC治療的療效差異更為顯著,這反映了潛在的自身免疫病理以及對β細胞再生和免疫調節的迫切需求。MSC和HSC的聯合療法可能帶來更佳的治療效果,但需要仔細考慮相關風險,包括嚴重不良事件。DPP-4抑制劑等藥物在2型糖尿病和神經退行性疾病中對免疫調節和代謝改善的潛在協同作用已被探索。
細胞來源優先級與發病機制的關聯:這些結果與最近的報告一致,這些報告表明華通膠衍生的MSCs在T2DM中表現出卓越的免疫調節和再生能力。最近的評論還強調了炎癥級聯(包括NF-κB/NLRP3軸)在糖尿病相關神經退行性疾病和帕金森病合并癥中的病理作用。同樣,淀粉樣蛋白聚集的致糖尿病作用與阿爾茨海默病和T2DM中的重疊通路有關。
基于MSC來源的療效差異凸顯了對標準化治療方案的迫切需要。沃頓膠衍生的MSCs和BM-MNC的卓越功效表明在未來的臨床試驗中應優先考慮這些來源。相反,臍帶血衍生的MSCs性能不佳表明在臨床應用中應謹慎。MSC療法,尤其是使用WJ-MSCs和BM-MNCs的療法,可以作為胰島素抵抗患者的輔助或替代療法。
新興研究表明二甲雙胍可以增強成纖維細胞生長因子21 (FGF21),這是一種可能與MSC通路協同作用的代謝調節劑。然而,在臨床應用之前,必須解決生產標準化、交付物流和監管障礙。
當前干細胞治療糖尿病的轉化瓶頸與局限性
當前研究存在三大核心局限:
- ①治療方案異質性高(細胞制備/給藥方案未標準化);
- ②隨訪期普遍較短(中位≤12個月);
- ③長期安全性證據匱乏(腫瘤發生/自身免疫風險未明確)。
亟需通過統一生產標準、優化遞送系統及建立長期監測框架推動臨床轉化。
結論與未來展望
基于對現有高質量系統綜述和薈萃分析的整合,本研究表明MSC療法有望成為糖尿病管理(尤其是2型糖尿病)的一種有前景的輔助手段。
特別是源自沃頓膠(WJ-MSCs)或骨髓單核細胞(BM-MNCs)的療法,在治療糖尿病(尤其T2DM)中顯示出顯著改善血糖控制(降低HbA1c)和減少胰島素需求的潛力,且具有可接受的安全性。這為開發超越傳統胰島素替代的療法帶來了希望。
然而,將其確立為標準臨床療法仍面臨重大挑戰:治療方案的高度異質性、長期安全性和有效性數據的缺乏、以及需要更強大臨床證據。
未來的研究必須優先解決這些瓶頸——應優先開展大規模、隨機對照試驗,并采用標準化方案,重點關注最佳的MSC來源、劑量和給藥方法。超過五年的長期隨訪對于全面評估其持久性和安全性至關重要。探索MSC介導的免疫和再生途徑的機制研究可以提高治療的精準度,從而根據患者的具體特征和糖尿病亞型制定個性化治療方案。
參考資料:[1]:https://www.sciencedirect.com/science/article/abs/pii/S0040816625003234?via%3Dihub
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信