靜止的神經干細胞在受到一定條件的刺激下可以被再激活,重新進入細胞分裂周期,產生新的神經元,為神經干細胞移植治療神經系統疾病的細胞治療帶來前景。
神經干細胞(neural stem bells,NSCs)對神經系統的發育、再生和修復至關重要。成年哺乳類動物的大腦中,大部分處于靜止狀態的神經干細胞在受到外部刺激以及內在的信號分子、轉錄因子等多種因素之間的協調作用時,可以被再激活,從而退出G0期重新進入細胞分裂周期,產生新的神經元,神經干細胞再激活機制為神經系統疾病的細胞治療帶來前景。
神經干細胞再激活機制成為治療神經系統疾病的新方法
文中就近年來關于神經干細胞再激活的外部刺激、內在調控因素以及對神經系統疾病的修復治療等方面的研究進展進行綜述。
成人神經干細胞再激活的外部因素
Cattaneo等證明了神經生長因子(NGF)在神經系統中對神經干細胞增殖的影響。研究發現,神經干細胞暴露于纖維母細胞生長因子-2后給予NGF治療,通過激活與NGF特異結合的酪氨酸激酶(TrkA)受體,促進巢蛋白表達增加。NGF通過ERK1/2磷酸化促進神經干細胞增殖。這些受體的表達模式和NGF的濃度共同決定對神經干細胞的影響。
Zhang等證明低濃度的NGF對神經干細胞的增殖更有效,并且NGF可調節神經干細胞向成年神經表型分化。腦源性神經營養因子(BDNF)是神經營養素家族的另一個成員,對神經系統的發育,包括增殖、遷移、分化、存活、 凋亡和突觸可塑性起著重要作用。
研究表明,BDNF對BrdU標記培養的神經干細胞增殖具有劑量依賴性,同時BDNF可增強神經干細胞向少突膠質細胞和神經元分化的趨勢,并上調Wnt/β-連環蛋白(β-batenin)分子在神經干細胞中的表達。由此推測,BDNF可能通過激活Wnt1/β-batenin信號通路,在體外促進神經干細胞的增殖以及向神經元和少突膠質細胞分化。
成年神經干細胞再激活的內在調控因素
信號分子在成人神經干細胞再激活中的作用
成人神經發生的早期和晚期都受多種信號分子的調控, 如紡錘體基質蛋白、連接蛋白(CX)26作為NSCs重新激活的關鍵內在調節因子,均可防止NSCs在后期重新進入靜止狀態;紋狀蛋白相互作用的磷酸酶和激酶(STRIPAK)蛋白和熱休克蛋白(HSP)83/90與胰島素受體(InR)相互作用,可促進NSCs的重新激活;糖皮質激素是NSCs增殖的重要調節因子。
轉錄因子在成人神經干細胞再激活中的作用
轉錄因子是調控成人神經干細胞增殖、分化或存活的關鍵機制, 轉錄因子缺失可導致NSCs池衰竭。假激酶(Trbl)是靜止的NSCs特異性表達最顯著的蛋白編碼基因之一;E3連接酶CRL4Mahj在NSCs重新激活過程中起必不可少的作用;grl-5和grl-7是miR-235促進靜止NSCs重新激活的靶點;孤核受體tailless樣蛋白(Tlx)促進了NSCs從靜止狀態向激活狀態的轉換;蛋白轉錄因子(REST)在神經再生小室中的功能是雙向的,同時又是保護成人神經干細胞池所必須的。
成人神經干細胞再激活修復治療神經系統疾病
中樞神經系統損傷可能導致神經元和神經膠質細胞的喪失,以及脫髓鞘改變,如多發性硬化(MS)、缺血性腦卒中、帕金森病等損傷常與持續性功能喪失有關,因為中樞神經 系統的再生潛力和重建神經結構的能力有限。成年NSCs存在于大腦的一些離散再生小室中。這一發現為從成年NSCs中誘導內源性神經元和膠質細胞的生成開辟了新前景。
神經干細胞移植治療多發性硬化癥
多發性硬化癥(Multiple sclerosis,MS)是一種中樞神經系統的自身免疫疾病,臨床病理癥狀體現為T細胞浸潤至中樞神經系統內引起炎癥反應,并伴隨髓鞘,軸突的破壞與脫落。目前該疾病的發病機理仍未被闡述清楚,仍無有效對癥的治療方案能夠完全治愈該病。
近幾年神經干細胞移植技術的發展,為多發性硬化癥的治療提供了新策略。
2016年,中國科學院大學進行了一項誘導性多能干細胞來源的神經干細胞移植治療多發性硬化癥的臨床試驗[1]。
中國科學院大學發現,誘導多能干細胞體外誘導分化形成的神經干細胞在移植后可以顯著地減少EAE小鼠中樞神經系統內的T細胞浸潤和白質損傷。同時,移植誘導多能干細胞體外誘導分化形成的神經干細胞的EAE小鼠的臨床評分有了明顯下降,運動功能得到了較好的恢復。綜上結果表明,誘導多能干細胞體外誘導分化形成的神經干細胞可以有效地治療多發性硬化癥疾病。本研究提供了支持應用誘導多能干細胞分化的神經干細胞移植治療多發性硬化癥可行性的重要的前期臨床實驗證據。
神經干細胞移植治療缺血性腦卒中
缺血性腦卒中的發生是由于大腦供血的血管阻塞,導致病變內神經元、星形膠質細胞和少突膠質細胞壞死而引起。腦損傷對內源性神經發生的影響:
首先是增加細胞繁殖和吸引新的神經元進入損傷區域,與神經炎癥信號通路相協調,產生新的神經元;
其次,成年NSCs也有助于少突膠質細胞的生長,新的神經元和少突膠質細胞的生長可通過整合重新連接受損的神經元回路。
2021年,杜蘭大學醫學院藥理學系在《國際分子科學雜志》上發表了一篇《神經干細胞治療早期缺血性中風》的文章,文章表明神經干細胞(NSC)具有多效性,對高度復雜的早期中風病理生理學有益[2]。

移植的神經干細胞可以分化為大腦中的功能性神經元,并且還表現出旁觀者(伴侶)效應,包括遞送神經營養因子,這可以減輕有毒微環境并保護瀕臨滅絕的宿主細胞。臨床前研究表明,移植的神經干細胞通過多種機制改善中風結果,例如保護血腦屏障(BBB)、減少腦血管炎癥、增加神經發生和血管生成以及增強神經功能(圖1:神經干細胞輸送示意圖說明了神經干細胞移植治療缺血性中風的多種治療機制)。
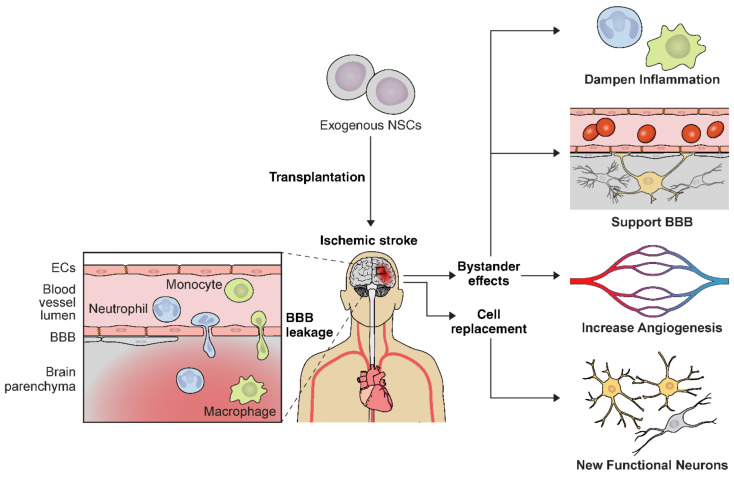
神經干細胞可以分化為中風大腦中的功能性神經元,并具有多效性旁觀者效應。這些旁觀者效應包括血腦屏障(BBB)破壞的減弱、血管生成的增加以及缺血性中風后免疫反應的調節。
神經干細胞移植治療帕金森病
帕金森病是由中腦黑質致密部多巴胺神經元變性引起的疾病。通過內源性修復產生 新的多巴胺神經元可能是改善帕金森病癥狀的有效治療方法,但目前多巴胺神經元發生的程度還遠不能達到治療水平。因此,神經干細胞移植成為較有吸引力的治療選擇,神經干細胞能夠自我更新并分化成所有的神經系細胞,可以替代缺失的多巴胺神經元,逆轉帕金森病的退行性病理過程。
體外實驗表明,將NSCs與內皮細胞結合,創造一種神經血管微環境,模擬NSCs移植的人腦體內微環境,通過對靶部位細胞和非細胞成分微環境的識別,可以誘導神經干細胞向多巴胺神經元分化,一旦從移植的神經干細胞中獲得多巴胺神經元,并整合到已有的黑質紋狀體多巴胺系統中進行神經傳遞,帕金森病癥狀將有望得到緩解。
此外,在2018年,《中國實用神經疾病雜志》發表了一篇《神經干細胞移植治療帕金森病的效果觀察》的文章[3]。

目的:探討神經干細胞移植術治療帕金森病的臨床效果。
方法:選擇2014-05—2015-05駐馬店市中心醫院收治的帕金森病患者27例,均采用神經干細胞移植手術治療。分別記錄患者治療前、治療后12個月的統一帕金森病評分量表(U P-DRS)評分,并觀察患者隨訪12個月的治療效果。
結果:治療后12個月,患者UPDRS量表中的行為和心理評分、日常生活質量評分、運動功能評分、并發癥評分均明顯低于治療前(P<0.05),且治療后12個月UPDRS量表總評分也低于治療前(P<0.05)。27例患者平均隨訪12個月,治療總有效率為81.48%。
結論:神經干細胞移植手術治療帕金森病療效確切,可明顯改善患者UPDRS評分,提升生活質量,值得推廣。
展望
在成體內源性神經干細胞的再生潛能以及再生機制研究方面取得了巨大進展,產生了治療的多種神經干細胞類型,并改善了利用外源神經干細胞進行細胞治療的方法。目前的研究集中在調控促進成人神經干細胞再生的信號通路、信號分子以及轉錄因子等方面,以充分利用它們的再生能力。
雖然,神經干細胞的再激活為神經系統障礙性疾病的細胞治療帶來前所未有的前景,但仍然面臨一系列的問題:例如,神經干細胞是如何控制新產生的神經元或神經膠質細胞的功能,神經干細胞對神經元整合的動態研究以及新神經元對鄰近神經元神經環路和行為的影響等,將是臨床應用中需要解決的關鍵問題。
未來,神經干細胞再生領域需要基礎研究人員、病理學家和臨床醫生等多學科的專業知識指導各類神經疾病的轉化治療。隨著這一領域的快速發展,期待成人神經干細胞的再激活進行臨床治療可能不會太久。
參考資料:
[1]:張超. 利用誘導性多能干細胞來源的神經干細胞移植治療多發性硬化癥[D]. 中國科學院大學,2016.
[2]:Hamblin MH, Lee JP. Neural Stem Cells for Early Ischemic Stroke. Int J Mol Sci. 2021 Jul 19;22(14):7703. doi: 10.3390/ijms22147703. PMID: 34299322; PMCID: PMC8306669.
[3]:康霞. 神經干細胞移植治療帕金森病的效果觀察[J]. 中國實用神經疾病雜志,2018,21(11):1233-1237. DOI:10.12083/SYSJ.2018.11.299.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信