帕金森病 (PD) 是最常見、最復雜的神經退行性疾病之一,影響約0.3%的普通人群和1%–2%的65歲以上人群,其患病率在未來幾年內將增加一倍或三倍隨著發達國家人口老齡化的數十年。人口老齡化帶來了巨大的社會經濟負擔,影響患者及其家人的生活質量,并給支持他們的醫療保健系統帶來壓力。
PD的標志之一是黑質致密部 (SNpc) 中的多巴胺能神經元進行性喪失,導致基底神經節內多巴胺缺乏,并出現典型的帕金森病運動癥狀(例如運動遲緩、震顫和強直),如以及許多非運動癥狀(例如抑郁、便秘、疼痛、泌尿生殖問題和睡眠障礙)。盡管多巴胺替代療法(例如左旋多巴或多巴胺激動劑)仍然是帕金森病的一線治療方法,并且使許多患者受益匪淺,但由于療效下降和副作用增加(例如運動障礙),其治療窗受到限制。手術治療已被證明可以成功緩解帕金森病的某些癥狀。其中,深部腦刺激(DBS)通常用作一種非破壞性治療,通過在藥物治療無效時調節基底神經節失調的輸出核,使PD患者的運動功能正常化。盡管有效,但DBS也存在實際缺點,包括費用較高、植入物感染的風險、植入硬件的腐蝕和/或遷移以及手術更換不可充電電池。

此外,還有一些與DBS可能的副作用相關的揮之不去的問題和擔憂,例如認知惡化、言語障礙、抑郁、姿勢不穩定和體重顯著增加。此外,這些治療方法僅提供對癥治療,到目前為止,沒有任何可用的治療方法能夠減緩、停止或逆轉疾病進展。
多能干細胞(PSC)具有兩個顯著特征,即自我更新性和多能性,使它們能夠產生幾乎任何細胞類型。人類PSC有兩種主要類型:人類胚胎干細胞 (hESC) 和人類誘導多能干細胞 (hiPSC)。由于其獨特和非凡的功能,hESC和hiPSC都被認為是疾病建模和藥物發現以及細胞移植方法的潛在工具。在過去的幾十年里,hPSC衍生的功能神經元與內源性神經元的身份充分匹配,為PD的治療提供了關鍵進展。
在這篇綜述中,我們將討論干細胞治療帕金森病的背景和最新進展,涵蓋胎兒組織、hESC和hiPSC的使用。
帕金森病作為細胞治療的一個有前景的目標疾病
PD是一種多因素神經退行性疾病,由衰老、遺傳和環境因素復雜的相互作用引起。PD病理學的標志是 SNpc中A9型中腦多巴胺能 (mDA) 神經元 (mDAN) 以及含有α-突觸核蛋白的路易體和路易神經突的逐漸喪失。這種損失導致的黑質紋狀體多巴胺通路的漸進性損傷被認為是帕金森病主要運動癥狀的原因。這種理解引領了細胞療法的新時代,重點是用多巴胺產生細胞替代失去的多巴胺能神經支配,包括來自異種或流產的人類胎兒組織的腹側中腦多巴胺神經元作為細胞來源。大量積累的數據表明,胎兒細胞移植具有顯著且長期從PD病理中恢復的潛力,為細胞替代療法提供了“概念驗證”。圖1)。
我們將在下面更詳細地討論干細胞療法治療帕金森病的從實驗室到臨床的進展。
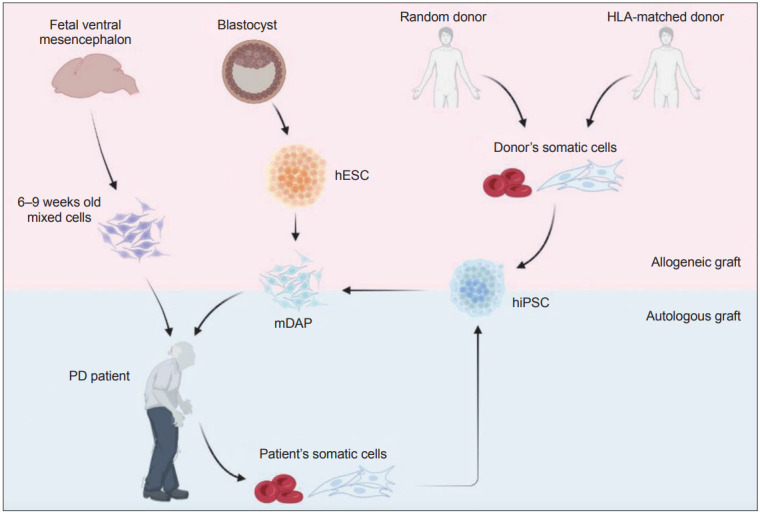
從6-9周大的流產人類胚胎中獲得的胎兒腹側中腦細胞的移植為支持PD細胞替代療法提供了概念證明。然而,使用流產的人類胚胎引起了倫理和實際問題。人胚胎干細胞 (hESC) 是生產mDAP的替代和可再生細胞來源,但存在與長期維持相關的有害突變積累的風險,并且需要免疫抑制以防止移植排斥。可以根據質量評估(例如,無致瘤性或毒性),并可作為治療PD患者的通用來源,盡管需接受免疫抑制方案。雖然源自患者體細胞的hiPSC可能是最佳細胞來源,允許自體細胞移植而不會出現任何免疫排斥問題,但它需要額外的時間和費用。
開發帕金森病的干細胞治療方法
中腦胎兒細胞移植作為早期概念驗證研究——教訓和挑戰
Lindvall等人于20世紀80年代初進行的開放標簽研究。首先表明,將從胎齡8-9周流產的人類胚胎中獲得的人類胎兒中腦多巴胺能神經元移植到PD患者的紋狀體中,可以在人腦中存活,并導致嚴重僵硬、運動遲緩、以及患者病情的波動。這可能是通過恢復紋狀體多巴胺能傳遞而發生的,揭示了使用胎兒組織進行細胞移植治療的前景。
隨后,類似的開放標簽研究在世界范圍內進行,結果表明,一些患者在長達二十年的時間里獲得了癥狀緩解和正常多巴胺信號的恢復。幾項后續研究顯示,尸檢證據表明,移植的胎兒組織支配宿主紋狀體,并在移植后24年內廣泛生長。
然而,兩項NIH資助的雙盲、假對照臨床試驗的結果未能提供統計學上顯著的改善,56名移植患者中有18名(32%)甚至出現不良反應,大多是病因不明的移植物誘發的運動障礙。這種運動并發癥的一個可能的解釋來自對胎兒細胞移植患者的體內成像研究,這些患者的結局不佳,顯示共同移植的血清素能神經元釋放不受調節的多巴胺。
盡管最初對這種方法的熱情因這些不令人滿意的臨床結果而受到挫傷,并且隨后在2000年代初暫停了胎兒細胞移植,但從這些胎兒細胞移植研究中吸取的經驗教訓表明,PD細胞治療策略的進步可能會改善患者生活質量的潛力。為了實現這一想法,該領域的多個團體發起了“G-Force PD”聯盟,合作開發臨床應用的標準化細胞移植程序。
據此,Roger Barker及其同事發起了一項新的歐洲試驗,使用人類胎兒腹側中腦 (fVM) 組織,稱為 TRANSEURO (?www.transeuro.org.uk?),為PD患者開發一種有效且安全的方法。盡管長期隨訪研究表明,一些最初進行胎兒移植的患者獲得了持續的運動癥狀緩解,證明了細胞移植療法在治療PD中的功效。
用于同種異體移植的hESC衍生多巴胺細胞
從fVM細胞的臨床應用中吸取的重要教訓促使研究人員探索替代細胞來源,包括具有分化成多種細胞譜系能力的多種干細胞類型。多種干細胞類型已在體外和體內得到鑒定和廣泛表征。
1981年小鼠胚胎干細胞 (ESC) 的分離和建立徹底改變了生物學研究,并因其無限的自我更新和多能分化潛力而引起了特別的興趣,能夠產生身體的任何細胞類型。隨后,湯姆森等人首先從人類囊胚中建立了 hESC 系,這種新的可擴展細胞來源作為胎兒組織的替代品,開啟了臨床應用轉化研究的新時代。
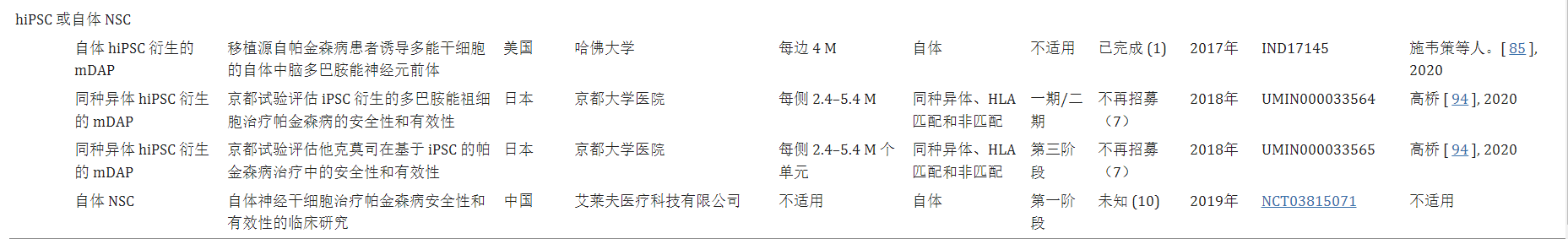
截至撰寫本文時,已有四項注冊臨床試驗使用 hESC 衍生的多巴胺細胞或人孤雌生殖神經干細胞作為移植治療的同種異體細胞來源(表格1)。其中,王等人于2017年啟動了第一個使用hESC的臨床試驗(NCT03119636)。基于最近的臨床前動物研究,美國Studer小組開展了一項1期臨床試驗,以確定同種異體WA09 hESC衍生的mDA祖細胞 (mDAP) (MSKDA01) 治療晚期PD患者的安全性和有效性 (NCT04802733)?。
2017年,瑞典Malin Parmar團隊還計劃啟動一項歐洲臨床試驗(STEM-PD試驗),使用源自人類ESC的同種異體mDAP(EudraCT 2021-001366-38)。盡管使用hESC進行細胞替代治療具有潛在益處,但這些hESC 衍生細胞與胎兒組織是同種異體,需要免疫抑制以避免移植排斥。由于感染和副作用(例如發生惡性腫瘤)的風險增加,免疫抑制的條件和持續時間仍然存在爭議,潛在的有害影響有待確定。


用于自體/同種異體移植的hiPSC衍生多巴胺細胞
2006年,Takahashi和Yamanaka首次報道了他們的突破性工作,表明他們可以將終末分化的小鼠體細胞恢復到類似ESC的狀態,此后稱為“誘導多能干細胞”。這項研究后不久,山中伸彌的小組和其他兩個小組使用相同或相似的重編程因子組成功地從人類體細胞中產生了hiPSC,為生成患者特異性hiPSC提供了前所未有的可能性,而無需考慮與破壞人類胚胎以獲得人類ESC相關的倫理問題。hiPSC技術的出現為干細胞生物學和再生醫學領域開創了一個令人興奮的新時代,也為人類“培養皿中的疾病”模型和藥物發現提供了一個有用的平臺。
盡管歷史較短,但使用基于自體hiPSC的個性化細胞療法的治療益處是顯而易見的。首個評估自體hiPSC衍生細胞潛力的臨床試驗由日本小組于2014年發起。曼代等人首先將自體hiPSC來源的視網膜色素上皮(RPE)移植到視網膜下患有晚期新生血管性年齡相關性黃斑變性的患者中,據報道該治療可改善患者的視力,證明了自體細胞療法的潛力。截至撰寫本文時,已經開展了3項使用hiPSC衍生細胞治療PD患者的臨床試驗(表格1)。
其中,Schweitzer等人發表了一份開創性的病例報告。最近提出了自體細胞替代療法的里程碑,因為他們展示了源自PD患者特異性hiPSC (IND17145) 的mDAP自體移植的可行性。此外,另一項臨床試驗于2019年啟動,測試自體神經干細胞對PD患者施用的功效(NCT03815071)。
然而,建立和表征患者特異性hiPSC的耗時費力的過程和高昂的成本被認為是個性化自體細胞替代療法應解決的一大障礙。使用自體iPSC衍生細胞產品治療一名患者的費用估計約為800,000美元。克服這些限制的一種可能性是使用基于同種異體 iPSC的“現成”細胞療法。這些人類白細胞抗原 (HLA) 匹配的細胞產品可以從共享最常見HLA類型的健康捐獻者中建立,因此可以針對大量患者群體,這將顯著減少每次治療的時間和成本。
此外,冷凍保存可以進行嚴格的臨床前研究,以確定將移植到人體中的hiPSC衍生細胞產品的批次特異性功效。此外,關鍵的安全問題,包括致瘤潛力、脫靶效應以及與手術輸送設備的兼容性,可以通過在臨床試驗前評估冷凍保存的mDAP的質量來解決。與此相符的是,高橋日本發起了一項單組、非隨機、開放標簽1/2期研究,以評估同種異體hiPSC衍生的冷凍保存mDAP(與宿主具有不同程度的HLA匹配)治療7名PD患者的安全性和有效性2018年(京都審判)(UMIN000033564)。然而,這些同種異體細胞移植需要患者接受免疫抑制劑藥物,以防止受者可能出現的免疫排斥反應。
hPSC衍生的mDAP臨床使用需要考慮的關鍵因素
為了充分發揮基于hPSC的PD細胞療法的潛力,移植細胞的安全性和有效性應該保持一致。應用hPSC衍生的mDAP作為治療PD患者的通用治療方法存在一些關鍵問題,如下所述:
自體干細胞與異體干細胞作為初始細胞來源
一般來說,所有用于臨床作為帕金森病患者長期治療的細胞產品都需要比用于發育和機制研究的細胞更高的安全水平。主要應通過避免使用可能有害的病毒制劑和可整合或破壞宿主生理機能的遺傳物質來確保移植細胞來源的安全。細胞移植治療的第一步是識別和選擇良好的干細胞來源,這需要考慮許多因素,包括 hPSC的基因組完整性。使用已充分表征的hESC系(例如WA09hESC系)可能有利于同種異體細胞移植的目的,因為二十年來許多研究人員已在基礎和臨床前研究中使用并充分表征了這些細胞系。
衍生用于移植的適當多巴胺細胞類型
從hPSC中選擇性產生特定的mDA神經元群是hPSC衍生物臨床應用于PD患者需要考慮的另一個問題。
最佳細胞數
確定要植入的最佳細胞數量是PD細胞移植治療中應考慮的另一個關鍵因素,因為這可能因細胞類型和活力、給藥途徑以及癥狀緩解程度而異。
hPSC衍生細胞移植物的安全性
移植細胞中未分化PSC的潛在致瘤風險是與轉化干細胞治療相關的主要問題之一。
對移植細胞的免疫反應
移植細胞/組織被宿主免疫反應排斥的可能性是干細胞移植治療帕金森病的另一個主要障礙和擔憂。如上所述,宿主免疫反應是影響同種異體細胞移植的主要障礙之一,異體細胞移植與自體移植有根本的不同。
移植患者分層
細胞替代療法的成功臨床結果取決于接受者黑質紋狀體多巴胺能系統的完整性。由于移植物在宿主紋狀體中的適當神經再支配可能在PD功能恢復中發揮關鍵作用,因此移植前受體體內應存在功能充分的黑質紋狀體系統。
未來發展方向
低免疫原性PSC衍生的mDAN的應用
考慮到PSC衍生細胞治療PD的成功取決于植入的mDAN與宿主患者之間的免疫匹配,毫無疑問,自體 hiPSC提供了理想且無限的細胞來源,可用于無需免疫的患者特異性治療。拒絕的擔憂。然而,盡管其有用,但從患者特異性體細胞生成和表征自體hiPSC以及擴增和表征足夠數量的這些hiPSC以用于治療用途的過程是耗時、費力且昂貴的。
細胞和基因聯合治療
除了細胞療法之外,基因療法也被廣泛探索作為治療帕金森病的一種選擇。
結論
干細胞研究領域的最新進展為對當前治療策略難治的患者提供了新的治療選擇,為患者量身定制的造血干細胞可在體外和體內分化成多種類型的細胞。盡管仍存在上述技術和科學挑戰,但越來越多的臨床前和臨床研究利用 hPSC 衍生物治療包括帕金森病在內的人類神經退行性疾病。盡管取得了這些進展,但細胞移植治療帕金森病仍存在一些問題。例如,羅恩-阿爾特曼博士(Dr. Ron Alterman)最近對第一份描述自體 mDAPs 治療帕金森病患者的病例報告提出了以下批評:
1)盡管第一階段開放標簽研究前景看好,但過去的細胞療法試驗均以失敗告終;
2)安慰劑效應可能是導致試驗失敗的部分原因;
3)移植物誘發的運動障礙等副作用是試驗失敗的另一個原因;
4)細胞療法并不能解決PD的所有潛在病理生理機制。
雖然這些批評的出發點是細胞療法可能不會比目前已被證實的療法(如DBS和多巴胺藥物)更有效地控制癥狀,但目前這還不得而知,正在進行的研究將有助于澄清這一問題。盡管如此,干細胞療法在概念上的優勢在于,這種方法可減輕帕金森癥狀(如DBS或多巴胺藥物療法),恢復移植細胞與保留的宿主神經元之間的突觸形成和多巴胺周轉,挽救帕金森病患者的運動和非運動障礙。
此外,與20世紀90年代末的胎兒細胞移植方法相比,目前基于PSC的治療方法還具有以下優勢:
1)細胞重編程的新策略(包括使用諾貝爾獎獲獎方法進行體細胞重編程);
2)利用干細胞的實際能力,減少或消除移植排斥反應;
3)系統制造方法,生成臨床級mDAPs,確保移植前的安全性和有效性。
雖然基于干細胞的帕金森病療法有一些局限性(例如,多巴胺相關干細胞療法可能無法糾正非多巴胺能病理學導致的所有已知帕金森病非運動癥狀;沒有一種基于細胞的療法已成功進行了三期臨床試驗),而且使用hPSC衍生物可能會繼續引起人們對安全性和可行性的擔憂,但人們已經并正在進行密集的科學努力,以改進和進一步優化基于hPSC的細胞治療方法,使其更安全、更有效、成本更低。
為了將我們的發現轉化為治療運動型和非運動型帕金森病癥狀的新型治療途徑,我們必須繼續努力,包括進行基礎和臨床研究,以加深對帕金森病病因的了解。此外,在這一領域進行大量的商業和政府投資對于克服實際限制(如制造mDAPs的成本)也很重要,這樣才能使基于hPSC的細胞療法成為一種可行的治療方法,供大量帕金森病患者使用。
參考資料:Cha Y, Park TY, Leblanc P, Kim KS. Current Status and Future Perspectives on Stem Cell-Based Therapies for Parkinson’s Disease. J Mov Disord. 2023 Jan;16(1):22-41. doi: 10.14802/jmd.22141. Epub 2023 Jan 12. PMID: 36628428; PMCID: PMC9978267.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信