概述:神經退行性疾病 (ND) 是影響中樞和周圍神經系統的一系列臨床病癥。目前尚無治愈方法,治療主要集中在減緩病情進展或緩解癥狀。
使用來自不同來源的各種細胞類型的細胞療法正在作為針對多種神經退行性疾病的臨床試驗進行。它們包括神經干細胞、間充質干細胞和造血干細胞,以及源自胚胎干細胞和誘導多能干細胞的神經細胞。在這篇綜述中,我們列出了神經干細胞移植療法在神經退行性疾病的的臨床試驗列表,其中包括33項使用神經干祖細胞的試驗、8項使用分化神經細胞的試驗以及7項ND中涉及非神經細胞的109項試驗。一些早期臨床試驗顯示了令人鼓舞的結果,需要在隨機環境中進行進一步研究。然而,考慮到試驗的相對成本以及罕見疾病的情況,這樣的決定性試驗可能是不可能的。
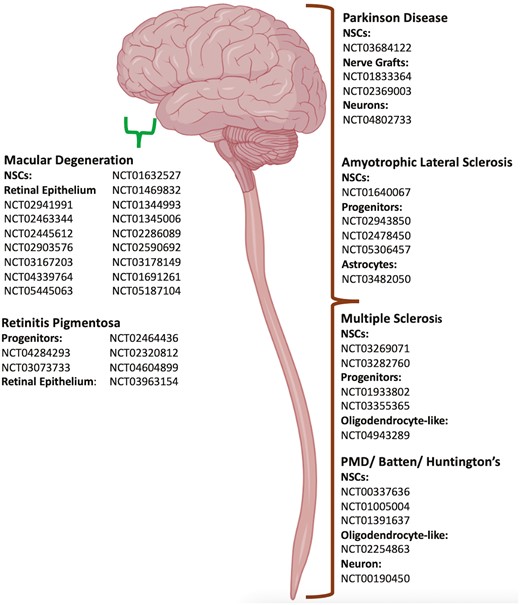
神經系細胞移植可通過多種機制產生臨床益處,例如:(1)與內源性微環境協同作用,上調固有細胞增殖或神經保護,增強移植組織的整體再生能力;(2)融入內源性宿主網絡,替代相關細胞/損傷細胞并形成功能性突觸。因此,本綜述的重點是詳細介紹使用NSCs和神經系細胞治療ND的最新臨床試驗。涉及其他來源干細胞的臨床試驗也已列出,但未詳述。
方法
對于每種疾病,搜索疾病名稱(帕金森氏病、肌萎縮側索硬化癥、多發性硬化癥、亨廷頓病、黃斑變性、視網膜色素變性、阿爾茨海默病、脊髓小腦性共濟失調、路易體癡呆、額顳葉變性、多系統萎縮)、神經干細胞、神經細胞和細胞治療均在ClinicalTrials.gov上進行。討論了使用神經譜系細胞進行細胞治療的疾病。它們也將列在表中,然后是每種疾病類型的非神經譜系細胞臨床試驗。為此目的,僅包括干預性研究而不包括觀察性研究。已終止、撤回、暫停或未知(已完成日期但狀態超過2年未驗證)的研究被排除在外。同樣,本研究中省略了未在ClinicalTrials.gov中注冊的研究。
神經干細胞與帕金森病
帕金森病是一種慢性ND,其特征是黑質中多巴胺能 (DA) 神經元的進行性喪失。表現為運動遲緩、震顫、姿勢不穩和肌肉強直等運動障礙。早期可以使用左旋多巴、多巴胺激動劑和單胺氧化酶抑制劑等藥物有效治療,但這些藥物無法阻止潛在的神經退行性變。迄今為止,尚無可逆轉疾病進程的治療方法。
自80年代末以來,多個研究小組將人類胎兒腹側中腦 (fVM) 組織移植到PD患者的尾狀核和殼核中,從而使PD癥狀得到一定程度的改善。對fVM移植人體臨床試驗的進一步分析表明,各種參數都有臨床改善,對于病程較短的輕度PD患者來說,效果最佳。然而,這種移植物與運動障礙的發生有關, 推測是由于捐贈的移植物中存在血清素能細胞。
韓等人在一本書的章節中總結了胎兒腦源性神經干細胞移植到帕金森病患者的早期試驗的臨床結果。與患者(在12個月到24年之間觀察,13項試驗中有11項觀察到癥狀改善,12項試驗中有3項報告有運動障礙。此外,移植物存活率較低,因此每位患者需要多個供體。隨著DA神經元分化方案的進步,DA神經元可以從各種細胞來源(ESC、iPSC和MSC)中分化出來,這些更加明確和分化的細胞群、更加同質化導致了新一波的細胞倡議PD患者的移植。
延伸閱讀:拜耳表示神經元干細胞療法治療帕金森病:首個1期臨床試驗取得積極結果
ClinicalTrials.gov上列出了18項試驗,其中4項是神經譜系試驗,直接輸送到大腦中(表1)。有1項試驗利用沃頓膠 (WJ) MSC通過體外分化衍生的NSC (NCT03684122)。間充質干細胞的多能特性使其能夠分化成多種細胞類型,包括神經元和其他神經元細胞。與未分化的WJ-MSC相比,分化為NSC的WJ-MSC被發現具有增強的治療潛力。這些NSC保留了其免疫調節特性,同時顯示出神經外胚層特征。
還有另外2項使用神經祖細胞 (NPC) 的臨床試驗(NCT03309514和 NCT01329926),但均因資金不足而被撤回。另外3項研究涉及分化的神經細胞,特別是含有雪旺細胞的周圍神經移植物,以及從人胚胎干細胞分化而來的DA神經元。兩項將自體周圍神經移植物直接植入黑質的試驗表明,其安全、可行且具有臨床獲益。使用周圍神經移植物的挑戰在于它們含有異質的細胞類型群。雖然它已被證明可行且安全,但其功效仍有待更多數據。
| 序號 | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 帕金森綜合癥 | 克雷格·范·霍恩 | 自體周圍神經移植 | 植入黑質 | 沒有提到 | 8 | 2012年 | na | NCT01833364 |
| 2 | 帕金森綜合癥 | 克雷格·范·霍恩 | 自體周圍神經移植 | 植入黑質 | 沒有提到 | 70 | 2015年 | 1 | NCT02369003 |
| 3 | 帕金森綜合癥 | 約旦大學 | 同種異體 WJSC 及其衍生 NSC | MSC(IV、IT)、NSC(IT) | 用于 iv 的 MSC (120-180 M)、用于 IT 的 MSC (240-260 M)、NSC (24-36 MM) | 10 | 2018年 | 1/2 | NCT03684122 |
| 4 | 晚期帕金森病 | 藍石療法 | ESC 衍生的多巴胺神經元 (MSK-DA01) | 手術移植到殼核 | 沒有提到 | 12 | 2021年 | 1 | NCT04802733 |
| 5 | 帕金森綜合癥 | 骨科和再生醫學基金會 | 同種異體UC-MSC | 靜脈注射 | 100M | 20 | 2011年 | 1 | NCT05152394 |
| 6 | 神經退行性疾病 | 艾略特·蘭德 | 自體脂肪來源的基質血管部分 | 靜脈注射、關節內注射和軟組織注射。 | 沒有提到 | 3000 | 2013年 | na | NCT01953523 |
| 7 | 中風/TBI/帕金森/ALS/阿爾茨海默/癡呆 | MD干細胞 | 自體骨髓間充質干細胞 | 靜脈注射和鼻內注射 | 沒有提到 | 500 | 2016年 | na | NCT02795052 |
| 8 | TBI/阿爾茨海默病/癡呆/帕金森癡呆/晚期腦病 | MD干細胞 | 自體骨髓間充質干細胞 | 靜脈注射和鼻內注射 | 沒有提到 | 100 | 2018年 | na | NCT03724136 |
| 9 | 帕金森綜合癥 | 德克薩斯大學健康科學中心 | 同種異體骨髓間充質干細胞 | 靜脈注射 | 1、3、6 和 10 M/kg | 20 | 2017年 | 1 | NCT02611167 |
| 10 | 帕金森綜合癥 | 德克薩斯大學健康科學中心 | 同種異體骨髓間充質干細胞 | 靜脈注射 | 20和30M/KG | 45 | 2020年 | 2a | NCT04506073 |
| 11 | 帕金森綜合癥 | 白俄羅斯研究生教育醫學院 | 自體骨髓間充質干細胞 | 靜脈注射和鼻內注射 | IV(0.5-2 M/kg),鼻內(5-12.6M) + IV(10-50 M) | 50 | 2017年 | 2,3 | NCT04146519 |
| 12 | 帕金森綜合癥 | 河北新賽生物醫藥科技有限公司 | MSC | 靜脈注射 | 10-20M | 20 | 2018年 | 1 | NCT03550183 |
| 13 | 多系統萎縮/帕金森癥 | 印度尼西亞大學 | 自體脂肪 MSC、同種異體 UC MSC | 鞘內 | 脂肪 MSC (100M)、上皮 MSC (100M) | 15 | 2020年 | na | NCT04876326 |
| 14 | 帕金森綜合癥 | 上海東方醫院 | 人羊膜上皮干細胞 | 側腦室立體定向植入 | 50公尺 | 3 | 2020年 | 1 | NCT04414813 |
| 15 | 帕金森綜合癥 | 上海東方醫院 | 人羊膜上皮干細胞 | 側腦室立體定向植入 | 50公尺 | 12 | 2022年 | 1 | NCT05435755 |
| 16 | 帕金森綜合癥 | 希望生物科學干細胞研究基金會 | 同種異體脂肪來源的 MSC (HB-adMSC) | 靜脈注射 | 沒有提到 | 60 | 2021年 | 2 | NCT04995081 |
| 17 號 | 帕金森綜合癥 | 希望生物科學干細胞研究基金會 | 自體脂肪來源的 MSC (HB-adMSC) | 靜脈注射 | 沒有提到 | 24 | 2021年 | 2 | NCT04928287 |
| 18 | 特發性帕金森病 | 臺灣線粒體應用科技股份有限公司 | 自體脂肪來源的 MSC(Mitocell) | 立體定向紋狀體內植入 | 60M和200M | 9 | 2022年 | 1 | NCT05094011 |
神經干細胞與肌萎縮側索硬化癥
肌萎縮側索硬化癥 (ALS) 是一種進行性運動神經元疾病,影響皮質、腦干和脊髓的運動神經元,全球發病率為每10萬人中2-3例。受影響的患者患有進行性肌肉無力、萎縮、痙攣和癱瘓,最終在3-5年內死亡。大多數 (90%) 病例是散發性的,其余10%是家族性ALS。迄今為止,尚無治愈方法或有效療法來阻止疾病的進展。
干細胞移植被認為是一種有前途的治療選擇 , 因為它們配備了復雜的細胞機制,可以通過分泌神經營養因子來改變局部環境, 還可能分化為星形膠質細胞,以提高谷氨酸再攝取的效率,這一過程在ALS中被破壞。此外,分化為神經元細胞的移植干細胞可能與天然運動神經元形成突觸,提供營養和/或接觸介導的支持。多項研究已證明不同來源的干細胞的安全性和有效性,例如胎兒NSC、外周血干細胞、MSC、和嗅鞘細胞(ALS中神經譜系的分化細胞)患者。
在記錄的32項細胞移植臨床試驗中,有5項涉及神經相關細胞并通過直接注射輸送(表2)。只有一名患者使用椎管內注射的人類胎兒神經干細胞,這表明所有6名登記參與者在18個月內沒有出現疾病進展,其中2名患者的步行評分有所改善。這項研究擴展到另外12名參與者,在60個月內既沒有出現嚴重的副作用,也沒有增加疾病進展,并且在移植后第1個月到第4個月期間ALS功能評定量表有所改善。
接下來,Kadimastem等人證明鞘內注射100-2.5億個ESC衍生的星形膠質細胞AstroRx可以顯著降低6個月的疾病進展速度 (NCT03482050)。還有另外2項試驗,其中一項使用尚未開始招募的神經膠質限制性祖細胞,另一項使用經過基因工程改造以超表達神經膠質源性神經營養因子 (GDNF) 的人類NPC,結果表明這些細胞的單次給藥是安全的,并且能夠在移植后長達42個月內提供新的支持細胞并輸送GDNF。
| no | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 肌萎縮側索硬化癥 | Azienda Ospedaliera Santa Maria, 特爾尼, 意大利 | 人類胎兒 NSC | 椎管內 | 2.25 或 4.5 M | 18 | 2011年 | 1 | NCT01640067 |
| 2 | 肌萎縮側索硬化癥 | 雪松西奈醫療中心 | 表達 GDNF 的人神經祖細胞 (CNS10-NPC-GDNF) | 單側腰脊髓注射 | 0.2M、0.5M | 18 | 2017年 | 1 | NCT02943850 |
| 3 | 肌萎縮側索硬化癥 | 卡迪馬斯特姆 | ESC 衍生的星形膠質細胞 (AstroRx) | 鞘內 | 100M、250M | 16 | 2018年 | 1,2 | NCT03482050 |
| 4 | 肌萎縮側索硬化癥 | Q治療公司 | 膠質限制性祖細胞(Q 細胞) | 移植到腰椎或頸脊髓 | 腰椎(劑量 1)、頸椎(劑量 1、2、3、4、5) | 30 | 2021年 | 1,2 | NCT02478450 |
| 5 | 肌萎縮側索硬化癥 | 雪松西奈醫療中心 | 表達 GDNF 的人神經祖細胞 (CNS10-NPC-GDNF) | 注射到運動皮層 | 5.25M、10.5M | 16 | 2022年 | 1 | NCT05306457 |
| 6 | 肌萎縮側索硬化癥 | 穆爾西亞地區衛生調查基金會 | 自體骨髓間充質干細胞 | 椎管內 | 沒有提到 | 11 | 2007年 | 1/2 | NCT00855400 |
| 7 | 肌萎縮側索硬化癥 | 穆爾西亞地區衛生調查基金會 | 自體骨髓間充質干細胞 | 鞘內 | 沒有提到 | 63 | 2010年 | 1/2 | NCT01254539 |
| 8 | 肌萎縮側索硬化癥 | 大連醫科大學第一附屬醫院 | 自體外周血MNC | 移植至蛛網膜下腔 | 沒有提到 | 14 | 2010年 | 娜 | NCT03085706 |
| 9 | 肌萎縮側索硬化癥 | 梅奧診所 | 自體脂肪間充質干細胞 | 椎管內 | 1M | 1 | 2010年 | 1 | NCT01142856 |
| 10 | 肌萎縮側索硬化癥 | 梅奧診所 | 自體脂肪間充質干細胞 | 鞘內 | 10、50、100M、200M | 27 | 2012年 | 1 | NCT01609283 |
| 11 | 肌萎縮側索硬化癥 | 梅奧診所 | 自體脂肪間充質干細胞 | 鞘內 | 60-150M | 60 | 2017年 | 2 | NCT03268603 |
| 12 | 肌萎縮側索硬化癥 | 科瑞斯特姆 | 自體 BM MSC(HYNR-CS 注射) | 鞘內 | 2米/公斤 | 71 | 2011年 | 1,2 | NCT01363401 |
| 13 | 肌萎縮側索硬化癥 | 科瑞斯特姆 | 自體 BM MSC [Lenzumestrocel (Neuronata-R Inj.)] | 鞘內 | 2M/kg 或 5M/kg | 115 | 2021年 | 3 | NCT04745299 |
| 14 | 肌萎縮側索硬化癥 | 頭腦風暴細胞療法 | 自體骨髓間充質干細胞分泌神經營養因子(MSC-NTF) | 鞘內和肌內注射 | IT (24 M)、IM (60 M) | 12 | 2011年 | 1,2 | NCT01051882 |
| 15 | 肌萎縮側索硬化癥 | 頭腦風暴細胞療法 | 自體骨髓間充質干細胞分泌神經營養因子(MSC-NTF) | 鞘內 | 94 M、141 M 或 188 M | 14 | 2012年 | 2 | NCT01777646 |
| 16 | 肌萎縮性側索硬化癥/ND | 漢陽大學首爾醫院 | 自體 BM MSC(HYNR-CS 注射) | 鞘內 | 0.5、1或2M/kg | 6 | 2012年 | 1 | NCT01758510 |
| 17 號 | 肌萎縮側索硬化癥 | 比奧伊諾瓦有限公司 | 自體骨髓間充質干細胞 | 鞘內 | 15 ± 4.5 M 細胞 | 26 | 2012年 | 1,2 | NCT03828123 |
| 18 | 肌萎縮側索硬化癥 | 何塞·岡薩雷斯博士大學醫院 | 自體造血干細胞 | 鞘內 | 沒有提到 | 14 | 2012年 | 2/3 | NCT01933321 |
| 19 | 肌萎縮側索硬化癥 | 魯瓦揚學院 | 自體骨髓間充質干細胞 | 靜脈注射 | 2米/公斤 | 6 | 2013年 | 1 | NCT01759797 |
| 20 | 肌萎縮側索硬化癥 | 魯瓦揚學院 | 自體骨髓間充質干細胞 | 鞘內 | 2米/公斤 | 8 | 2013年 | 1 | NCT01771640 |
| 21 | 肌萎縮側索硬化癥 | 魯瓦揚學院 | 同種異體脂肪間充質干細胞 | 靜脈注射 | 2米/公斤 | 19 | 2014年 | 1 | NCT02492516 |
| 22 | 肌萎縮側索硬化癥 | 頭腦風暴細胞療法 | 自體 BM MSC (NurOwn) | 鞘內和肌內注射 | 沒有提到 | 48 | 2014年 | 2 | NCT02017912 |
| 23 | 肌萎縮側索硬化癥 | 頭腦風暴細胞療法 | 自體骨髓間充質干細胞(NurOwn) | 鞘內 | 沒有提到 | 263 | 2017年 | 3 | NCT03280056 |
| 24 | 肌萎縮側索硬化癥 | 安達盧西亞先進療法倡議 – Fundación Pública Andaluza Progreso y Salud | 自體脂肪間充質干細胞 | 靜脈注射 | 1,2 或 4 M/kg | 52 | 2014年 | 1,2 | NCT02290886 |
| 25 | 肌萎縮側索硬化癥 | 中國醫科大學附屬醫院 | 自體脂肪間充質干細胞 | 靜脈注射和腦內注射 | IV(200-800M)、IC(100-400M) | 1 | 2015年 | 1 | NCT02383654 |
| 26 | 肌萎縮側索硬化癥 | Christóv?o da Gama 婦產醫院 | 自體間充質干細胞 | 鞘內 | 100M | 3 | 2015年 | 1 | NCT02987413 |
| 27 | 肌萎縮側索硬化癥 | 波蘭科學院莫薩科夫斯基醫學研究中心 | 自體脂肪再生細胞 | 椎管內/IT | 44米 | 30 | 2015年 | 1 | NCT03296501 |
| 28 | 肌萎縮側索硬化癥 | 哈達薩醫療組織 | 自體骨髓間充質干細胞 | 鞘內 | 4米/公斤 | 20 | 2016年 | 1,2 | NCT04821479 |
| 29 | 中風/TBI/帕金森/ALS/阿爾茨海默/癡呆 | MD干細胞 | 自體骨髓間充質干細胞 | 靜脈注射和鼻內注射 | 沒有提到 | 500 | 2016年 | 娜 | NCT02795052 |
| 30 | 肌萎縮側索硬化癥 | 波蘭銀行 Komorek Macierzystych JSC (PBKM) | 王家MSC | 鞘內 | 沒有提到 | 20 | 2020年 | 1,2 | NCT04651855 |
| 31 | 肌萎縮側索硬化癥 | 拉帕治療有限責任公司 | 自體雜交 TREG/Th2 細胞 (RAPA-501) | 靜脈注射 | 20M或80M | 21 | 2020年 | 1/2 | NCT04220190 |
| 32 | 肌萎縮側索硬化癥 | 穆爾西亞地區衛生調查基金會 | 自體骨髓跨國公司 | 肌內注射 | 沒有提到 | 100 | 2021年 | 2 | NCT04849065 |
MSC是最常用于治療ALS的細胞(32項試驗中的24項)。在所有試驗中,24項(73%)是I/II期試驗,主要是小患者樣本的安全性試驗,32項試驗中有11項沒有指定細胞劑量。需要更多的研究來闡明最有效的細胞來源和劑量、給藥方法和移植頻率,以及早期診斷疾病的能力,以在不可逆損傷發生之前改善細胞治療的結果。
神經干細胞與多發性硬化癥
多發性硬化癥(MS)是一種免疫介導的中樞神經系統脫髓鞘疾病,導致中樞神經系統神經變性和軸突損失。其特征是由離散的炎性脫髓鞘區域組成的早期急性病變,通過髓鞘再生解決或演變成慢性病變,伴有軸突損失、少突膠質細胞損失和神經膠質疤痕。目前的疾病修飾療法可以通過免疫抑制和免疫調節來預防或延緩疾病進展,盡管存在潛在的嚴重不良事件。一旦出現進行性殘疾,目前就無法治愈。
共檢索到48項涉及多發性硬化癥細胞治療的研究(表3),其中5項細胞來源為神經譜系(10.4%),22項使用MSC作為供體細胞,10項使用樹突狀細胞和T細胞作為免疫治療方法。在使用神經譜系細胞的臨床試驗中,2項使用自體來源,3項使用同種異體(2項胎兒血和1項臍帶血)。鞘內/心室內途徑是這些細胞的給藥方式。
第一個I期試驗于2014年開始,鞘內注射自體MSC衍生的NPC,分3劑,每劑1000萬個細胞,間隔3個月。MSC衍生的NPC是MSC的一個亞群,表現出神經外胚層譜系特征,但中胚層分化能力降低,最大限度地減少異位分化的風險。與MSC類似,這些NPC在體外和體內都表現出免疫調節和營養特性,同時上調包括肝細胞生長因子在內的營養因子,令人鼓舞的結果是一半參與者的肌肉力量和膀胱功能得到改善。此外,與基線相比,十分之四的參與者的擴展殘疾狀態量表評分有所下降,并且沒有報告嚴重不良事件。
| no | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 多發性硬化癥 | 紐約蒂施多發性硬化癥研究中心 | 自體 MSC 衍生的神經祖細胞 (MSC-NP) | 鞘內 | 6-30M | 20 | 2014年 | 1 | NCT01933802 |
| 2 | 多發性硬化癥 | 紐約蒂施多發性硬化癥研究中心 | 自體 MSC 衍生的神經祖細胞 (MSC-NP) | 鞘內 | 沒有提到 | 50 | 2018年 | 2 | NCT03355365 |
| 3 | 進行性多發性硬化癥 | IRCCS 圣拉斐爾 | 胎兒源性 NSC | 鞘內 | 0.7M、1.4M、2.8M、5.7M | 4 | 2017年 | 1 | NCT03269071 |
| 4 | 繼發性進展型多發性硬化癥 | 索利沃德拉索弗倫扎之家 IRCCS | 胎兒源性 NSC | 腦室內 | 5、10、16 和 24 M | 24 | 2017年 | 1 | NCT03282760 |
| 5 | 原發性進展型多發性硬化癥 | 喬安妮·庫茲伯格 | UCB 來源的少突膠質細胞樣細胞 (DUOC-01) | 鞘內 | 10 M(3 人)、10-25 M(3 人)、25-50 M(16 人) | 20 | 2021年 | 1a | NCT04943289 |
| 6 | 多發性硬化癥 | 貝勒醫學院 | 自體 CD34+ HSC | 靜脈注射 | 3M | 10 | 1999年 | 2 | NCT00040482 |
| 7 | 多發性硬化癥 | 渥太華醫院研究所 | 自體 CD34+ HSC | 靜脈注射 | 沒有提到 | 24 | 2001年 | 2 | NCT01099930 |
| 8 | 多發性硬化癥 | 哈達薩醫療組織 | 自體T細胞 | 皮下 | 10-30 M 細胞(×4 劑量) | 30 | 2002年 | 1/2 | NCT01448252 |
| 9 | 復發緩解型多發性硬化癥/繼發進展性多發性硬化癥 | 歐佩克薩治療公司 | 自體髓磷脂反應性 T 細胞 (Tovaxin) | 皮下 | 6-9 M、30-45 M 或 60-90 M | 16 | 2002年 | 1/2 | NCT00587691 |
| 10 | 復發緩解型多發性硬化癥 | 歐佩克薩治療公司 | 自體髓磷脂反應性 T 細胞 (Tovaxin) | 皮下 | 30-45米 | 150 | 2006年 | 2 | NCT00245622 |
| 11 | 多發性硬化癥/繼發性進展性多發性硬化癥 | 歐佩克薩治療公司 | 自體 T 細胞 (Tcelna/ Imilecleucel-T) | 皮下 | 30-45M(×5 年)×2 年 | 183 | 2012年 | 2 | NCT01684761 |
| 12 | 多發性硬化癥 | 西北大學 | 自體動員HSC | 靜脈 | 沒有提到 | 110 | 2005年 | 2 | NCT00273364 |
| 13 | 復發緩解型多發性硬化癥 | 國家過敏和傳染病研究所 (NIAID) | 自體 CD34+ HSC | 靜脈 | 沒有提到 | 25 | 2006年 | 2 | NCT00288626 |
| 14 | 復發性多發性硬化癥/復發緩解性多發性硬化癥/繼發進展性多發性硬化癥 | 國家過敏和傳染病研究所 (NIAID) | 自體造血干細胞 | 靜脈 | 4-7.5M CD34+ 細胞/kg | 156 | 2019年 | 3 | NCT04047628 |
| 15 | 多發性硬化癥 | 哈達薩醫療組織 | 自體骨髓間充質干細胞 | 鞘內和肌內注射 | IT (1M/kg) 和 IV (0.3-1M/kg) | 24 | 2006年 | 1/2 | NCT00781872 |
| 16 | 多發性硬化癥 | 哈達薩醫療組織 | 自體骨髓間充質干細胞 | 鞘內和肌內注射 | IT (1M/kg) 和 IV (1M/kg) 高達 8 倍 | 24 | 2013年 | 1/2 | NCT04823000 |
| 17 號 | 多發性硬化癥 | 塔拉瑞斯療法 | 同種異體造血干細胞 | 靜脈 | 沒有提到 | 3 | 2007年 | 1/2 | NCT00497952 |
| 18 | 多發性硬化癥 | 劍橋大學 | 自體骨髓間充質干細胞 | 靜脈 | 高達 2 M/kg | 10 | 2008年 | 1/2 | NCT00395200 |
| 19 | MS/自身免疫性疾病/小腦變性/ | 弗雷德·哈欽森癌癥中心 | 自體或同基因外周血干細胞 | 靜脈 | 至少 4 M CD34+ 細胞/kg | 80 | 2008年 | 2 | NCT00716066 |
| 20 | 自身免疫性疾病/神經系統疾病 | 安達盧西亞先進療法倡議 – Fundación Pública Andaluza Progreso y Salud | 自體脂肪間充質干細胞 | 靜脈 | 4米/公斤 | 30 | 2010年 | 1/2 | NCT01056471 |
| 21 | 多發性硬化癥 | 安達盧西亞先進療法倡議 – Fundación Pública Andaluza Progreso y Salud | 自體骨髓間充質干細胞 | 靜脈 | 1-2米/公斤 | 26 | 2013年 | 1/2 | NCT01745783 |
| 22 | 多發性硬化癥 | 魯瓦揚學院 | 自體骨髓間充質干細胞 | 靜脈 | 沒有提到 | 22 | 2011年 | 1/2 | NCT01377870 |
| 23 | 復發緩解型多發性硬化癥/繼發進展性多發性硬化癥/進行性復發性多發性硬化癥 | 克利夫蘭診所 | 自體骨髓間充質干細胞 | 靜脈 | 1-2米/公斤 | 24 | 2011年 | 1 | NCT00813969 |
| 24 | 多發性硬化癥 | 約旦大學 | 自體骨髓間充質干細胞 | 鞘內 | 13 | 2012年 | 2 | NCT01895439 | |
| 25 | 多發性硬化癥 | 約旦大學 | 同種異體WJ MSC | 信息技術和信息技術 | IT(200 M) 與 100 M (iv) | 60 | 2017年 | 1/2 | NCT03326505 |
| 26 | 進展型多發性硬化癥 | 北布里斯托爾 NHS 信托基金 | 自體骨髓細胞 | 靜脈 | 沒有提到 | 80 | 2012年 | 2 | NCT01815632 |
| 27 | 多發性硬化癥 | 北布里斯托爾 NHS 信托基金 | 自體骨髓細胞 | 靜脈 | 沒有提到 | 4 | 2014年 | 娜 | NCT01932593 |
| 28 | 復發緩解型多發性硬化癥 | 德國特里亞斯普霍爾醫院 | 自體骨髓間充質干細胞 | 靜脈 | 1米/公斤 | 9 | 2012年 | 1/2 | NCT02035514 |
| 29 | 多發性硬化癥 | 安東尼奧·烏切利 | 自體骨髓間充質干細胞 | 靜脈 | 1-2m米/公斤 | 20 | 2012年 | 1/2 | NCT01854957 |
| 30 | 多發性硬化癥 | 倫敦帝國理工學院 | 自體骨髓間充質干細胞 | 靜脈 | 1-2米/公斤 | 21 | 2012年 | 1/2 | NCT01606215 |
| 31 | 多發性硬化癥 | 卡羅林斯卡學院 | 自體骨髓間充質干細胞 | 靜脈 | 1-2米/公斤 | 7 | 2012年 | 1 | NCT03778333 |
| 32 | 多發性硬化癥 | 轉化生物科學 | 同種異體WJ MSC | 靜脈 | 140 M(7天以上,20 M/天) | 20 | 2014年 | 1/2 | NCT02034188 |
| 33 | 多發性硬化癥 | 薩拉·瓦雷亞 | 自體耐受樹突狀細胞 | 靜脈 | 沒有提到 | 20 | 2015年 | 1 | NCT02283671 |
| 34 | 多發性硬化癥 | 渥太華醫院研究所 | 自體骨髓間充質干細胞 | 靜脈 | 1-2米/公斤 | 31 | 2015年 | 2 | NCT02239393 |
| 35 | 復發緩解型 MS/繼發進展型 MS | 桑伊泰克西特銀行 | 自體骨髓間充質干細胞 (XCEL-MC-ALPHA) | 靜脈 | 沒有提到 | 8 | 2015年 | 1/2 | NCT02495766 |
| 36 | 多發性硬化癥 | 迪米特里奧斯·卡魯西斯 | 自體骨髓間充質干細胞 | 信息技術或靜脈注射 | 1米/公斤 | 48 | 2015年 | 2 | NCT02166021 |
| 37 | 復發緩解型 MS/繼發進展型 MS | 血液學和內科醫學中心 | 自體外周血干細胞 | 靜脈 | 至少 1 M/kg CD34+ 細胞 | 1000 | 2015年 | 娜 | NCT02674217 |
| 38 | 復發緩解型/慢性進行性多發性硬化癥 | 德國特里亞斯和普霍爾基金會基金會 | 自體 VitD3 耐受性單核細胞衍生樹突狀細胞 (tolDC-VitD3) | 結內 | 5M、10M、15M | 16 | 2017年 | 1 | NCT02903537 |
| 39 | 多發性硬化癥 | 安特衛普大學醫院 | 自體耐受樹突狀細胞(tolDC) | 皮內的 | 5M、10M、15M | 9 | 2017年 | 1 | NCT02618902 |
| 40 | 原發性和繼發性進展型多發性硬化癥 | 阿塔拉生物治療公司 | 同種異體 T 細胞 (ATA188) | 靜脈 | 沒有提到 | 265 | 2017年 | 1/2 | NCT03283826 |
| 41 | 慢性進行性多發性硬化癥 | 頭腦風暴-細胞療法 | 自體 BM MSC (NurOwn) | 鞘內 | 未提及(3 劑) | 20 | 2019年 | 2 | NCT03799718 |
| 42 | 復發緩解型多發性硬化癥 | 朱迪思·皮奇 | 自體外周血分化成體耐受性樹突狀細胞 | 靜脈 | 沒有提到 | 45 | 2020年 | 2 | NCT04530318 |
| 43 | 復發緩解型多發性硬化癥 | 纖維生物制劑 | 耐受性成纖維細胞 | 靜脈 | 100M | 5 | 2020年 | 1 | NCT05080270 |
| 44 | 多發性硬化癥 | 南特大學醫院 | 自體 EBV 特異性細胞毒性 T 細胞淋巴細胞 | 靜脈 | 沒有提到 | 7 | 2021年 | 1 | NCT02912897 |
| 45 | 復發緩解型多發性硬化癥 | 烏普薩拉大學 | 自體造血干細胞 | 靜脈 | 沒有提到 | 200 | 2021年 | 娜 | NCT05029206 |
| 46 | 多發性硬化癥 | 希望生物科學干細胞研究基金會 | 脂肪 MSC (HB-adMSC) | 靜脈 | 沒有提到 | 24 | 2021年 | 2 | NCT05116540 |
| 47 | 進展型多發性硬化癥 | 豪克蘭大學醫院 | 自體骨髓間充質干細胞 | 鞘內 | 沒有提到 | 18 | 2021年 | 1/2 | NCT04749667 |
| 48 | 多發性硬化癥 | ImStem生物技術公司 | ESC MSC (IMS001) | 靜脈 | 低劑量或高劑量 | 30 | 2021年 | 1 | NCT04956744 |
據報道,免疫療法取得了一些成功,例如使用針對髓磷脂堿性蛋白、髓磷脂少突膠質細胞糖蛋白和蛋白脂質蛋白 (PLP) 的自體T細胞,在隨機對照試驗中導致年復發率降低。絕大多數使用MSC的試驗數量較少(n=7-60),這表明靜脈或鞘內方法的結果相似。
罕見的神經退行性疾病
一組罕見的ND已歸入本節,包括Pelizaeus-Merzbacher病 (PMD)、Batten病和一些酶缺乏癥(表4)。PMD是一種X連鎖髓鞘形成不足疾病,會導致大腦白質逐漸退化,導致學習、協調和運動技能出現問題。PLP1基因的基因重復和點突變導致少突膠質細胞內質網髓鞘生成異常或運輸異常。神經元蠟質脂褐質沉著癥 (NCL),也稱為 Batten 病,是一種異質性溶酶體貯積病,其特征是神經變性,具有進行性視力和認知能力下降的共同臨床特征。
表4.ClinicalTrials.gov上列出了針對Batten和Pelizaeus-Merzbacher疾病的臨床試驗。
| no | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 巴頓病 | 干細胞公司 | 中樞神經系統 | 皮質下部位和側腦室立體定向注射 | 低劑量(700M)、高劑量(1400M) | 6 | 2006年 | 1 | NCT00337636 |
| 2 | PMD | 干細胞公司 | 中樞神經系統 | 腦內 | 300M | 4 | 2009年 | 1 | NCT01005004 |
| 3 | PMD | 干細胞公司 | 中樞神經系統 | 腦內 | 300M | 4 | 2011年 | 1 | NCT01391637 |
| 4 | Batten/MPS II/NP/PMD/先天性代謝性腦病/ | 喬安妮·庫茲伯格 | UCB 來源的少突膠質細胞樣細胞 (DUOC-01) | 鞘內 | 50.1-350.1米/公斤 | 12 | 2014年 | 1 | NCT02254863 |
| 5 | 板條/NP/高雪氏/ | 共濟會癌癥中心 | 同種異體 BM 和 UCB HSC | 靜脈 | 沒有提到 | 135 | 1995年 | 2,3 | NCT00176904 |
| 6 | NP/PMD/Tay Sachs/Krabbe/Batten/Sandhorf 病 | Talaris 治療公司 | 同種異體造血干細胞 | 靜脈 | 沒有提到 | 30 | 2011年 | 1,2 | NCT01372228 |
| 7 | Batten/MPS I 和 IV/NP/Gauchers/Krabbe/巖藻糖苷沉積癥 | 紐約醫學院 | 胎盤來源的 SC 和臍帶血 | 靜脈 | 沒有提到 | 43 | 2013年 | 1 | NCT01586455 |
迄今為止,已經有一些基于干細胞的臨床試驗,細胞來源范圍從人類胎兒中樞神經系統衍生的NSC到來自骨髓和圍產期組織(包括胎盤、臍帶和臍帶血)的造血干細胞(HSC)。3項試驗使用了直接CNS遞送同種異體CNS衍生的NSC,其中一項試驗使用了臍帶血衍生的少突膠質細胞樣細胞。使用人類CNS干細胞治療NCL是一項涉及純化的人類NSC群的首次人體臨床試驗,用于ND (NCT00337636)。結果表明,NCL中的神經細胞移植基本上是安全的,尸檢時確定了長期植入的證據,表明NSC在ND中具有治療作用。
神經干細胞與亨廷頓氏病
亨廷頓病 (HD) 是一種常染色體顯性ND,認知、運動和精神能力在2-3年內逐漸下降。HD主要影響中等棘紋狀體神經元,使其成為細胞治療的有吸引力的目標。在檢索到的4項試驗中,只有1項使用胎兒神經元組織(表5)。在這項具有開創性的法國研究中,人類胎兒移植物在6年的時間里證明了3名參與者的存活率以及運動和認知功能的顯著改善,但此后逐漸消失,表明缺乏永久治愈方法。其他3項試驗涉及使用MSC,特別是Cellavita-HD,最新的II/III期試驗于2020年啟動。
| no | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 亨廷頓氏病 | 公共援助 – 巴黎醫院 | 胎兒神經元 | 腦內 | 沒有提到 | 54 | 2002年 | 2 | NCT00190450 |
| 2 | 亨廷頓病 | 阿齊杜斯·巴西 | 未成熟牙髓間充質干細胞(NestaCell-HDTM) | 靜脈 | 3M/kg 或 6M/kg | 6 | 2017年 | 1 | NCT02728115 |
| 3 | 亨廷頓氏病 | 阿齊杜斯·巴西 | 未成熟牙髓間充質干細胞(NestaCell-HDTM) | 靜脈 | 9M/kg 或 18M/kg | 35 | 2018年 | 2 | NCT03252535 |
| 4 | 亨廷頓氏病 | 阿齊杜斯·巴西 | 未成熟牙髓間充質干細胞(NestaCell-HDTM) | 靜脈 | 24米/公斤 | 35 | 2020年 | 2,3 | NCT04219241 |
據Kim等人評論,還有許多其他旨在治療HD的活躍臨床試驗,其中干細胞療法約占 10% (3/28)。干細胞的優勢在于,新的神經元可以替代受影響大腦區域中的退化細胞,從而改善疾病狀況。通過將細胞改造為過度分泌BDNF、GDNF或其他神經營養因子,或者將干細胞與HD基因修飾療法相結合,可以進一步提高這種功效。
神經干細胞與黃斑變性
黃斑變性 (MD) 有兩種主要形式:Stargardt病 (STGD1) 是兒童和年輕人MD的最常見原因,年齡相關性黃斑變性影響著世界人口的8.7%,而Stargardt病是ABCA4基因突變的結果,并導致逐漸嚴重的損害的視線。萎縮性年齡相關性MD的關鍵特征是視網膜色素上皮 (RPE) 和覆蓋的感光細胞進行性萎縮,如STGD1,而年齡相關性MD是由于暴露于遺傳和環境因素的免疫介導和氧化應激所致。盡管用健康細胞補充退化的 RPE 細胞可以通過支持上層感光細胞的功能和存活而帶來益處,但它們目前無法治愈。
列出了22項試驗,其中16項涉及神經相關細胞(表6)。其中6項試驗使用了來自ESC系MA09的ESC衍生RPE細胞。第一個ESC衍生的RPE 細胞于2011年啟動,有12名參與者 (NCT01469832),其中視網膜下注射200000個ESCs-RPE細胞被發現是安全的,但沒有確定益處。另外2項試驗(針對STGD1的NCT01345006和針對年齡相關性MD的NCT01344993)證明,在移植后長達37個月內使用相同的hESC-RPE來源,獲得了類似的令人放心的安全結果。
在這2項僅對1只眼睛進行治療的試驗中,除了與視力相關的生活質量指標有所改善外,大多數接受治療的眼睛(17只眼睛中的10只)的最佳矯正視力 (BCVA) 均有所改善。此后,3家公司開發了至少4種不同的ESC衍生的RPE細胞產品(CPCB-RPE1、ASP7316、ASP7317和PF-05206388),目前正在進行針對不同形式MD的I/II期臨床試驗(表6)。
| no | 疾病 | 贊助 | 細胞類型 | 路線 | 細胞劑量 | 計劃參加者 | 年 | 階段 | 臨床試驗 # |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 斯塔加特病 | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 12 | 2011年 | 1/2 | NCT01469832 |
| 2 | 斯塔加特病 | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 12 | 2013年 | 1/2 | NCT02941991 |
| 3 | AMD | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 13 | 2011年 | 1/2 | NCT01344993 |
| 4 | AMD | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 11 | 2013年 | 1/2 | NCT02463344 |
| 5 | 斯塔加特病 | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 13 | 2011年 | 1/2 | NCT01345006 |
| 6 | 斯塔加特病 | 安斯泰來再生醫學研究所 | ESC RPE (MA09-hRPE) | 視網膜下 | 50 000、100 000、150 000 和 200 000 | 13 | 2012年 | 1/2 | NCT02445612 |
| 7 | AMD | 干細胞公司 | 中樞神經系統 | 視網膜下 | 200 000/1M | 15 | 2012年 | 1/2 | NCT01632527 |
| 8 | AMD | Lineage Therapeutics/霍夫曼-拉羅氏 | ESC RPE(奧普雷根) | 視網膜下 | 50 000-200 000 | 24 | 2015年 | 1/2 | NCT02286089 |
| 9 | AMD/Stargartd | 圣保羅聯邦大學 | ESC RPE | 視網膜下 | 100 000 | 15 | 2015年 | 1/2 | NCT02903576 |
| 10 | 干MD/GA | 再生補丁技術有限公司 | ESC RPE (CPCB-RPE1) | 視網膜下 | 100 000 | 16 | 2016年 | 1/2 | NCT02590692 |
| 11 | 黃斑變性疾病 | 安斯泰來再生醫學研究所 | 電調 RPE (ASP7316) | 視網膜下 | 沒有提到 | 36 | 2018年 | 1/2 | NCT03167203 |
| 12 | AMD | 安斯泰來再生醫學研究所 | 電調 RPE (ASP7317) | 進入黃斑區 | 低、中、高細胞劑量 | 18 | 2018年 | 1 | NCT03178149 |
| 13 | AMD | 國家眼科研究所 | 自體 iPSC RPE | 視網膜下 | 沒有提到 | 20 | 2020年 | 1/2a | NCT04339764 |
| 14 | AMD | 莫菲爾德眼科醫院 NHS 基金會信托 | ESC RPE (PF-05206388) | 眼 | 沒有提到 | 10 | 2021年 | 1 | NCT01691261 |
| 15 | 黃斑變性 | 北京同仁醫院 | 自體 iPSC RPE | 視網膜下 | 沒有提到 | 10 | 2022年 | 1 | NCT05445063 |
| 16 | AMD | 白俄羅斯國家科學院生物物理與細胞工程研究所 | 自體培養視網膜干細胞和祖細胞 | 視網膜下 | 沒有提到 | 20 | 2022年 | 1/2 | NCT05187104 |
| 17 號 | AMD | 楊森研究與開發 | 臍帶組織細胞(CNTO2476) | 視網膜下 | 60K、120K、300K、560K | 39 | 2010年 | 1/2 | NCT01226628 |
| 18 | 遺傳算法MD | 楊森研究與開發 | 臍帶組織細胞(CNTO2476) | 視網膜下 | 0.3M | 21 | 2015年 | 2 | NCT02659098 |
| 19 | AMD/Stargartd 病 | 圣保羅大學 | 自體骨髓SC | 玻璃體內 | 10M | 20 | 2011年 | 1/2 | NCT01518127 |
| 20 | 視網膜病變/年齡相關性和遺傳性黃斑變性 | 加州大學 | 自體骨髓SC | 玻璃體內 | 沒有提到 | 15 | 2012年 | 1 | NCT01736059 |
| 21 | 視網膜病變/年齡相關性和遺傳性黃斑變性 | MD干細胞 | 自體骨髓SC | 球后、玻璃體內、視網膜下、視內 | 240 M(球后)、4 M(玻璃體內)、8 M(視網膜下、視內) | 500 | 2016年 | na | NCT03011541 |
| 22 | 黃斑變性/RP | 骨科與再生醫學基金會 | UC MSC | 四、筋膜下 | 100M | 20 | 2022年 | 1 | NCT05147701 |
其中,CPCB-RPE1已被證明是安全的,并且對于患有晚期干齡相關MD的參與者在移植后1年具有良好的耐受性,15名參與者中有4名的BCVA有所改善。在較高劑量的hESC衍生的RPE下,觀察到局灶性敏感性降低和色素沉著過度視網膜變薄的情況,這表明存在潛在的危害,并表明應謹慎對待退化早期階段的干預。
2013年,高橋博士在1名患者中領導了第一個使用自體人iPSC衍生的RPE治療MD的臨床試驗。除了黃斑囊樣水腫外,該患者沒有出現嚴重的不良事件或排斥反應,BCVA在移植后1年保持穩定(JPRN-UMIN000011929)。
目前還有另外2項針對MD的自體iPSC-RPE試驗已注冊(2020年的NCT04339764和2022年的NCT05445063)。
大多數用于治療MD的供體細胞通常是分化的RPE細胞類型。盡管如此,我們發現有6項試驗使用自體骨髓干細胞 (BMSC)、人臍帶組織來源的細胞和同種異體臍帶MSC通過各種途徑進行細胞治療(表6)。盡管第一次試驗早在2011年就進行了,但目前還沒有使用細胞療法治療MD的III期試驗,這暗示了開發有效的MD細胞療法的困難。
討論
我們發現8項臨床試驗涉及NSCs,10項涉及神經祖細胞,23項涉及分化神經細胞。
NSCs已顯示出治療ND的潛力,但尚未得到充分利用。
哺乳動物大腦通過神經發生和膠質細胞生成進行修復和再生的能力有限。在可用于治療的細胞來源中,NSCs比其他細胞來源更具優勢,因為它不僅能促進多能分化,替代神經和非神經細胞類型,還能通過分泌營養因子參與調節炎癥損傷。另一方面,胎兒組織移植需要多個供體,因為每個供體的干細胞數量少,而且移植存活率低,移植前還需要協調收集、處理和分析工作,因此給后勤工作帶來了巨大挑戰。
生物工程支架能再現細胞外基質的條件,加強不同類型細胞、移植細胞和宿主細胞、健康組織和損傷組織之間的交換和串聯,同時提供細胞支持,這將是向前邁進的一步。
使用先進的低溫保存技術可能有助于解決神經外科移植手術日程安排方面的一些后勤問題。當務之急是進一步提高從不同細胞來源精確分化所需細胞的能力,同時將致瘤風險降至最低,并對這些細胞的特征進行標準化,以確定其多重潛能或系限制。
對于通過直接神經移植術進行的細胞療法,開發微創但高度精確的手術技術也至關重要,而目前更高分辨率的成像技術可實現準確的移植置放和術后觀察,因此現在正是時候,同樣重要的是,在設計隨機安慰劑對照試驗的同時,規范疾病評分量表和長期可衡量的結果,以確定治療的有效性。最后,我們需要推進早期檢測和干預,以發揮細胞療法的最大潛力。
參考資料:范一平等,神經細胞治療神經退行性疾病的臨床試驗,干細胞轉化醫學,2023,szad041, https: //doi.org/10.1093/stcltm/szad041
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信