干細胞醫療技術臨床應用始于1968年,世界上第一例骨髓移植術治療了一位重癥聯合免疫缺陷患者,從而開啟干細胞在醫學上的應用之門。
細胞產業?
隨著全球干細胞產業也邁入了高速發展期,當前全球已登記的干細胞相關臨床試驗已超過 7000余項,其中近3000 項已完成臨床試驗研究,并進行了數萬例干細胞移植。
截止2022年初,全球經批準的細胞治療產品共33款,包括12種免疫細胞產品和21種干細胞產品,令人期待的是,許多已經批準的細胞療法正在開發新的適應癥。
隨著全球范圍內干細胞治療技術和產業化快速發展,各國家密集發布支持性政策,多種成熟產品陸續走向市場,干細胞產業即將翻開新的篇章。
1
全球干細胞治療產業發展現狀
干細胞資源是國家重要的戰略資源,如何安全有效的保存我國特殊、唯一、稀有的人類生物資源,對促進我國人口健康、維護生命資源安全、治療重大疾病等具有重要的意義。
干細胞的重要價值體現之一是在疾病治療中的應用。
諾貝爾生理學或醫學獎獲得者Thomas C. Sudhof教授曾表示, “我們可以把疾病進行控制,干細胞是一個非常好的治療方法。在傳統醫學治療無法解決的問題上,干細胞研究將帶來新的希望。”
△ Thomas C. Sudhof教授
國際上美國、韓國、日本、歐盟等均已有經批準的干細胞治療產品上市,干細胞治療疾病正成為更為廣泛的現實。
根據美國國立衛生研究院管理的臨床研究登記系統(Clinicaltrials.gov)數據顯示,截至2021年8月,全球登記的干細胞臨床研究項目共計5903項。目前全球登記的干細胞臨床研究項目主要是成體干細胞臨床試驗,涉及血液病、腫瘤、神經系統疾病、心臟疾病、免疫系統疾病等領域。
其中美國保持絕對領先的地位,截至2021年,美國干細胞臨床研究項目數量達到2837項,遠多于其他各國;中國、法國和德國的干細胞臨床研究項目數量分別為628項、364項和322項。
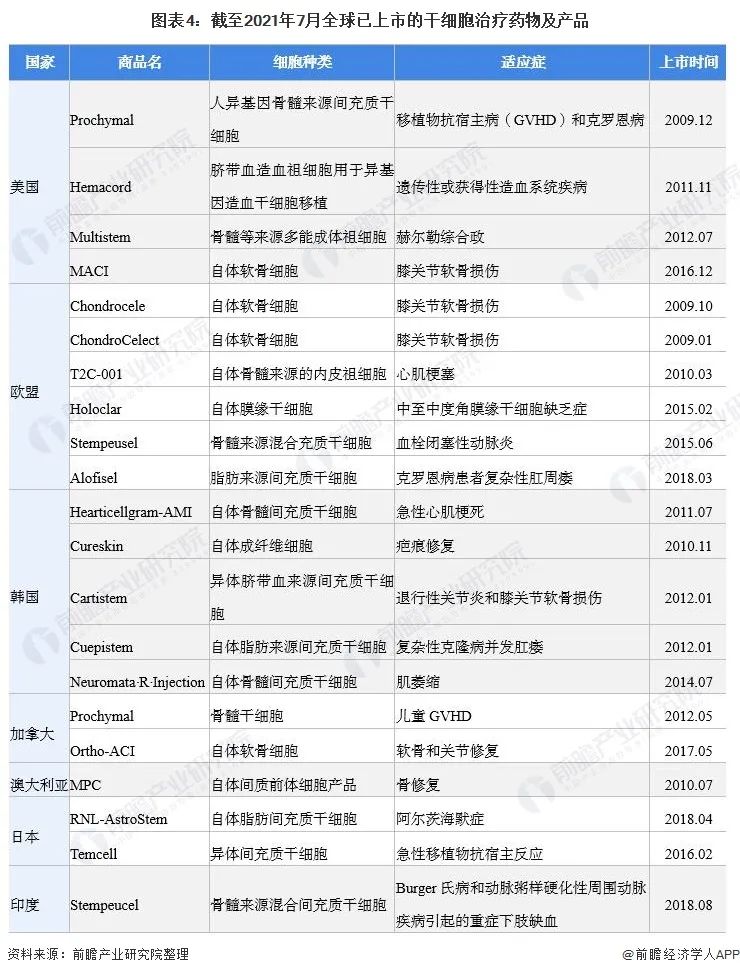
截止2021年9月,全球已經有21款干細胞產品獲批上市,分布于美國、歐盟、韓國、加拿大、澳大利亞和日本等地。其中,歐盟批準數量最多,有6款產品獲批上市;韓國有5款產品獲批。
2
國內外干細胞產業相關政策
目前,歐美日韓等發達國家高度重視干細胞產業的發展,并認為干細胞產業將是本國繼續引領未來生物科技領域的重要支撐,都出臺了比較完整的干細胞產業政策體系。
我國參照發達國家的發展經驗,結合我國干細胞產業的發展實際,也出臺了一系列政策法規,為干細胞產業的發展提供了有利的政策支持。
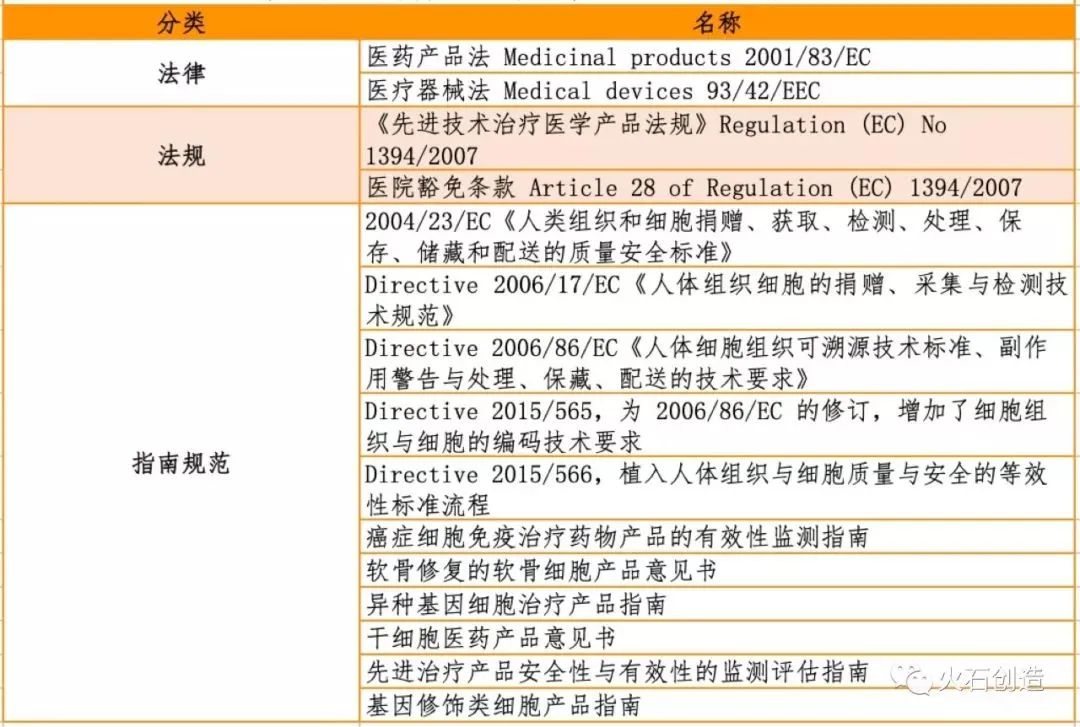
△ 美國有關干細胞治療產品主要監管法律法規和指南規范
△ 歐盟有關干細胞治療產品主要監管法律法規和指南規范
△ 日本、韓國和中國有關干細胞治療產品的主要監管法律法規和指南規范
3
中國對干細胞行業發展的政策支持
中國在政策上大力支持干細胞移植領域,每年都會對干細胞研究項目提供資金支持。
隨著干細胞基礎研究不斷成熟,行業內也急需相應的法規來規范和引導干細胞臨床轉化應用,在 2015 年原國家衛生計生委先后出臺了干細胞三大政策《干細胞臨床研究管理辦法(試行)》、《干細胞制劑質量控制及臨床前研究指導原則(試行)》、《關于開展干細胞臨床研究機構備案工作的通知》文件。
《干細胞臨床研究管理辦法(試行)》規定,干細胞治療相關技術不再按照第三類醫療技術管理。這是中國第一份針對干細胞臨床研究進行管理的規范性文件,有力地推進了中國干細胞臨床研究工作的的規范化管理。
△ 關于印發《干細胞臨床研究管理辦法(試行)》的通知
國家十分重視干細胞研究,最近幾年出臺了一系列政策為干細胞研究和應用保駕護航。
2020年9月,國務院發布《關于印發北京、湖南、安徽自由貿易試驗區總體方案及浙江自由貿易試驗區擴展區域方案的通知》,鼓勵自貿區內開展跨境遠程醫療等臨床醫學研究,和按照有關規定開展干細胞臨床前沿醫療技術研究。
2021年,北京、上海、天津、浙江、海南、云南等省和直轄市緊鑼密鼓的出臺細胞治療相關政策,加速推動干細胞技術和產品的臨床應用和審批。

4
全球細胞上市藥物
截止2022年初,全球經批準的細胞治療產品共33款,包括12種免疫細胞和21種干細胞。值得注意的是,許多已經批準的細胞療法正在開發新的適應癥。
1
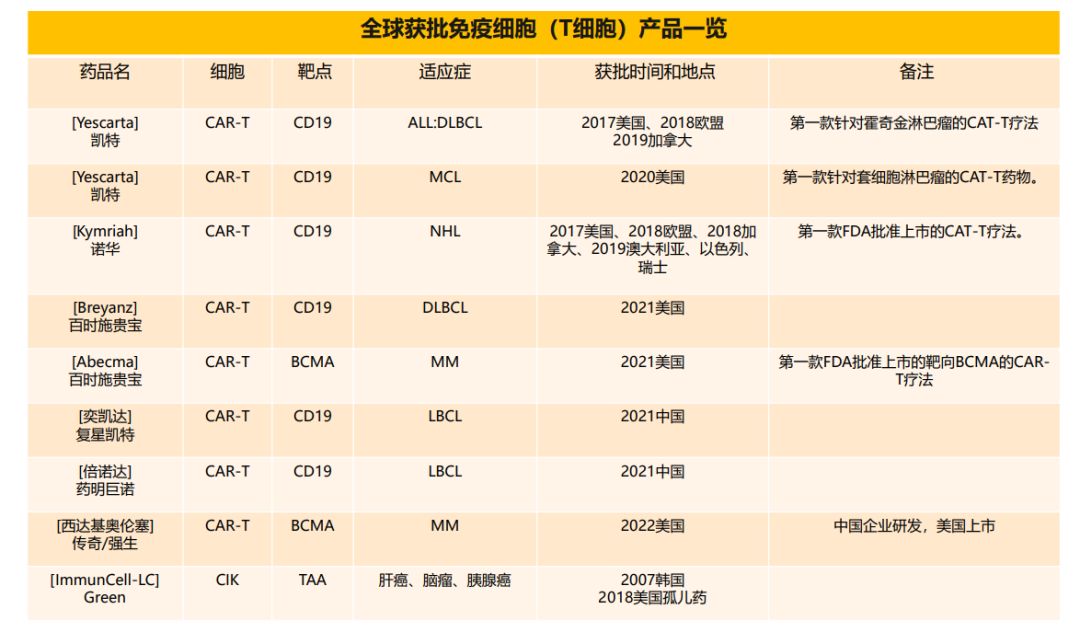
全球臨床批準的免疫細胞藥物產品
目前,全球范圍內共批準了9種T細胞相關產品,其中美國FDA批準上市6 款CAR-T 產品,中國NMPA批準上市2款CAR-T產品。有意思的是,韓國KFDA批準上市1款CIK產品。
2
全球獲批上市的干細胞藥物產品
目前,干細胞治療行業蓬勃發展,全球已經有21款干細胞產品獲批上市,分布于美國、歐盟、韓國、加拿大、澳大利亞和日本等地。
全球登記的干細胞臨床研究項目已接近7000余項,其中有接近3000項已經完成臨床試驗研究,未來幾年內全球范圍將有更多干細胞藥物獲批上市。
目前全球批準的間充質干細胞產品共有 10 種,根據作用機制和批準的適應癥間充質干細胞產品可分為兩大類:組織修復和免疫調節。
已經獲批的間充質干細胞藥物產品,其中,有三種被批準用于組織修復應用。適應癥分別是急性心肌梗死,重復性和/或創傷性軟骨退行性病變、包括退行性骨關節炎,皮下組織缺損。
獲批的間充質干細胞產品中,有七款用于調節多種疾病的免疫反應。適應癥包括克羅恩病(Alofisel、Cupistem)、急性移植物抗宿主病(Prochymal、TEMCELL)、肌萎縮側索硬化(NeuroNata-R)、脊髓損傷(Stemirac)和Buerger病引起的嚴重肢體缺血(Stempeucel)。
5
中國干細胞研究現狀
中國已有23款干細胞藥物獲得臨床試驗默示許可
為鼓勵新藥研發和提高新藥審批效率,我國開啟了新藥臨床默認審批制度,新藥臨床試驗也由過去的審批制度轉變為默示許可制。
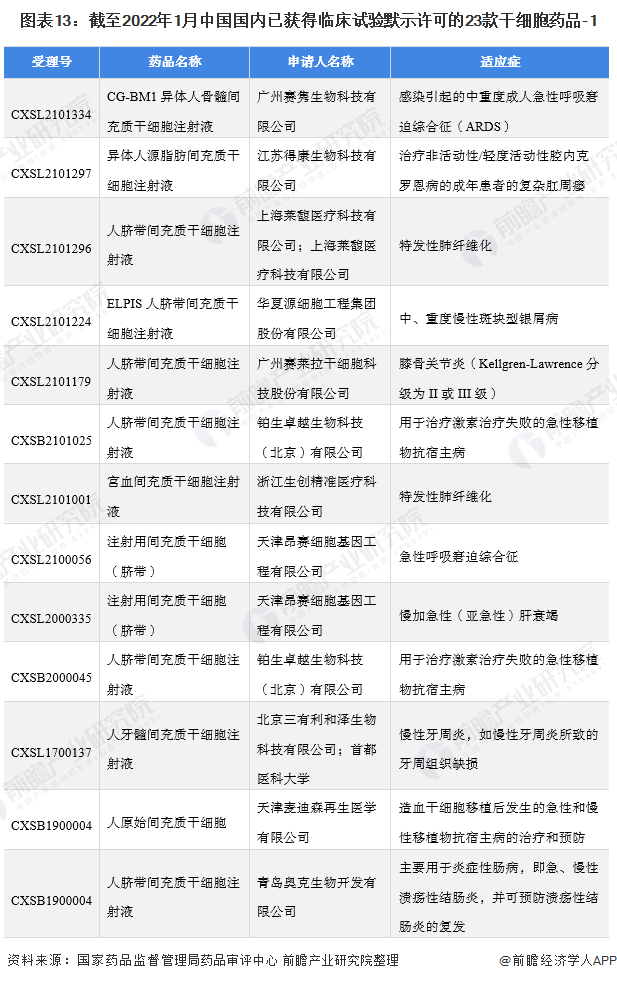
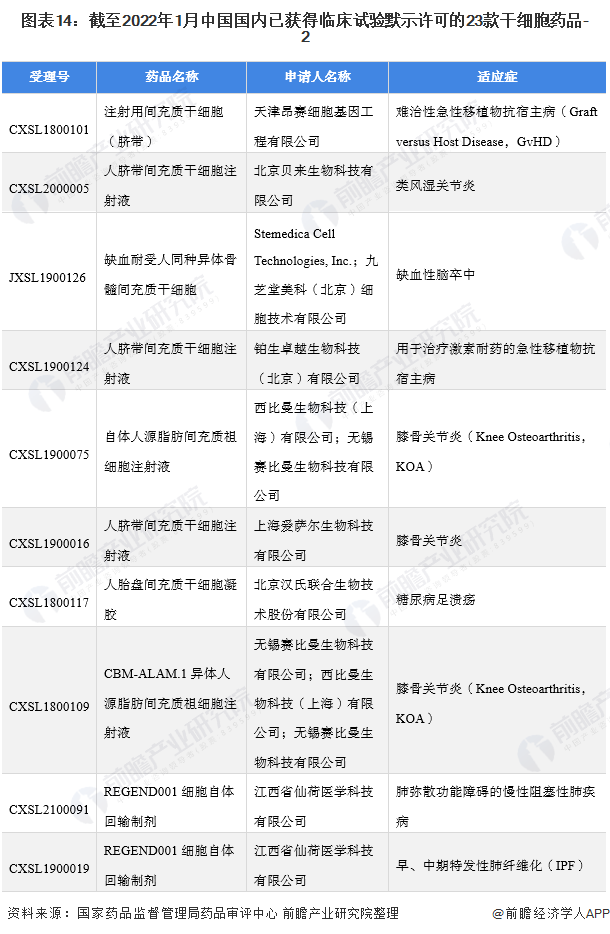
在干細胞臨床應用方面,根據國家藥品監督管理局藥品審評中心(CDE)公示信息顯示,截止2022年1月5日,共有23個干細胞新藥項目獲得國家臨床默示許可——
分別是胎盤、臍帶、骨髓、牙髓、宮血、異體/自體脂肪來源的間充質干細胞,適應證包括了膝骨關節炎、類風濕關節炎、糖尿病足潰瘍、肺纖維化、肝衰竭、卒中、急性呼吸窘迫綜合征、牙周炎、克羅恩病和GvHD等。
中國干細胞研究備案項目111個研究備案機構133家
2021年11月,山東省“人臍帶間充質干細胞注射液治療中-重度持續性變應性鼻炎的臨床研究”、“臍帶間充質干細胞靜脈輸注治療酒精性失代償期肝硬化的安全性、耐受性及初步有效性臨床研究”兩個干細胞臨床研究項目在國家衛健委成功備案。
此外,此次全國共有11個干細胞臨床研究項目在國家衛健委備案成功。
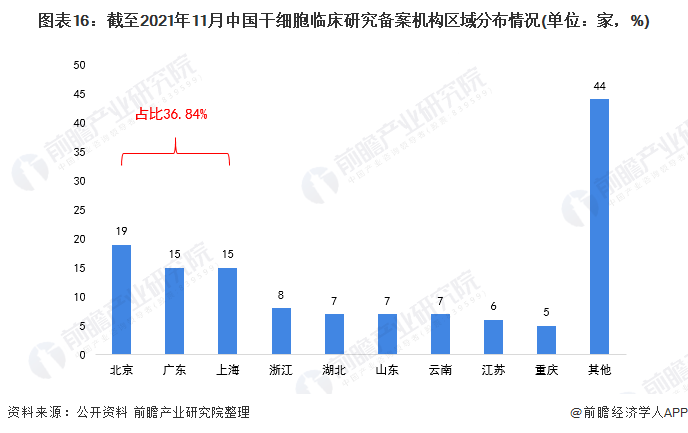
截至2021年11月,干細胞臨床研究備案項目達到111個,干細胞臨床研究備案機構133家(含軍隊醫院)。
中國干細胞醫療產業競爭格局分析
根據對上述133家備案機構歸屬地的匯總與整理,北京、廣東、上海的干細胞臨床研究備案機構數量最多,分別達到19家、15家和15家。個省市干細胞臨床研究備案機構數量的總和占全國干細胞臨床研究備案機構總量的36.84%。
基本已形成區域競爭格局:北京、廣東、上海干細胞臨床研究備案機構占比近四成。
6
干細胞產業前景
隨著各國政策的逐步放開,干細胞治療相關的監管指導意見相繼出臺,生物技術公司的前期基礎科研結果和臨床試驗數據的積累等都為干細胞治療行業的發展打下良好的基礎,干細胞產業前景也十分明朗——
“
新冠疫情催生市場持續發展。
在新冠疫情肆虐之下,干細胞治療方法表現出了深的潛力和可應用前景,干細胞可以用來控制和治療疾病,再生醫學的研究和普及推動了干細胞治療市場的增長。
“
干細胞治療將會與精準醫療緊密相結合
干細胞治療正成為繼藥物治療、手術治療后的另一種治療途徑,正在引領一場醫學革命。正如上文提到的干細胞移植治療技術被譽為人類有史以來最為飛躍式的醫療手段,未來干細胞用于其他疾病的研究正在進行中。
“
全產業鏈布局的企業優勢明顯
隨著干細胞有關技術的迅速發展,對企業的要求越來越高,未來發展干細胞全產業鏈的企業將在市場上占據優勢地位。
值得一提的是:當前,中國已經涌現一批干細胞企業向全產業鏈的方向發展,這些企業通過產業各個環節互相支持,依靠采集、儲存、研究、治療于一體的干細胞全產業鏈,不僅打造了良好的生態圈,還對整個產業的良性發展起到了正向作用。
我國細胞產業的發展可以說在全球已經處于第一梯隊,而人們也更加期待,優秀的醫療科研者,必將會用這一先進的技術,為大眾帶來更加健康、高品質的生活。
內容來源:丁院士講細胞








 掃碼添加微信
掃碼添加微信