間充質干細胞與亨廷頓病
亨廷頓氏病的發生是由于編碼一種稱為亨廷頓蛋白的蛋白質的基因發生突變,該蛋白質在細胞中過量積累并具有細胞毒性作用。在HD期間,腦神經元死亡,特別是位于紋狀體結構內的神經元,例如尾狀核和殼,分泌γ-氨基丁酸。這種疾病的癥狀通常出現在30-40歲左右,并且與運動功能、行為和認知能力受損有關。
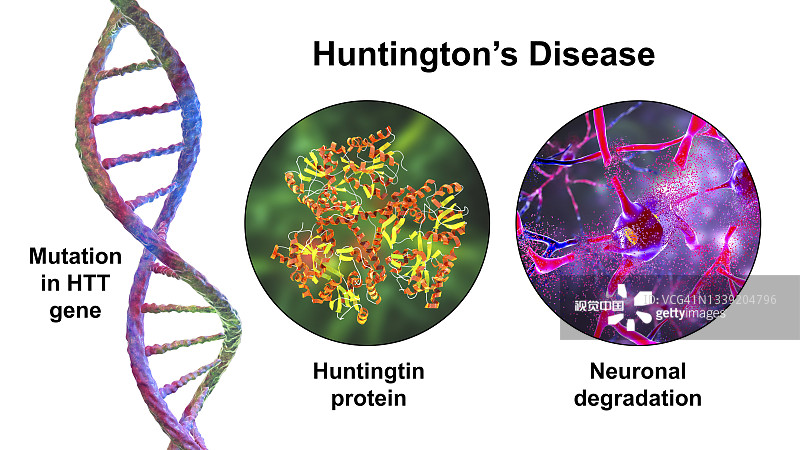
間充質干細胞成為治療亨廷頓病的新希望
目前對亨廷頓病的治療方式主要以對癥治療為主,主要包括多巴胺拮抗劑、苯二氮卓類藥物、谷氨酸鹽拮抗劑、乙酰膽堿酯酶抑制劑、大麻類藥物、鋰劑、深度腦刺激。表1提供了藥物名稱、藥物化學結構,對癥治療的可選擇方案。
間充質干細胞治療亨廷頓氏病的臨床前研究
在HD動物模型中報道了間充質干細胞的治療效果。對于迄今為止在HD中進行的大多數間充質干細胞移植研究,外源細胞是通過腦內給藥的。用BM-MSC治療的HD小鼠表現出運動缺陷減少和空間記憶改善。移植的BM-MSC刺激了內源性神經干細胞增殖,這可能是通過誘導HD小鼠紋狀體BDNF水平增加的營養支持。用過表達BDNF或NGF因子的基因工程間充質干細胞治療的HD小鼠顯示紋狀體區域的凋亡細胞減少,腦萎縮減少。
除了間充質干細胞的顱內注射外,還在HD小鼠模型中進行了鼻內細胞給藥。與未經治療的小鼠相比,經治療的小鼠睡眠周期規律,存活時間延長,后者表現出晝夜節律紊亂和壽命縮短。
作者表明,鼻內輸注自體BM衍生的間充質干細胞導致紋狀體酪氨酸羥化酶 (TH) 和與多巴胺信號級聯中涉及的多巴胺D1受體 (DARPP-32) 相關的磷蛋白表達增加。間充質干細胞治療還揭示了通過小膠質細胞形態改變為M2抗炎亞型和抑制TNF?-α促炎基因表達的免疫調節作用、IL-6和MCP-1,通常在HD小鼠的大腦中上調。
由于疾病的復雜癥狀,HD的臨床治療一直極具挑戰性。已經證明,HD患者具有低水平的BDNF,負責皮層神經元的存活和功能。在轉基因HD嚙齒動物模型中恢復BDNF水平可提高神經元存活率并改善HD癥狀。因此,可以考慮將BDNF用于治療在HD患者中觀察到的神經元功能障礙。然而,實驗研究表明,由于蛋白質的半衰期短,直接注射BDNF對HD疾病無效。因此,擬議的HD患者臨床試驗被任命為移植過表達BDNF的基因工程MSCs ( NCT01937923)。
根據實驗研究,間充質干細胞治療揭示了HD小鼠和大鼠模型的運動和認知缺陷得到改善。在HD疾病中移植的人類間充質干細胞減少了在紋狀體和HTT聚集體中觀察到的萎縮,并刺激了內源性神經發生并延長了壽命。從臨床前研究中獲得的積極結果表明,間充質干細胞療法可能對HD患者具有吸引力。
亨廷頓病是一種進行性的神經退行性疾病,迄今為止所有的治療方法在于緩解癥狀,無法從根本治愈疾病。但間充質干細胞新療法已經在研究中取得了一些重大進展,其中一些已經進入臨床試驗階段,為HD的治療提供了一線希望。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信