1型糖尿病 (T1D) 影響著全球約1000萬人,且在兒童和青少年中的患病率呈穩(wěn)步增長趨勢。這種疾病是由胰島β細(xì)胞的選擇性自身免疫性破壞引起的,而β細(xì)胞的功能是生物合成和調(diào)節(jié)胰島素的分泌。治愈1型糖尿病的一個關(guān)鍵策略是用有活力且功能正常的細(xì)胞替換受損/破壞的β細(xì)胞,同時防止免疫排斥以及復(fù)發(fā)性自身免疫。

歷史上,第一次臨床嘗試可以追溯到20世紀(jì)70年代,在對糖尿病動物模型進(jìn)行多年的臨床前研究之后,人們從尸體人類捐獻(xiàn)的胰腺中提取胰島,并將其移植到T1D受體體內(nèi)。
然而,尸體供體胰島數(shù)量有限,加之受體往往需要長期免疫抑制,嚴(yán)重制約了胰島移植的臨床應(yīng)用。這一困境促使研究者尋求新的胰島素分泌細(xì)胞來源,并探索替代免疫抑制的策略,以提升移植的可行性與安全性。
新研究有望終結(jié)胰島素注射!《糖尿病雜志》:干細(xì)胞治療1型糖尿病迎來轉(zhuǎn)機(jī)
在這一背景下,國際著名期刊《糖尿病/代謝研究》近期刊發(fā)的”正在開發(fā)治療1型糖尿病的干細(xì)胞療法”研究綜述指出,人類干細(xì)胞因其供應(yīng)幾乎無限且具備分化潛力,被視為重要解決方案[1]。

ESCs、iPSCs和MSCs均有應(yīng)用前景:ESCs與iPSCs可分化為胰島樣細(xì)胞,但分別面臨倫理爭議與技術(shù)挑戰(zhàn),并存在免疫排斥問題;MSCs雖難以轉(zhuǎn)分化為類β細(xì)胞,但具備強(qiáng)大免疫調(diào)節(jié)優(yōu)勢且無倫理障礙。
胰島移植當(dāng)前成就與局限與細(xì)胞替代療法的進(jìn)展與挑戰(zhàn)
胰島移植作為治療1型糖尿病的一種關(guān)鍵策略,通過替換被自身免疫破壞的β細(xì)胞,已在部分醫(yī)療中心取得顯著成效。得益于胰島制備技術(shù)的提升和免疫抑制方案的優(yōu)化,當(dāng)前移植可有效逆轉(zhuǎn)高血糖、幫助患者擺脫胰島素依賴,并實(shí)現(xiàn)糖化血紅蛋白正常化等代謝獲益。然而,這一療法仍嚴(yán)重依賴尸體供體胰腺,且移植過程復(fù)雜,限制了其廣泛應(yīng)用。
盡管技術(shù)日益成熟,胰島移植仍面臨兩大核心挑戰(zhàn):一是需長期使用全身免疫抑制藥物以防止排斥反應(yīng),這不僅增加感染、腎功能損害及癌癥風(fēng)險,也將適用人群限制于伴有嚴(yán)重并發(fā)癥或需同期器官移植的患者;二是尸體供體來源極度有限,難以滿足臨床需求。
因此,未來研究重點(diǎn)在于開發(fā)替代性的胰島素分泌細(xì)胞來源(如干細(xì)胞技術(shù)),并探索無需長期免疫抑制的保護(hù)策略,以推動該療法走向更廣泛的患者群體。
干細(xì)胞療法:治愈1型糖尿病的新希望與現(xiàn)實(shí)障礙
人類干細(xì)胞為1型糖尿病的細(xì)胞替代療法提供了新的希望。早期臨床試驗顯示,利用胚胎干細(xì)胞(hESCs)和誘導(dǎo)多能干細(xì)胞(hiPSCs)生成的胰島素分泌細(xì)胞能夠在一定程度上改善患者病情,而成體間充質(zhì)干細(xì)胞(hMSCs)也可能為工程化細(xì)胞或免疫保護(hù)提供機(jī)會,以減少免疫排斥。
由于hESCs和hiPSCs幾乎可無限獲取,它們成為理想的細(xì)胞來源,但要獲得具備正常功能的細(xì)胞,必須模擬人類胰腺的胚胎發(fā)育過程,并重現(xiàn)關(guān)鍵轉(zhuǎn)錄因子的作用,如PDX-1和MAfA在胰島分化和胰島素基因激活中的核心地位。
然而,干細(xì)胞分化為成熟β細(xì)胞的過程依然復(fù)雜且耗時長,常常需要數(shù)月,并可能產(chǎn)生非目標(biāo)細(xì)胞譜系。即使分化出的細(xì)胞能表達(dá)胰島素等標(biāo)志物,它們?nèi)詿o法完全重建成熟β細(xì)胞的葡萄糖感應(yīng)系統(tǒng),導(dǎo)致分泌功能不穩(wěn)定。與此同時,受體通常需要接受全身免疫抑制來維持移植物的存活,但這帶來慢性感染和器官損傷等嚴(yán)重風(fēng)險,限制了干細(xì)胞療法的臨床推廣。
為突破這些瓶頸,研究者正在探索通過基因工程改造來賦予干細(xì)胞衍生物“免疫逃逸”能力。方法包括刪除細(xì)胞中的人類白細(xì)胞抗原(HLA)蛋白以降低免疫識別,或增強(qiáng)PD-L1等免疫檢查點(diǎn)分子的活性,以減弱宿主免疫反應(yīng)。這些策略有望在未來減少對全身免疫抑制的依賴,為T1D的干細(xì)胞治療開辟更安全有效的道路。
干細(xì)胞治療1型糖尿病的重大突破與未來挑戰(zhàn)
2024年,Vertex公司公布了一項正在進(jìn)行的I/II期臨床試驗(NCT04786262)的初步結(jié)果。該試驗使用人胚胎干細(xì)胞(hESCs),在體外預(yù)分化為類β細(xì)胞(產(chǎn)品名稱:VX880),用于長期患有T1D并有嚴(yán)重低血糖病史的成年患者。

16名接受VX880移植的患者中,胰島樣細(xì)胞經(jīng)門靜脈輸注移植入肝臟,并在全身藥物性免疫抑制下維持。其中,4名接受足量細(xì)胞劑量的患者在移植數(shù)月后不再出現(xiàn)嚴(yán)重低血糖,并實(shí)現(xiàn)了胰島素獨(dú)立(最新更新:2025年6月,意大利比薩IPITA大會)。
大約9個月的延遲期(從移植到移植物功能的出現(xiàn))被認(rèn)為是ESCs在體內(nèi)繼續(xù)分化并獲得功能成熟所需的時間。在接受足量細(xì)胞移植并配合全身免疫抑制的患者中,多人成功實(shí)現(xiàn)了胰島素獨(dú)立和嚴(yán)重低血糖的消除,證明了該策略的臨床可行性。
其他早期試驗(如CRISPR Therapeutics的NCT05210530)雖然已有初步結(jié)果,但因數(shù)據(jù)過早,目前尚無法評估療效。hESCs雖然帶來一定臨床成功,但仍受限于必須通過病毒轉(zhuǎn)染體細(xì)胞以誘導(dǎo)多能性,這增加了安全風(fēng)險并延長制備時間。
創(chuàng)新突破:中國研究的貢獻(xiàn):為應(yīng)對這些局限,中國的一項研究嘗試使用化學(xué)誘導(dǎo)多能干細(xì)胞(ciPSCs)衍生胰島移植到T1D患者,移植一年后實(shí)現(xiàn)胰島素獨(dú)立。該方法采用化學(xué)分子而非基因操作誘導(dǎo)多能性,同時將細(xì)胞移植至腹直肌鞘下,而非傳統(tǒng)肝臟移植部位,提供了新的移植策略。
ciPSCs的優(yōu)勢還在于來源于成體體細(xì)胞,可避免hESCs涉及的人類胚胎倫理問題。盡管如此,無論是基因工程方法還是化學(xué)誘導(dǎo),小分子方法的分化過程仍然復(fù)雜、漫長且不穩(wěn)定,并可能產(chǎn)生非目標(biāo)細(xì)胞譜系,其潛在致瘤性也無法完全排除。
總體而言,干細(xì)胞移植在T1D治療中展現(xiàn)出巨大潛力,克服這些障礙的基因編輯策略仍處于早期階段,臨床經(jīng)驗僅限于少數(shù)國家。雖然離T1D全面應(yīng)用仍有距離,但在神經(jīng)退行性疾病(如ALS和阿爾茨海默病)領(lǐng)域已有一定探索,積累了寶貴經(jīng)驗,盡管成功證據(jù)仍不充分。這顯示了干細(xì)胞治療在復(fù)雜疾病中的潛力及其面臨的技術(shù)和安全挑戰(zhàn)。
人間充質(zhì)干細(xì)胞能否成為治療1型糖尿病的新助力?
人間充質(zhì)干細(xì)胞雖然難以直接轉(zhuǎn)分化為類β細(xì)胞,即具有胰島素分泌功能的細(xì)胞,但它們具有強(qiáng)大的免疫調(diào)節(jié)能力,這使其在T1D治療中仍然具有潛在價值。由于人間充質(zhì)干細(xì)胞不表達(dá)MHC II類抗原,幾乎不被免疫系統(tǒng)識別,同時能夠抑制T細(xì)胞反應(yīng)、阻礙樹突狀細(xì)胞分化或β細(xì)胞增殖,并促進(jìn)調(diào)節(jié)性T細(xì)胞(Treg)擴(kuò)增,它們在移植環(huán)境中可以降低免疫排斥的風(fēng)險。
此外,臍帶沃頓膠來源的人間充質(zhì)干細(xì)胞還能增強(qiáng)抗炎因子和關(guān)鍵免疫調(diào)節(jié)分子(如HLA-G5)的產(chǎn)生,并與抗凋亡蛋白Bcl-2的上調(diào)相關(guān),從而進(jìn)一步支持移植物存活。基于這些特性,人間充質(zhì)干細(xì)胞可作為干細(xì)胞衍生療法的輔助細(xì)胞,改善移植成活率和功能,即便其自身難以直接替代β細(xì)胞,也能在治療T1D中發(fā)揮重要的輔助作用。
無免疫抑制移植的創(chuàng)新突破
近期的首次人體研究顯示,通過前臂肌肉注射工程化原代胰島細(xì)胞療法(UP421)移植到T1D患者體內(nèi),即使未使用任何免疫抑制,1個月后移植物仍未被排斥,并能持續(xù)產(chǎn)生功能性C肽。這一結(jié)果表明,有可能在不依賴全身免疫抑制的情況下維持移植物功能,為T1D患者提供更安全的治療方案。

最新的更新(2025年6月,比薩IPITA大會)進(jìn)一步顯示,移植6個月后,C肽在基礎(chǔ)及餐后刺激狀態(tài)下均保持穩(wěn)定,影像學(xué)顯示移植物位置穩(wěn)定,無免疫排斥跡象。這一技術(shù)目前也在嘗試應(yīng)用于hiPSC衍生胰島細(xì)胞,為未來免疫逃逸型干細(xì)胞療法提供了有希望的方向。
封裝技術(shù):是細(xì)胞治療的終極保護(hù)方案,還是過渡策略?
封裝技術(shù)旨在通過物理屏障隔離移植細(xì)胞,使其免受宿主免疫系統(tǒng)的攻擊,從而避免使用全身性免疫抑制劑。然而,該策略面臨重大挑戰(zhàn),例如FDA批準(zhǔn)的VX264試驗因封裝細(xì)胞功能不佳而中止,凸顯了技術(shù)可行性問題。此外,盡管水凝膠封裝展示了長期的耐受性,但其固有的局限性——尤其是核心的長期供氧不足以及無法按需取出移植物——嚴(yán)重限制了其臨床轉(zhuǎn)化和應(yīng)用。
為克服微囊的瓶頸,研究重心已轉(zhuǎn)向更易操作但風(fēng)險不同的免疫保護(hù)性宏裝置。當(dāng)前的研究前沿是開發(fā)高性能生物材料(如納米纖維),以期在提供免疫隔離的同時,促進(jìn)血管生成以改善氧氣供應(yīng)。更進(jìn)一步,結(jié)合去細(xì)胞化器官基質(zhì)和3D生物打印技術(shù)來構(gòu)建“生物雜交器官”,正為T1D的細(xì)胞治療開辟出一條充滿潛力的新途徑,目標(biāo)是最終實(shí)現(xiàn)功能完整、長期存活且安全的細(xì)胞替代療法。
細(xì)胞療法普及之路:為何生產(chǎn)困難與移植部位同等重要?
盡管已有成熟方案指導(dǎo)如何從hESC或hiPSC中獲取胰島素分泌細(xì)胞,但其實(shí)際生產(chǎn)仍面臨巨大技術(shù)壁壘和高昂成本。這些細(xì)胞不僅脆弱、對環(huán)境敏感,其分化過程的日常監(jiān)測和維持依賴昂貴試劑,加之必需的復(fù)雜基因編輯操作,使得能穩(wěn)定生產(chǎn)功能齊全細(xì)胞產(chǎn)品的實(shí)驗室寥寥無幾,極大地限制了該技術(shù)的推廣和應(yīng)用范圍。
相比之下,hMSC因其易于從多種成體組織(如脂肪、臍帶)中獲取、擴(kuò)增簡便且成本低廉,展現(xiàn)出更好的經(jīng)濟(jì)性和可及性優(yōu)勢。
移植部位的選擇是決定療法成敗的另一關(guān)鍵因素,它直接影響細(xì)胞的存活(氧氣/營養(yǎng)供應(yīng))和功能(胰島素擴(kuò)散效率)。
對于免疫原性已通過編輯技術(shù)降低的細(xì)胞,傳統(tǒng)門靜脈肝內(nèi)移植或肌肉移植仍是可行選項;而對于需要物理免疫隔離的細(xì)胞(如微囊化或宏裝置封裝產(chǎn)品),則必須將其植入皮下或網(wǎng)膜等特定部位,這些位置不僅需便于植入和取出,更要能促進(jìn)血管化以保證細(xì)胞長期存活和功能發(fā)揮。
綜合治療策略:未來發(fā)展方向
治愈1型糖尿病的核心在于用健康活力的細(xì)胞替代被破壞的β細(xì)胞,從而恢復(fù)接近生理狀態(tài)的內(nèi)源性胰島素分泌模式(圖1)。尸體供體胰島雖然能夠逆轉(zhuǎn)T1D,但因器官捐獻(xiàn)稀缺性而難以廣泛應(yīng)用。
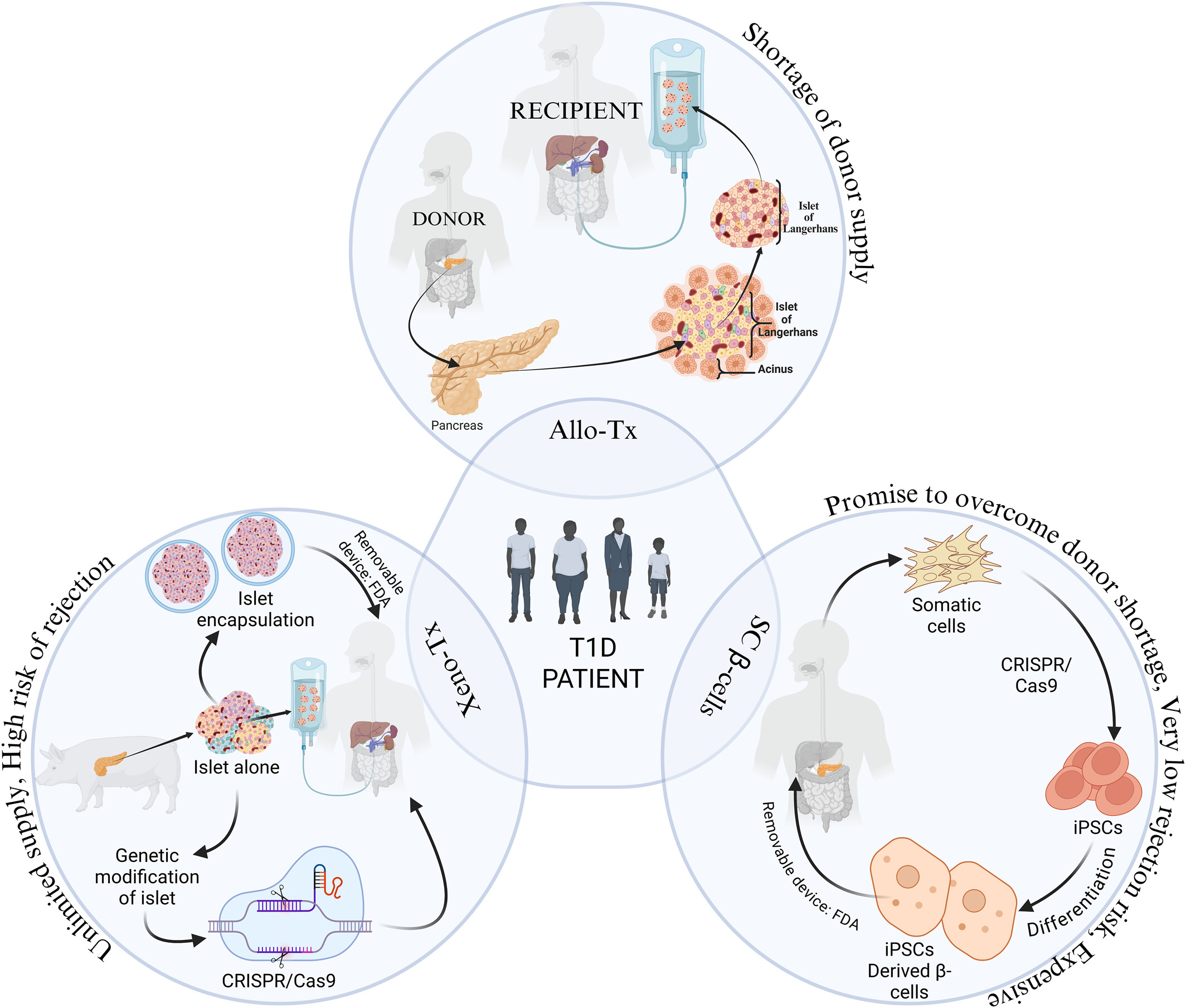
由于T1D起始于自身免疫性β細(xì)胞破壞,對抗自身免疫是首要任務(wù)。Car-Treg細(xì)胞、hMSCs或其他研發(fā)中的免疫調(diào)節(jié)方法可在疾病早期防止β細(xì)胞持續(xù)損傷;在疾病晚期,將免疫調(diào)控手段與hESCs或hiPSCs衍生胰島素生產(chǎn)細(xì)胞移植結(jié)合,有望在無需全身免疫抑制的情況下逆轉(zhuǎn)高血糖(表1)。

通過”混合”策略整合穩(wěn)定干細(xì)胞移植物與免疫調(diào)節(jié)技術(shù),或能為T1D提供可行的治愈途徑。
參考資料:
[1]:https://onlinelibrary.wiley.com/doi/10.1002/dmrr.70079
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。




 掃碼添加微信
掃碼添加微信