缺血性冠狀動脈疾病是導致死亡的主要原因之一,冠狀動脈疾病常惡化為心肌梗死(也稱心梗),冠狀動脈閉塞會導致局部缺血,造成肌性心肌廣泛壞死、不良心室重塑和纖維化瘢痕形成。
目前再灌注治療(包括介入、溶栓和搭橋)是心梗標準療法,雖可快速恢復冠脈血流,但無法促進受損組織再生,心梗后數年內的并發癥仍是主要死因,亟需能夠實現心臟功能完全恢復的新型療法。
近年來,干細胞療法的快速發展為多種難治性疾病開辟了潛在治療途徑,它能分化為心肌細胞,并可誘導旁分泌信號通路、血管生成和免疫調節,還能提高左心室射血分數(LVEF) 并減少梗死區域瘢痕組織增生。
2025年5月,國外學者在《Biomedicines》(生物醫學)期刊發表一篇關于干細胞治療心梗的最新綜述研究,該綜述從5大方面闡述了干細胞療法在心梗修復中的治療潛力,并梳理該領域最新進展以及未來發展方向。
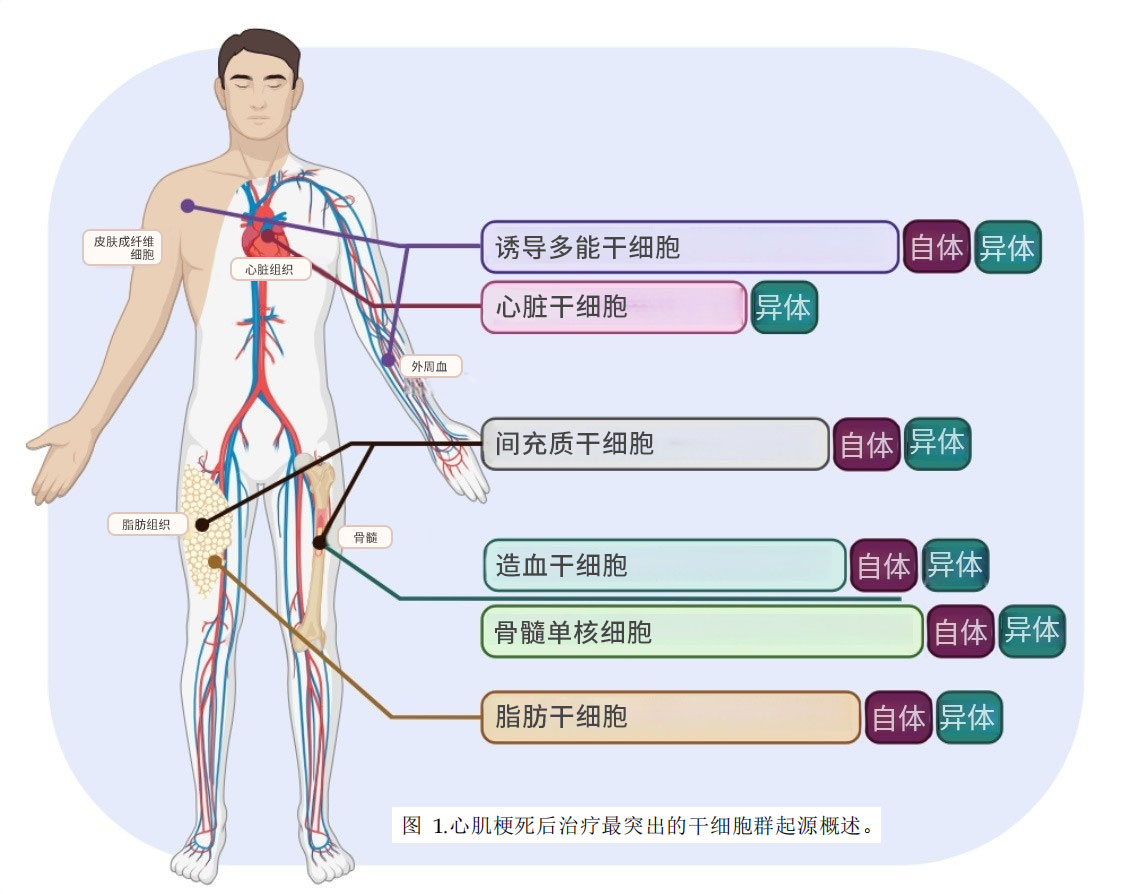
接下來介紹一下目前與心臟修復相關的常見干細胞/祖細胞,圖1簡要概述了文獻中用于心臟修復不同干細胞類型的常見來源。
一、目前心梗研究常用干細胞類型
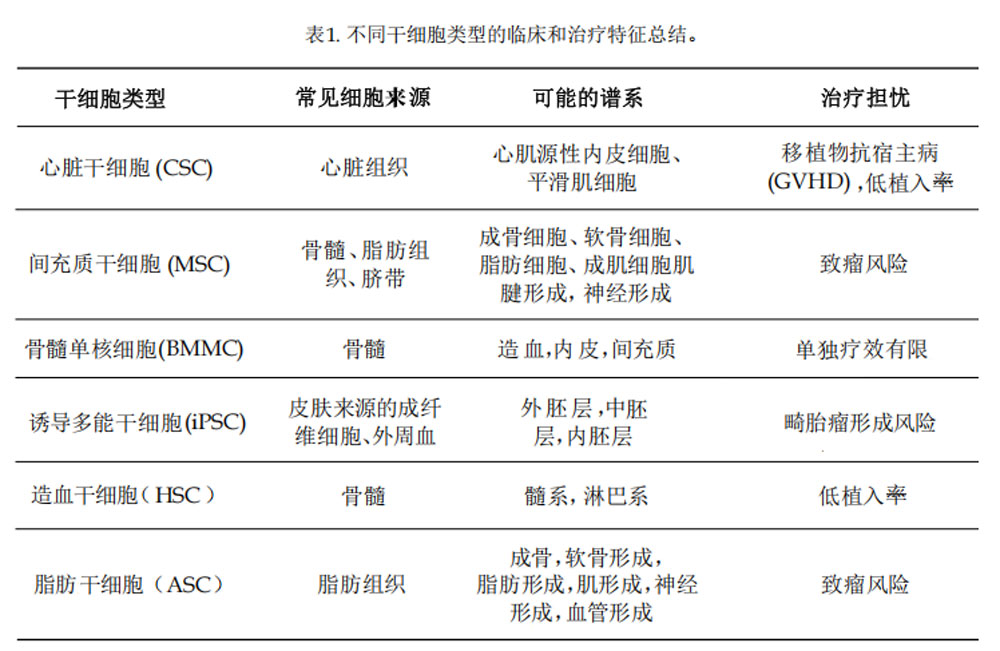
1.心臟干細胞(CSC)
CSC是心臟內多能前體細胞(其分布稀疏且增殖緩慢?),可分化為心肌細胞、內皮細胞或平滑肌細胞,它在胚胎發育過程中指導心臟發生,并在一定程度上參與心臟修復。由于心臟環境的抗增殖特性,成人組織中CSC自然修復能力有限。
CSC在體內數量較少,可通過體外擴增達到移植需求,但由于分離制備限制,需依賴同種異體來源,如心臟移植殘留心房組織或切碎的供體心臟,雖然移植后增加了GVHD風險,但多數研究表明CSC移植后未顯著增加重大心血管不良事件(MACE)發生率。
2.間充質干細胞(MSC)
MSC是迄今為止研究最深入的干細胞之一,它是一種多能性基質干細胞,可從多種組織中分離,包括骨髓、脂肪組織和臍帶組織,還具有分化成多種細胞譜系的能力,包括軟骨細胞、心肌細胞,甚至神經元。
MSC在心肌修復中的優勢可能更多地在于其旁分泌信號傳導能力和/或募集內源性干細胞進行修復能力,而不是直接向心肌細胞分化。這一機制規避了細胞移植存活率低的問題,還能通過多靶點調控實現更高效修復。
鑒于MSC在體內普遍存在且在體外可持久存在,自體和同種異體MSC均已被廣泛用于心梗臨床研究,且療效相似,無論是同種異體MSC其在心梗后恢復中的作用均顯示出良好的安全性結果。
3.骨髓單核細胞(BMMC)
從技術上講,BMMC不是同質干細胞群,而是在骨髓中發現的祖細胞/多能干細胞群,包括造血干細胞(HSCs)、內皮祖細胞(EPCs)和MSCs等。盡管它是由不同祖細胞組成的混合體,但它也是臨床應用最多的細胞類型之一。
由于其細胞組成多樣,BMMC表現出廣泛分化潛力,它們能夠分化為構成細胞所能提供的所有譜系。除此之外,由于不需要大量體外培養,它們具有較快周轉時間,為自體急性心梗治療提供了罕見的可能性。
多數研究顯示,BMMC治療對心梗后心功能改善有限,可能由于其成分被非相關的祖細胞“稀釋”。但因MACE和其它風險因素較低,BMMC療法仍是心梗有前景候選者,因為其與同質干細胞群(如MSC)或與冠狀動脈旁路移植(CABG)聯用可產生協同修復作用。
4.誘導性多能干細胞(iPSC)
iPSC是通過基因重編程將成體細胞(如皮膚成纖維細胞或外周血細胞)逆轉為多能狀態的干細胞,具有類似胚胎干細胞(ESC)的全能分化潛力。其多能性和低供體變異性使其在自體/異體治療中極具應用前景。
iPSC的多能性優勢也帶來了巨大挑戰,尤其是移植后形成畸胎瘤的風險。因此,有人提出在移植前將iPSC作為CSC或MSC分化起始群體,以最大限度地提高效益并最大限度地降低風險。
在心梗后心臟修復背景下,iPSC顯示出獨特優勢:Yang等人通過2D/3D培養證實其可分化為心肌細胞,并分泌促血管生成因子。若能控制腫瘤風險,iPSC或將成為最具潛力的同質干細胞療法。
5.造血干細胞(HSC)
HSC是一種主要來源于骨髓和外周血的干細胞,在所有血系中均表現出多能性,可從同種異體和自體來源獲取,每年的治療性移植大致在這兩種來源之間分配(分別為47%和53%)。
HSC雖不能直接分化為心肌細胞,但臨床前研究顯示其旁分泌效應顯著。Shalaby團隊在小鼠心梗模型中發現,HSC治療可減少膠原沉積、改善心臟結構(比MSC能更有效縮小梗死面積),并上調關鍵修復因子。
6.脂肪干細胞(ASC)
ASC是從脂肪組織中獲得的一種MSC亞群。與其它MSC一樣,具有多能性,能夠分化為多種細胞類型,包括成骨、成軟骨和成脂肪譜系。它與骨髓來源的MSC也有許多功能相似之處,但其在脂肪組織中更易于獲取且數量較多。
ASC雖與其它MSC具有相似的再生和旁分泌功能,但其獨特的免疫調節特性使其成為治療多種病癥的潛在候選者。多項心梗動物模型研究顯示,ASC治療潛力至少與其它來源的MSC相當。
二、干細胞在心梗恢復中的作用
1.修復和血管生成
干細胞療法通過分化為血管相關細胞促進心臟血管生成,該機制對缺血組織修復尤為關鍵,新生血管能增強冠脈循環效率,由心梗觸發后可減少心肌細胞死亡并抑制瘢痕形成,是改善血流的核心病理修復過程。
2.細胞外和旁分泌信號轉導
植入體內的干細胞主要通過旁分泌信號傳導等機制(釋放趨化因子/生長因子)發揮心臟再生作用,而非直接分化為心肌細胞。這些因子通過調控炎癥、促進血管新生、募集內源干細胞及重啟心肌細胞周期實現協同修復作用。
3.細胞外囊泡(EV)
EV通過運輸蛋白/核酸等生物分子介導心臟再生和修復,其中外泌體最具潛力,因為它們源自多種干細胞且致瘤風險極低,還能促進心肌細胞增殖、血管生成、抗炎反應,并通過基因調節減少梗死面積和細胞凋亡,顯著改善心臟功能。
三、給藥方法和時間
干細胞給藥方式的選擇需綜合考慮手術類型(開胸/導管)、冠脈狹窄程度及心肌梗死時間(急性期<7天/亞急性7-14天/慢性期>14天)。由于每個階段心肌都會發生復雜變化,因此給藥時機也是一個重要因素。
1.直接心肌內注射
直接心肌內注射涉及針對心肌特定梗死區域,這些區域通過核成像和/或心臟超聲心動圖識別。在開胸開胸手術中,例如冠狀動脈搭橋術或作為獨立手術,包括側部小切口開胸術,將干細胞直接注射到梗死區域。
直接心肌注射雖能實現高細胞保留率(無需歸巢過程),但作為開胸手術具有顯著侵入性,可能導致心律失常、心肌穿孔等并發癥。局限性在于僅能靶向特定心肌區域、恢復期長、不可重復操作,且存在細胞從注射位點流失風險。
2.靜脈輸液
靜脈輸注主要用于急性心梗,因為成功率很大程度上取決于瀕死心肌釋放的信號分子,這種方法很有吸引力,因為與其它方法相比,侵入性小且易于管理。它在涉及多個梗死區域的病例中也特別有用,因為干細胞會遷移到心臟的任何梗死區域。
其局限性在于輸注的干細胞容易滯留在肺部,導致輸送效率低、心肌保留率低,這會降低治療效果。與直接心肌注射相比,左心室射血分數的改善也較小。
3.冠狀動脈內輸液
冠狀動脈內輸注通過球囊導管經股動脈靶向遞送干細胞,可采用停流(球囊阻斷減少體循環流失)或持續血流兩種注射模式。該技術能顯著改善左心室功能、抑制心室重塑、縮小梗死面積,并提升患者生活質量與臨床預后。
冠狀動脈內輸注較靜脈輸注能精準遞送干細胞至病灶,提升心肌細胞保留率,且可結合常規心導管檢查同步完成。但存在冠脈損傷、微栓塞風險,限制細胞劑量/大小,對低灌注區遞送困難。缺氧環境影響存活率,且細胞可能經心肌二次轉移至肺循環。
4.使用導管進行心肌內給藥
①?心內膜注射?:通過機電映射精準靶向梗死交界區,可顯著改善左心室射血分數并縮小梗死面積,細胞保留率高且并發癥少,但需特殊設備并存在穿孔和心律失常風險。
②冠狀靜脈注射?:經皮微創操作,利用血管內超聲實現細胞均勻分布,可規避開放性手術風險,但受靜脈解剖變異影響定位精度,仍存在心律失常風險和肺部再分布等風險。
③?逆行冠狀靜脈系統?:經股靜脈-冠狀竇路徑隔離注射,適用于冠狀動脈阻塞患者,栓塞風險低于冠狀動脈內注射,但靜脈迂曲增加操作難度,冠狀竇損傷風險需警惕。
四、臨床和臨床前試驗總結
通過分析各種治療心梗的干細胞療法臨床和臨床前研究后,發現MSC和自體心臟球體衍生細胞(CDC)顯示出更好的應用前景。
一項多中心對照試驗經皮冠狀動脈介入治療后冠狀動脈內輸注MSC,注射后4個月內LVEF增加了8.8%,而對照組則僅增加了4.8%。還發現多劑量MSC輸注使LVEF功能改善了7.45%,而單劑量僅改善了4.54%。

另一項隨機對照試驗中,經冠狀動脈內輸注CDC,在一年隨訪中顯著減少了瘢痕大小(?11.1%),并增加了存活心肌(22.6%)。與單純進行CABG相比,增強左心房功能。總體而言,干細胞注射未出現重大安全問題或不良事件。
五、細胞存活和保留限制
研究發現,只有極少數(大約1%或更少)干細胞在移植后能夠長期存活,缺血、炎癥和心肌的機械性沖洗是導致細胞顯著損失的主要因素。此外,冠狀內或靜脈輸注也會受到快速沖洗的影響,這限制了有效的細胞植入。
為提高急性期細胞保留率,新型遞送策略(心肌內注射/可注射水凝膠/心外膜貼片)通過構建仿生細胞外基質,使細胞保留率較生理鹽水提升8-59倍。鑒于細胞存活率瓶頸,醫學界推薦采用干細胞外泌體作為替代方案,其既能攜帶修復信號又可規避細胞存活難題。
未來發展方向
目前已有學者嘗試將基因編輯與干細胞和生物打印技術融合進行相關試驗。未來隨著學者們的不斷探索,開發出一種特定的心臟貼片,將為心臟再生開辟一條新的治療途徑。目前研究重點是促進工程化組織的成熟度,確保其與宿主心肌的機械和電氣融合,并建立穩健的血管網絡,以支持植入后組織活力。
總 結:上述分析結果表明,干細胞療法通過多種機制展現出良好治療潛力,臨床數據顯示,心肌內注射MSC可安全改善左心室功能,冠脈內CDC能降低LVEDV/LVESV等指標,冠狀動脈搭橋術聯合BM-MNC可增強心房功能。
雖然干細胞療法展現了治療優勢,但還存在三大瓶頸:①細胞保留率低,②未能顯著改善無事件生存期/疤痕縮小等硬指標,③潛在致瘤及免疫等風險。為了實現一致和持久的臨床益處,有必要進一步優化細胞來源、遞送方法。
參考資料:
Le, N.T.; Dunleavy, M.W.;Zhou, W.; Bhatia, S.S.; Kumar, R.D.;Woo, S.T.; Ramirez-Pulido, G.;Ramakrishnan, K.S.; El-Hashash, A.H.Stem Cell Therapy for MyocardialInfarction Recovery: Advances,Challenges, and Future Directions.Biomedicines 2025, 13, 1209.https://doi.org/10.3390/biomedicines13051209.






 掃碼添加微信
掃碼添加微信