CORESTEM于2015年在韓國推出了世界上第一個針對肌萎縮側索硬化癥的干細胞療法。該公司目前正在尋求授權合作伙伴,以爭取在美國和歐洲獲得產品批準。
CORESTEM是一家生物科技公司,專門從事神經和自身免疫性疾病個性化干細胞療法的研發。其主導產品是NeuroNata-R (lenzumestrocel),這是世界上第一個基于干細胞的肌萎縮側索硬化癥 (ALS) 療法。
NeuroNata-R于2014年被韓國食品藥品安全部 (MFDS??) 批準為治療ALS的罕見藥。 CORESTEM一直在這方面鋪平道路,我們采取的道路被MFDS采用為監管指南,”CORESTEM首席執行官KyungSuk Kim說。
ALS,也稱為Lou Gehrig病或運動神經元病,是一種進行性神經退行性疾病,由于運動神經元死亡導致肌肉萎縮。平均預期壽命為發病后三到五年。在韓國以外唯一獲得批準的ALS治療藥物是小分子藥物利魯唑和依達拉奉。
NeuroNata-R基于自體骨髓間充質干細胞 (MSC)。治療包括從患者身上提取骨髓,分離和培養間充質干細胞,與從患者身上收集的腦脊髓液混合,并通過鞘內注射給藥最終產品。第一次NeuroNata-R注射通常在第一次骨髓提取后4周進行,然后在4周后進行第二次注射。
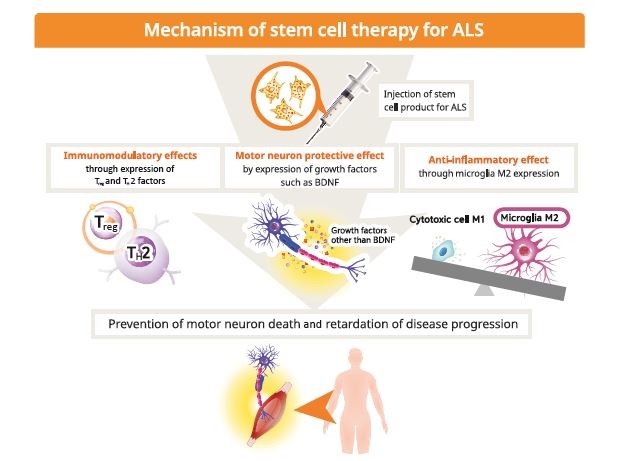
使用NeuroNata-R進行治療可產生多種效果,可防止運動神經元死亡并減緩ALS的進展(圖1)。這些包括免疫調節因子的釋放,例如調節性T淋巴細胞和T輔助因子2;通過表達生長因子,如腦源性神經營養因子,產生運動神經元保護作用;以及由于小膠質細胞從M1表型轉變為M2表型而產生的抗炎作用。
安全性和有效性數據
來自臨床研究的數據表明,根據ALS功能評定量表修訂版 (ALSFRS-R) 2、3的變化測量,NeuroNata-R減緩了ALS的進展。
一項1期開放標簽研究證明了在7名ALS患者中進行兩次重復鞘內注射自體骨髓間充質干細胞超過12個月的安全性和可行性。隨后進行了兩次重復鞘內注射的2期、平行組、隨機對照試驗,證明了在至少六個月內減緩ALS進展的安全性和有效性。與對照組(n=27)相比,NeuroNata-R組(n=32)四個月時 ALSFRS-R 評分相對于基線的平均變化顯著降低(組差2.98;95% CI 1.48–4.47,P<0.001) 和六個月 (3.38; 95% CI 1.23–5.54,?P=0.003)?。
根據1期和2期數據,NeuroNata-R于2014年7月在韓國獲批,并于2015年2月上市。截至2019年3月,韓國已有371名患者接受了NeuroNata-R(自商業化以來為256名患者),其中49外國患者。
CORESTEM現在正準備進行一項創新的隨機、雙盲、安慰劑對照、多中心第3期研究,以評估NeuroNata-R 在超過94名ALS患者中的安全性和有效性。患者將被隨機分配接受兩劑研究藥物或安慰劑(不含干細胞的腦脊液)。將開發冷凍保存程序,以便ALS患者不必進行重復的骨髓提取程序。
主要結果將是ALSFRS-R從基線到24周的變化。次要結果將包括其他功能和生活質量指標。符合條件的患者可以參加一項將持續到第48周的補充研究,并將在首次NeuroNata-R給藥之日起36個月的觀察期內評估長期療效和安全性。
合作機會
CORESTEM自2003年在韓國成立以來,一直引領創新干細胞技術的發展。該公司于2015年重組,以將其首個商業化產品推向當地市場,并設計進入全球市場的戰略。
NeuroNata-R于2018年從美國食品和藥物管理局 (FDA) 獲得了治療ALS的罕見藥物指定,并于2019年初獲得了歐洲藥品管理局的指定。CORESTEM現在正在準備與FDA在2019年第二季度。
隨著CORESTEM致力于在美國和歐洲批準NeuroNata-R,它正在尋找對外許可的機會。“我們正在尋找與我們一樣相信干細胞治療潛力的合作伙伴,他們可能正在考慮在他們的管道中添加干細胞療法和/或基因療法,”Kim說。
除了NeuroNata-R之外,CORESTEM還在推進針對狼瘡性腎炎和多系統萎縮(均為第一階段)的干細胞療法的臨床開發以及一系列臨床前候選藥物。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信