近日,MDPI子期刊《藥品》發表了一篇目前有多少間充質干細胞療法獲得世界各地監管機構的批準的文章,文章概述了,截至2023年4月,全球已有1120項注冊臨床試驗使用間充質干細胞療法,但只有12種MSC療法獲得監管機構批準商業化。間充質干細胞批準的12種產品中有9種來自亞洲,其中韓國是批準療法最多的國家。未來,間充質干細胞將在多種疾病的治療中發揮重要作用。
盤點:獲得世界各地監管機構批準的間充質干細胞療法有哪些?
在歐洲,新興的新基因和細胞療法導致制定了監管這些通常稱為先進治療藥品(ATMP)的產品的法律。ATMP分為四種類型:
- 細胞治療藥品 (CTMP)。這些細胞或組織含有經過處理的細胞或組織,與捐贈者體內的細胞或組織相比,這些細胞或組織旨在用于受體的不同基本功能。
- 組織工程產品(TEP)。可以再生、修復或替換人體組織的工程細胞或組織。
- 基因治療藥品(GTMP)。與使用特定重組核酸的診斷、治療或預防效果相關。
- 組合ATMP (cATMP)。它們集成了上面列出的兩個或多個產品。
世界各地的每個監管機構都有自己的產品分類,它們之間的差異很小。世界各地的一些監管機構包括中國國家藥品監督管理局藥品審評中心(CDE)、歐洲藥品管理局 (EMA)、美國 (USA) 食品藥品管理局 (FDA)、韓國食品藥品安全部 (MFDS)、印度藥品監管總局 (DCGI)、澳大利亞治療用品管理局 (TGA) 和日本藥品和醫療器械管理局 (PMDA)。
提到之前的監管機構是因為他們是迄今為止唯一可以批準使用其最初命名的間充質干細胞(通常稱為 MSC)的CTMP療法的機構;這些機構試圖將其名稱更改為醫學信號細胞,最近更名為間充質祖細胞。為了方便起見,從這里開始將使用術語MSC。
回到基礎知識,干細胞一般根據其分化能力進行分類,包括全能、多能、專能和單能特性。
- 全能干細胞具有通過分裂自我更新并分化成生物體中發現的任何類型細胞的潛力,受精卵細胞就是這種情況。
- 多能干細胞具有通過分裂進行自我更新的潛力,并產生中胚層、內胚層和外胚層中的所有細胞,但不能產生胎盤等胚胎外組織。然后,先前的細胞在體內產生不同類型的特化細胞變得多能。多能干細胞可以產生僅限于起源生發層的多種細胞,間充質干細胞就是這種情況,具有分化成肌肉、骨骼和軟骨組織均源自中胚層。
- 最后,單能干細胞只能產生一種細胞譜系,例如,肌肉或皮膚的細胞只能分別產生肌肉或皮膚細胞。
對它們進行分類的另一種方法是根據可以提取它們的發育階段,例如胚胎干細胞、胎兒干細胞、嬰兒干細胞或成人干細胞。
- 胚胎干細胞源自囊胚的內部細胞;這些是高度未分化和高度增殖的并且可以包含全能和多能干細胞。
- 胎兒干細胞,顧名思義包括間充質干細胞,可以從胎兒組織中分離,例如血液、骨髓(BM)、肝臟和腎臟。
- 嬰兒MSC包括從臍帶血、羊膜或胎盤中提取的MSC。
最后,成體間充質干細胞包括從脂肪組織、骨髓、外周血和牙髓中分離的間充質干細胞(圖1)。

它們在適當的體外刺激下可以自我更新并分化成各種組織,包括骨、軟骨、肌肉、骨髓基質、肌腱/韌帶、脂肪和真皮。另一方面,未在體外分化的間充質干細胞正在測試用于治療結締組織疾病、急性心肌梗塞、肌萎縮側索硬化癥、脊髓損傷、骨關節炎、眼部燒傷和移植物抗宿主病。
間充質干細胞
如上所述,醫學信號細胞和間充質祖細胞這兩個術語已開始被該領域的專家用來取代以前的名稱來指代MSC。盡管如此,我們將使用后者以避免混淆。間充質干細胞來源于胚胎中胚層細胞,具有自我更新能力,在適當的刺激下,可以在體外分化成多種組織,包括骨、軟骨、肌肉、骨髓間質、肌腱/韌帶、脂肪和真皮。
另一方面,體內(或生理上,指體內發生的情況)的間充質干細胞起源于血管周圍細胞,不會分化成其他細胞類型來修復受損組織,而是從受損的血管中分離出來。組織通過其免疫調節分泌物和營養生物活性因子產生再生微環境,誘導其他細胞(來自受損組織的干細胞)再生組織。正是由于這一特性,有人建議將它們重新命名為藥物信號細胞。
間充質干細胞的臨床應用
我們進行了截至2020年6月的系統審查;研究結果包括在ClinicalTrials.gov上注冊的903項使用間充質干細胞作為治療方法的臨床試驗,這些試驗擁有有關其目標和當前階段的完整信息。注冊臨床試驗數量最多的醫學專業是骨科、呼吸科、神經病學、心臟病學和免疫學(從高到低)。就這些臨床試驗的階段而言,278項處于1期,551項處于2期,68項處于3期,其余6項處于4期。盡管有許多注冊研究,但其中只有18項發表了結果。
相關閱讀:
機構批準的間充質干細胞療法
大多數治療方法通常在第3階段后獲得監管機構的批準,使其在商業上可繼續進行第4階段。到2023年9月,即我們的系統審查三年后,注冊臨床試驗的數量已從903項增加到1236項臨床試驗。
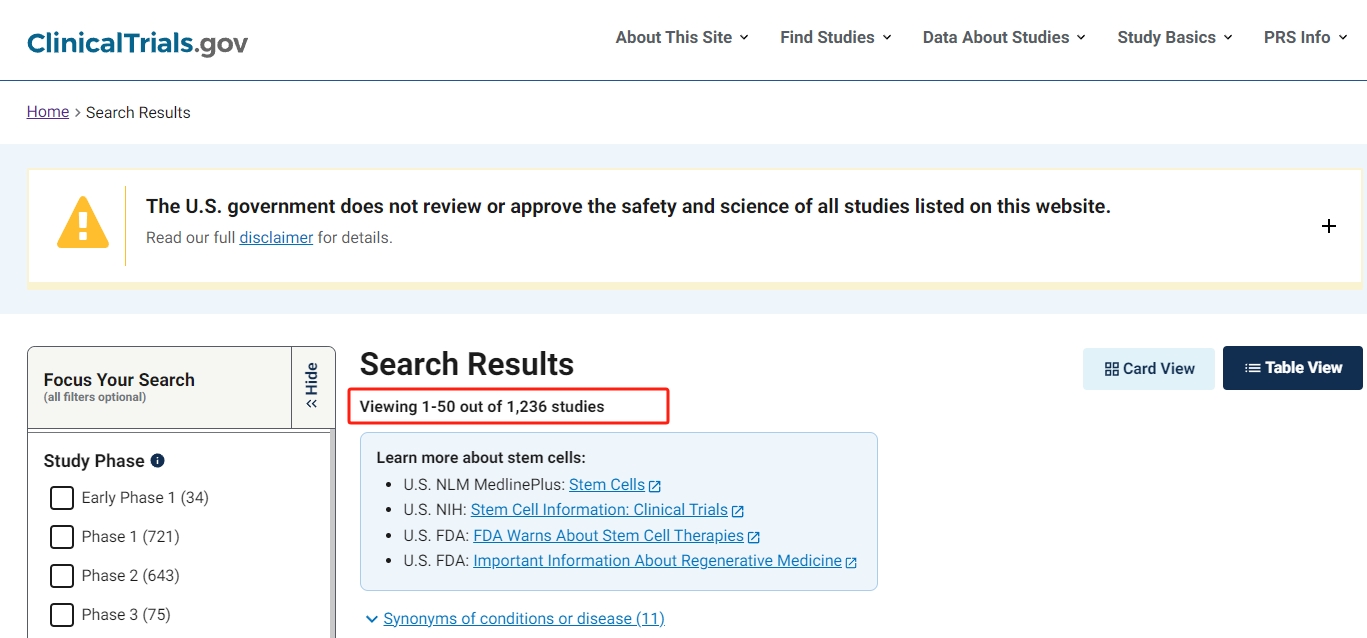
然而,全球監管機構批準的產品數量卻保持不變,只有12種(表1)。
| 姓名/年份 | 公司 | 起源 | 使用 | 描述 | 劑量 | 同種異體/自體 | 收費 |
|---|---|---|---|---|---|---|---|
| 皇后細胞/2010 [ 1 , 27 ] | Anterogen(韓國) | 韓國 MFDS | 結締組織疾病 | AT-MSC和其他細胞類型的異質混合物 | 1×10?細胞/mL | 自體 | 不適用 |
| Cellgram AMI/2011 [ 1 , 28 ] | Pharmicell(韓國) | 韓國 MFDS | 急性心肌梗死 | 人骨髓間充質干細胞 | A:60kg以下=10 mL/5.0×10?BM-MSC b:61–80kg=14mL/7.0×10? BM-MSC c:80kg=18 mL/9×10?BM-MSC | 自體 | 每次治療 15,000美元 |
| Cupistem/2012 [ 1 , 27 , 38 ] | Anterogen(韓國) | 韓國 MFDS | 克羅恩病瘺管 | 人類脂肪組織來源的間充質干細胞 | 瘺管直徑: (a) ≤1cm(1mL中3×10?MSC) (b) 1<X<2cm(2mL中6×10?MSC) | 自體 | 每次治療 5000美元 |
| 卡特斯蒂姆/2012 [ 1 , 29 ] | Medipost(韓國) | 韓國 MFDS | 膝關節骨關節炎(ICRS IV級) | 人臍帶血來源的間充質干細胞 | 7.5×10?細胞/瓶(取決于病變大小) | 異體 | 每次治療 21,000 美元 |
| NeuroNataR/2014 [ 1 , 30 , 39 ] | Corestem(韓國) | 韓國 MFDS | 肌萎縮側索硬化癥 | 人骨髓間充質干細胞 | 1×10?BM-MSCs/kg每4周兩次 | 自體 | 每年 55,000美元 |
| Holoclar/2015 [ 35 , 40 ] | 基耶西農場藥廠 | EMA | 眼部燒傷導致角膜緣干細胞缺乏 | 角膜緣干細胞 | 79,000–316,000個細胞/cm2 | 自體 | 每只治療80,000美元 |
| Reme-stemcel-L/2015 [ 1 , 5 , 8 ] | Mesoblast 有限公司(澳大利亞) | 美國FDA | 兒科患者的急性和難治性 GvHD | 人骨髓間充質干細胞 | IV給藥: 低(200萬個細胞/kg) 高(800萬個細胞/kg) | 自體 | 每次治療 200,000 美元 |
| Temcell HS/2015 [ 1 , 31 , 41 ] | JCR制藥(日本) | 日本PMDA | 急性和難治性GvHD | 人骨髓間充質干細胞 | 靜脈輸注200萬個細胞/kg(每袋含18mL生理鹽水7200萬個細胞);每分鐘4毫升,每周兩次,間隔3天或更長時間,持續4周 | 自體 | 每件治療7600 美元 |
| 干細胞/2016 [1 , 33] | Stem-peutics Research 班加羅爾(印度) | 印度 DCGI | 嚴重肢體缺血 | 人骨髓間充質干細胞 | 肌肉注射1或200萬個細胞/公斤體重 | 自體 | 每次治療 2200美元 |
| 阿洛菲塞爾/2018 [ 1 , 36 , 42 ] | TiGenix(美國)和 Takeda(英國) | EMA | CD 中的復雜性肛周瘺 | 人類脂肪組織來源的間充質干細胞 | 小瓶:3000萬個MSC/6mL 治療:4瓶 | 自體 | 每次治療 47,485美元 |
| Mesestro-Cell/2018 [ 1 , 34 ] | Cell Tech Pharmed(伊朗) | 伊朗FDA | 骨關節炎 | 骨髓間充質干細胞 | 至少關節內注射2×10?細胞/膝;兩個膝蓋總共有4×10?個單元 | 異體 | 不適用 |
| 斯特米拉克/2018 [ 32 , 43 ] | 尼普羅公司 | 日本PMDA | 脊髓損傷 | 骨髓間充質干細胞 | 50至2億個細胞 | 異體 | 135,000 美元 |
2010年,第一個含有間充質干細胞的產品獲得韓國食品藥品監督管理局(MFDS)或韓國食品藥品管理局(KFDA)的批準。該產品名為Queencell,由Anterogen生產。Queencell由基質血管成分 (SVF) 組成,它是收集多余脂肪組織的副產品。SVF包含AT-MSC和其他細胞類型的異質混合物,例如前脂肪細胞、內皮祖細胞、肥大細胞和成纖維細胞;它被批準用于治療皮下組織缺陷。
十二種獲批的間充質干細胞產品中有九種來自亞洲。該地區獲得批準產品最多的國家是韓國,有五個。除了Cellgram-AMI、Cupistem、Cartistem和Neuronata-R之外,還包括之前提到的Queencell。
Cellgram-AMI是一種在胸痛后72小時內通過冠狀動脈成形術再灌注的急性心肌梗死(AMI)患者改善左心室射血分數的方法。Cupistem表明,82%的復雜克羅恩瘺患者在治療后八周內實現完全愈合,其中81%的患者持續到第96周仍保持陽性反應。
Cartistem用于治療與骨關節炎IV級(分類中最嚴重的階段,沒有可見軟骨殘留)相關的膝關節軟骨缺損,由國際軟骨修復協會 (ICRS) 推薦。
最后,NeuroNata-R具有神經保護作用,由于其抗炎和免疫調節作用,可以通過延長運動神經細胞的存活來緩解肌萎縮側索硬化癥 (ALS) 的進展。
剩下的四種產品中,兩種來自日本,一種來自印度,另一種來自伊朗。
日本的產品有Temcell HS和Stemiral。
- Temcell HS是一種經批準的治療方法,用于治療因血液系統惡性腫瘤而接受骨髓移植的兒童和成人患者的急性和難治性移植物抗宿主病 (GVHD)。
- Stemirac是第一個被批準用于脊髓損傷的干細胞治療方法。
在印度,Stempeucel被批準用于治療由布爾格病和外周動脈疾病引起的嚴重肢體缺血(CLI)。
最后,在伊朗,Mesestrocell被用作骨關節炎的治療方法。
在歐洲,迄今為止EMA僅批準了兩種MSC療法。
- Holoclar用于眼部替換成人角膜上皮中受損的細胞,以治療燒傷引起的中度至重度角膜緣干細胞缺乏癥。
- Alofisel被批準用于治療成年克羅恩病患者的復雜性肛瘺。
最后,在進行MSC臨床試驗最多的國家美國,迄今為止唯一批準的MSC療法是Remestemcel-L,這是一種同種異體細胞產品,用于治療兒科患者的類固醇難治性急性GVHD。
當前的問題和未來的方向
間充質干細胞將在治療許多目前尚無有效療法或治愈方法的疾病和病癥方面發揮重要作用。雖然從理論上講,將間充質干細胞從工作臺轉移到床邊是可能的,但據報道,在一些臨床試驗中出現了質量控制嚴重失誤和許多不一致的情況(關于免疫相容性、穩定性、異質性、分化和遷移能力)。此外,這些療法在適用性方面面臨的另一個相當大的經濟問題是,大多數保險公司認為間充質干細胞療法是實驗性的,因此不承擔其費用。
除上述問題外,這些產品面臨的最大障礙是如何被監管機構接受,尤其是美國食品及藥物管理局,因為該機構接受的此類產品最少。美國食品和藥物管理局的部分審批要求是在過去50年中通過與制藥公司的合作而制定的,這一標準非常適合小分子藥物,但在我們現階段的技術能力中并不適合基于細胞的療法。
總之,利用間充質干細胞進行治療并釋放其所有有益潛能還有很長的路要走,因為任何一種新興療法都需要相關領域的多方努力,包括基礎和臨床研究人員、營銷公司、監管機構,甚至政府和國際機構,以解決其發展過程中出現的問題。大部分科學界人士和公眾都對這些療法所取得的成果和未來在治療各種疾病方面的應用前景充滿熱情。
參考資料:Fernández-Garza, L.E.; Barrera-Barrera, S.A.; Barrera-Salda?a, H.A. Mesenchymal Stem Cell Therapies Approved by Regulatory Agencies around the World. Pharmaceuticals 2023, 16, 1334. https://doi.org/10.3390/ph16091334
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信