阿爾茨海默病 (AD) 是一種進行性衰弱性神經退行性疾病,是老年人群中最常見的癡呆癥。目前,AD尚無明確有效的治療方法。因此,研究人員現在正在尋找干細胞療法作為AD的一種可能治療方法,但干細胞對人體是否安全有效仍不清楚。
2021年,香港大學李嘉誠醫學院生物醫學科學學院在《Int J Mol Sci》國際期刊發表了一篇《干細胞移植治療阿爾茨海默病的潛力》的綜述,在這篇敘述性綜述中,香港大學李嘉誠醫學院生物醫學科學學院討論了關于人類干細胞在AD中的治療潛力的臨床前研究和臨床試驗。臨床前研究已成功在體外將干細胞分化為神經元,表明干細胞療法在神經退行性疾病中的潛在可行性。

臨床前研究還表明,干細胞療法在改善動物模型的認知能力方面是安全有效的,盡管完成的臨床試驗很少,許多試驗仍處于I期和II期,但初步結果證實了臨床前研究的結果。然而,排斥反應、致瘤性和倫理問題等局限性仍然是干細胞療法發展的障礙。總之,使用干細胞治療AD在有效性和安全性方面顯示出前景。
干細胞治療的潛力
在一項研究中,發現神經干細胞在改善小鼠AD癥狀方面產生積極作用。神經干細胞的形式被發現對其有效性有很大的影響。
后來,科學家開發了另一種形式的干細胞療法,涉及內源性神經干細胞和祖細胞的藥理學激活。
寺本等在腦缺血小鼠模型中靜脈注射EGF和白蛋白,導致神經元替代增加100倍。他們還發現,新發育的未成熟神經元已經遷移到病變部位并分化為成熟神經元,在13周內取代了20%以上丟失的中間神經元。雖然這種干細胞治療方法尚未廣泛應用于AD試驗,但上述實驗表明它在治療AD方面具有巨大的潛力。
干細胞移植治療阿爾茨海默病的臨床研究
回顧了干細胞療法在阿爾茨海默病中的六項臨床試驗(表3)。
| 作者 | 臨床階段和持續時間 | 學習規劃 | 干細胞類型和植入途徑 | 劑量和濃度 | 結果措施 | 臨床評估 | 不利影響 |
|---|---|---|---|---|---|---|---|
| 劉等人。[20] | 第一階段 活躍 65 周 | 50至85 歲的開放標簽、前瞻性、單組分配 | 臍帶來源的同種異體hMSCs 靜脈 輸注 | 每次輸注1億個細胞 | 不可用 | 不良事件評估 ADAS-Cog MMSE 老年抑郁量表 (GDS) 氣味識別測試 阿爾茨海默病相關生活質量 (ADRQL-40) 阿爾茨海默病日常生活合作研究活動 (ADCS-ADL) 神經精神量表-Q (NPI-Q) | 不可用 |
| Oliva等,2019[157] | 第一階段完成 第二階段活躍 1 年 | 50至80 歲的隨機對照試驗 | Longeveron MSCs 靜脈輸注 | 一次用于2000萬個LMSC(低劑量)、1億個LMSC(高劑量)或安慰劑 | 不可用 | 認知評估 患者報告的結果 (PRO) 生物標志物(血清、CSF 和 MRI)。 | 無嚴重不良事件 |
| Ra等人,2011[135] | 第一階段 7 個月 | 單組 8男患者(19-60歲) | 自體脂肪來源的間充質干細胞 靜脈 輸注 | 每位患者4×108 個自體hAdMSC | 部分情況有所改善 | 血液化學、HBV/HCV、血液學和尿液分析,并篩查了 HIV 和 VDRL。 獲得了肺功能測試、胸部 X 光、脊髓獨立性測量 (SCIM)、視覺模擬量表、運動電生理學檢查、脊髓磁共振成像、體感誘發電位(分別為 MEP 和 SEP)以及使用 ASIA 的神經學檢查對于每個病人。 | 8例患者出現胸悶、胸痛、輕度發熱等19次不良事件。 |
| 牛等, 2016 [156] | I/II 期活躍期 1年 | 開放標簽、自我對照、單中心前瞻性試驗 30名患者(50至 85 歲) | hUC-MSCs 靜脈內進入肘正中靜脈 | 0.5×106hUC-MSCs/kg | 不可用 | 不良反應評價 AD改善,如CIBIC、MMSE、ADL、NPI | 不可用 |
| Medipost 有限公司 [154] | 第一階段 北美 | 開放標簽、單組分配9名患者(50至 75歲) | 人臍帶血來源的間充質干細胞 | 劑量A——每個進入點每5μL250,000個細胞,每個大腦300萬個細胞 劑量B——每個進入點每5μL500,000個細胞,每個大腦 600萬個細胞 | 不可用 | 不良事件評估 ADAS-cog的變化 | 不可用 |
| 劉等人。[20] | NA階段 12 個月 | 開放標簽、非隨機、平行分配18歲及以上 | 骨髓干細胞 (BMSC)靜脈鼻內局部近紅外光 | 14cc的BMSC部分1 cc的BMSC分數14 cc的BMSC部分 | 不可用 | MMSE 自閉癥譜系商數考試 (AQ) ADCS-ADL | 不可用 |
六項臨床試驗中的各種細胞療法審查了所有使用的間充質干細胞,它們來自不同的組織。這些臨床試驗中使用的干細胞大多通過靜脈內途徑給藥,而一項試驗中的干細胞移植是通過手術切口進行的。間充質干細胞在許多研究中的廣泛使用是由于它們報告的生存力、安全性和有效性。
干細胞治療阿爾茨海默病的機制
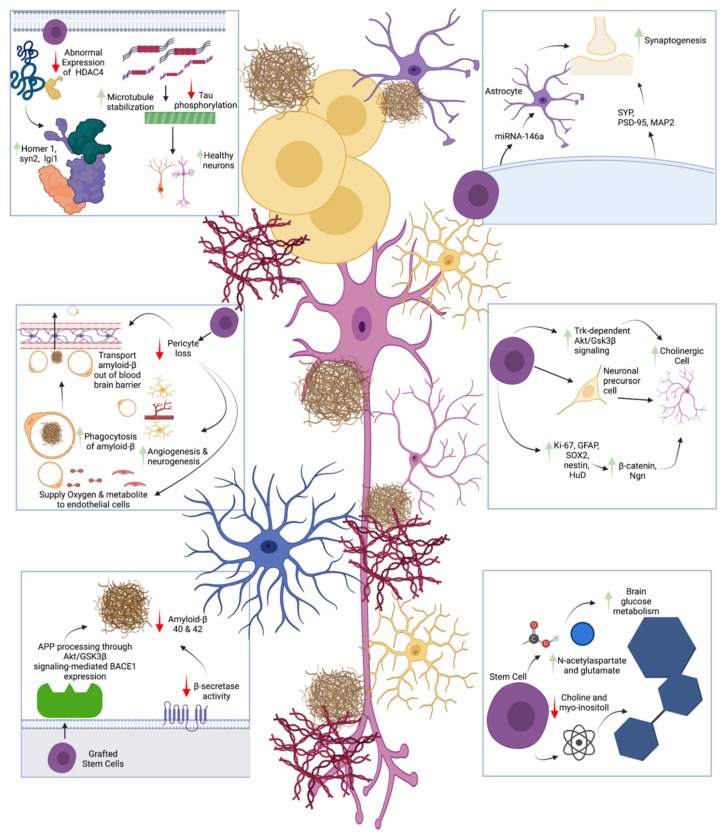
主要作用機制包括:
1.保護神經元,修復腦損傷。
2.抑制營養不良的神經元突起數量,增強神經可塑性,改善認知障礙。
3.調節神經炎癥,調節促炎和抗炎生物標志物的穩態,改善疾病癥狀。
眾多實驗結果表明,干細胞移植治療阿爾茲海默病時,不僅能夠調節腦內炎癥性環境,而且促進神經再生和突觸連接,可以有效改善病癥,具有廣闊應用前景。
此外,盧等人還報道了干細胞治療對涉及神經炎癥和周細胞的AD的影響。他們發現hNSC移植可以降低星形膠質細胞和小膠質細胞的密度,這表明抑制神經炎癥可以改善認知。Li等人顯示hNSC移植提高了NAA和GlU水平,降低了膽堿和肌醇水平,從而改善了神經元活動(圖1)。
結論
阿爾茨海默氏病每年影響全球數百萬人,并且正在成為越來越嚴重的健康負擔。盡管有多種AD治療方法可用,例如膽堿酯酶抑制劑、美金剛、NMDA受體拮抗劑和抗氧化劑,但它們的有效性很低。干細胞療法作為阿爾茨海默氏病的潛在治療方法引起了許多科學家的興趣。
近年來,對人類神經干細胞的研究大大增加,展示了它們潛在的有益作用。多年來,已經進行了許多臨床前研究來研究干細胞在AD中的有效性。干細胞治療嚙齒動物AD模型的臨床前研究已成功表明它們可以改善認知功能。
參考資料:
Chan HJ, Yanshree, Roy J, Tipoe GL, Fung ML, Lim LW. Therapeutic Potential of Human Stem Cell Implantation in Alzheimer’s Disease. Int J Mol Sci. 2021 Sep 21;22(18):10151. doi: 10.3390/ijms221810151. PMID: 34576314; PMCID: PMC8471075.
版權聲明:本網站所有注明“來源:杭吉干細胞科技”或“來源:杭吉干細胞科技”的文字、圖片和音視頻資料,版權均屬于杭吉干細胞科技網站所有。非經授權,任何媒體、網站或個人不得轉載,否則將追究法律責任。取得書面授權轉載時,須注明“來源:杭吉干細胞科技”。其它來源的文章系轉載文章,本網所有轉載文章系出于傳遞更多信息之目的,轉載內容不代表本站立場。不希望被轉載的媒體或個人可與我們聯系,我們將立即進行刪除處理。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信