CAR-T細胞療法是一種免疫療法,教導T細胞識別并消滅癌癥。CAR-T 細胞療法已在全球范圍內的一系列患者中顯示出有希望的結果。對于一些患者來說,這可以徹底消除癌癥。在其他情況下,疾病有顯著改善。
對于那些面臨癌癥的人來說,回答“什么是CAR-T?”這個問題很重要。
本指南將為想要了解這種治療癌癥的新技術平臺的讀者解答有關CAR-T細胞療法的最常見問題。?
什么是CAR-T細胞療法?治療癌癥的新方法
什么是CAR-T細胞療法?
關于CAR-T療法及其在癌癥治療中的作用,您需要了解的信息如下所述。
什么是CAR-T?
CAR-T的發音是“car tee cell”。CAR-T以一種名為嵌合體的神話生物命名。嵌合體是一種由不同動物的不同部分連接在一起而成的動物。
通過CAR-T細胞療法,患者的T細胞在實驗室內進行修飾,以便它們能夠發現并攻擊癌細胞。由于CAR-T細胞結合了不同來源的不同部分,因此被稱為嵌合體(意為“混合”或“融合”)抗原受體 T 細胞。T細胞是一種白細胞,在人類免疫反應中發揮著核心作用。經過基因改造的CAR-T細胞在給予患者時就像“活體藥物”。
什么是CAR-T細胞療法?
要了解CAR-T細胞療法, 免疫學簡史可能會有所幫助。抗原是體內的一種外來物質,可以是毒素、病原體或不健康的細胞(如癌癥),它會觸發免疫反應。然后身體產生白細胞來攻擊該藥劑。它通過使用白細胞或淋巴細胞表面上的抗原受體與其結合來實現這一點。只有這樣,身體才會產生抗體來消滅外來或患病的病原體。
問題在于,T細胞(負責破壞腫瘤細胞的白細胞)并不總是能夠識別和消除癌癥。因此,為了提高患者的免疫水平,醫學專家會采集血液、收獲T細胞,并將特定的抗原受體添加到這些細胞的表面。然后,他們通過輸血將細胞注射回患者體內,它們在那里繁殖并可以攻擊癌癥,無論是否有額外療法的幫助。
具體來說,抗原可以識別蛋白質CD-19,該蛋白質形成于B細胞表面,B細胞是一種經常癌變的血細胞。通過知道要尋找哪些蛋白質,修飾后的T細胞可以在整個血液中追捕、攻擊和摧毀它們。
如何制作CAR-T細胞?
醫生通過仔細的過程制造CAR-T細胞。首先,患者被安置在醫院并準備抽血,然后長期住院。大多數患者在開始CAR-T細胞免疫治療時已經病得很重,因此需要留在醫院直到治療完成。
然后醫生抽取病人的血液并將其輸入單采機。該裝置可分離出白細胞,包括T細胞。然后它將剩余的血液輸送回患者體內。這意味著他們不會失去大量血液,而醫生現在有健康的細胞供應可供轉化。然后醫生冷凍收獲的細胞并將其送往實驗室。
然后,實驗室工作人員將收集到的T細胞引入到每個細胞的DNA中,以制造嵌合抗原受體。然后實驗室工作人員培育出數百萬個這些細胞。一旦他們有了足夠的細胞,他們就會收獲細胞,再次冷凍它們,并通過輸血將它們輸送回患者體內。
這些T細胞,加上患者身體隨后產生的T細胞,都可以結合并攻擊癌細胞。
CAR-T細胞治療的流程
如上所述,CAR-T細胞是經過修飾以匹配癌細胞外部標記的T細胞(免疫細胞),從而使它們能夠選擇性地發現并攻擊癌細胞。
為了制造CAR-T細胞,醫生從患者體內提取 T 細胞,對其進行基因改造,使其數量倍增,然后將其重新注入患者體內,以便工程化的CAR-T細胞能夠選擇性地攻擊癌細胞。然后使用各種工具監測患者的反應。
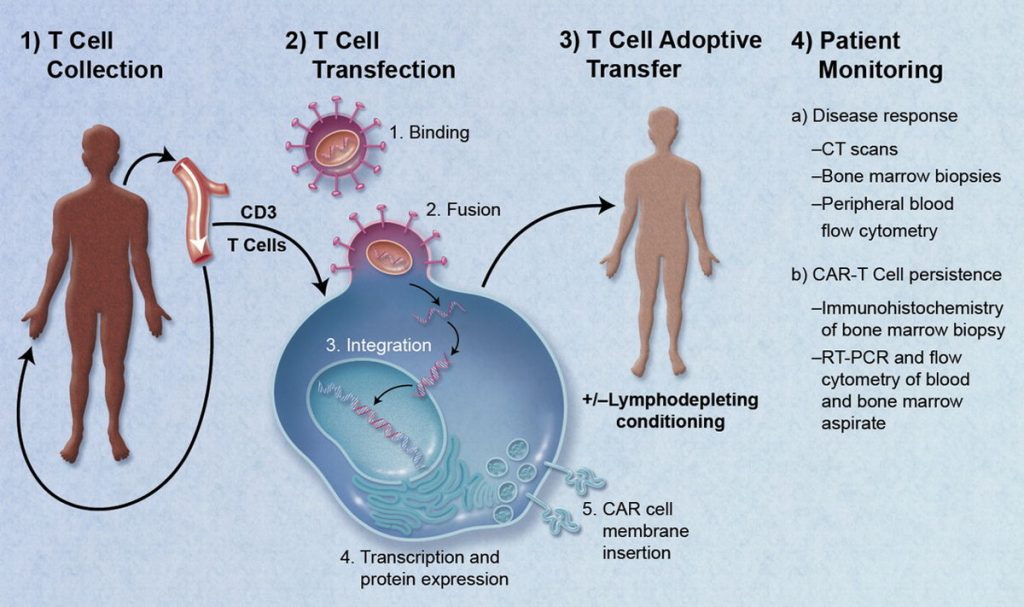
總而言之,CAR-T細胞治療過程涉及四個步驟:
- 從個體的外周血中收獲免疫細胞
- 對這些細胞進行基因改造以表達癌癥特異性嵌合抗原受體(CAR)
- 在實驗室中擴大這些細胞的數量(稱為“離體擴增”)
- 將經過修飾的細胞重新注入患者體內,以選擇性地攻擊癌細胞
CAR-T治療白血病和淋巴瘤
癌癥是無聲的殺手。很多時候,它會產生毀滅性的后果,因為人體內的細胞不善于殺死它。T 細胞就是這種情況,T細胞是人類免疫細胞,其職責是對抗入侵和疾病。
美國癌癥治療中心指出CAR-T治療是一種治療癌癥的新方法,它可能會極大地改變兒童和成人的醫療前景。否則這些患者將沒有治愈的可能。
然而,CAR-T免疫療法并不是對每個患者的包治百病。對于某些人來說,它只能在癌癥復發之前持續很短的時間。其他患者對此有反應,但遭受嚴重的副作用,幾乎無法緩解癥狀。盡管研究人員正在努力確定為什么有些療法對癌細胞有效而另一些療法卻無效,但他們仍然沒有得出確切的答案。
CAR-T細胞治療進展
2017 年,兩種實驗性CAR-T療法獲得了美國FDA的里程碑式批準,其中更多的療法已進入臨床試驗:
- Kymriah (諾華)
- Yescarta (風箏制藥)
Kymriah于2017年8月獲得FDA批準用于患有ALL的兒童和成人。2018年5月,FDA批準 Kymriah 用于第二個適應癥(彌漫性大B細胞淋巴瘤)。第二個CAR-T產品Yescarta于2017年10月獲得FDA批準用于淋巴瘤患者。此后,全球眾多監管機構已批準這些CAR-T療法,目前已有100多家公司正在開發CAR-T療法。
如今,以下CAR-T細胞療法已實現商業化:
- Kymriah(tisagenlecleucel)
- Yescarta(axicabtagene ciloleucel)
- Tecartus(brexucabtagene autoleucel)
- Breyanzi (lisocabtagene maraleucel)
- Abecma(idecabtagene vicleucel)
由于CAR-T是一項新技術,因此存在一定的挑戰。首先,在實驗室中制造抗原并將其附著到T細胞上的成本很高。其次,候選人獲得治療批準需要很長時間并且具有多種不同的規格。那么,到底哪些候選人可以接受CAR-T細胞治療呢?
誰是CAR-T細胞療法的最佳候選人?
如前所述,美國FDA于2017年批準使用兩種CAR-T細胞免疫療法:
- Kymriah:這種治療可以幫助25歲及以下的急性淋巴細胞白血病患者,尤其是兒童。它對于患有復發性非霍奇金淋巴瘤或對其他類型的治療沒有反應的成年患者也有效。
- Yescarta:這也可以治療非霍奇金淋巴瘤,這種淋巴瘤在其他類型的治療中沒有顯示出改善。
兩種治療方案都會修改T細胞,幫助它們識別和攻擊血液中患病的B細胞。患有白血病或B細胞淋巴瘤的患者此時可以申請臨床試驗。然而,如果不首先嘗試至少兩種其他更標準的癌癥療法,他們就無法做到這一點。
目前,研究人員正在試驗針對其他類型癌癥的CAR-T療法。這些包括白血病和淋巴瘤亞型,以及非血源性癌癥。迄今為止,它對抗實體瘤或不擴散到血液或骨髓的實體瘤的能力尚未證明令人印象深刻。
患者的CAR-T治療是什么樣的?
由于轉化T細胞是一個非常復雜的過程,因此治療對于患者來說通常是一個漫長的過程。從開始到結束,細胞的轉化和重新引入可能需要長達3周的時間。在此期間,由于T細胞數量的減少,患者的病情比平時更加??嚴重。這就是為什么他們通常在整個過程中都留在醫院。這樣,醫生就可以監測他們并確保他們的免疫力盡可能保持強勁。
在將修飾過的T細胞引入患者之前,醫生通常會給他們進行一輪化療。這有助于進一步削弱他們的免疫系統,從而降低現有T細胞數量超過新細胞的機會。與直覺相反,通過在短期內抑制免疫系統,醫生為患者提供了工程T細胞增殖和發揮作用的最佳機會。

輸血本身通常時間短且無痛,僅持續約一個小時。住院監測后,患者必須在幾周內定期復診。
CAR-T細胞療法有什么好處?
此類治療的巨大好處是T細胞修飾將持續終生。每當身體的T細胞遇到毒素或疾病因子并產生抗原受體和抗體來對抗它時,人就永遠擁有這種能力。這意味著接受修飾T細胞的患者現在擁有了在余生中對抗特定癌癥的工具。
這使得CAR-T細胞療法不僅僅是一種治療方法。例如,雖然化療和放療有效,但它們的療效會在治療結束時結束(或者更準確地說,在最后一個療程后的幾天或幾周)。相比之下,經過修飾的T細胞會永遠存在,將這種類型的免疫療法變成“活體藥物”。
CAR-T治療有缺點嗎?
當談到這種實驗性療法時,潛在的副作用確實存在。這些包括:
- 血細胞計數低
- 顫抖和發冷
- 嘔吐和腹瀉
- 細胞因子釋放綜合征 (CRS),細胞因子(免疫系統物質)大量釋放并開始攻擊健康組織
此外,雖然這個過程對某些患者有益,但非常耗時。考慮到必要的時間和所需的專業化,一些人質疑它實際上可以在哪里服務于更廣泛的人群。
CAR-T細胞治療的費用
雖然CAR-T療法效果持久,但獲得這些療法的費用非常昂貴。Kymriah和Yescarta在美國的售價如下:
- 美國諾華公司的Kymriah=425,000美元
- 美國Kite Pharma公司的Yescarta=373,000美元
由于價格高昂,一些保險公司在提供CAR-T細胞療法承保方面進展緩慢。
CAR-T細胞療法批準
全球首個CAR-T細胞療法獲批于2017年8月30日,美國FDA批準Tisagenlecleucel (Kymriah) 用于治療兒童和年輕人急性淋巴細胞白血病 (ALL)。
此后不久,2017年10月18日,FDA批準 Axicabtagene ciloleucel (Yescarta) 用于治療復發/難治性彌漫性大 B細胞淋巴瘤 (r/rDLBCL) 和其他罕見大B細胞淋巴瘤患者。
到2018年中期,歐洲EMA還批準了Kymriah和Yescarta。諾華公司的Kymriah在歐盟獲得上市許可,用于治療血癌,包括B細胞急性淋巴細胞白血病 (ALL) 和經過兩種或多種全身治療后復發或難治性彌漫性大B細胞淋巴瘤。Gilead/Kite Therapeutics的Yescarta被授權用于治療經過兩線或以上全身治療后復發或難治性 DLBCL和原發性縱隔大B細胞淋巴瘤 (PMBCL) 的成年患者。
加拿大衛生部批準Kymriah為加拿大首個CAR-T療法,治療用品管理局 (TGA) 批準其為澳大利亞首個CAR-T 療法。
日本厚生勞動省也于2019年3月26日批準了諾華的Kymriah,使其成為日本國內批準的首個CAR-T療法。控制吉利德科學公司CAR-T療法Yescarta在日本權利的第一三共公司 (Daiichi Sankyo) 已在日本獲得批準。
2020年7月,美國FDA批準了第三種CAR-T細胞療法,即Kite Pharma的brexucabtagene autoleucel(以Tecartus出售)。
2021年2月,Breyanzi成為第四個獲批的CAR-T,也是第一個獲得FDA許可的RMAT指定產品。
2021年3月,美國FDA批準了第五種CAR-T細胞療法Abecma,用于治療經過四線或以上療法后的復發或難治性多發性骨髓瘤。
截至2021年9月,JW Therapeutics的Relma-cel在中國獲得NMPA批準,成為中國首個自主研發并獲批1類生物制品的CAR-T產品,也是全球第六個獲批的CAR-T產品。
毫無疑問,這些全球批準證實了CAR-T細胞療法是一種有前途的新治療方法。隨著其生產、管理和安全性的改善,它將成為癌癥治療工具箱中的重要工具。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信