簡介:干細胞療法在中國已經從臨床到臨床進行了數十年的積極研究,近年來,干細胞療法的臨床試驗在中國蓬勃發展,因此其治療潛力引發了巨大的熱情和期待在醫療需求未得到滿足的各種疾病和傷害中。
但是,與其他國家和地區一樣,由于干細胞療法與其他療法(如小分子藥物和生物制劑)在來源、體內作用、臨床方案和醫療準備等。
2015年,原中國國家衛生和計劃生育委員會(NHFPC,原名衛生部 [MOH])闡明了干細胞療法的臨床轉化方法;而現在的國家衛生健康委員會 [NHC])和中國食品藥品監督管理局(CFDA,前身為國家藥品監督管理局 [SDA];現為國家藥品監督管理局 [NMPA]),在接下來的幾年中,為滿足生物技術利益相關者日益增長的需求并促進干細胞療法的發展,起草了幾項基于干細胞的產品的技術指南。在此,我們簡要介紹了中國干細胞療法的發展和監管框架,以及臨床評價問題。
國內干細胞治療監管框架的發展
近三十年來,中國對干細胞療法的監管觀念已經演變,伴隨著國內研發(R&D)概況的發展,并考慮確定此類療法是否應作為醫療產品進行管理。
細胞與基因治療于1993年5月首次進入監管部門的視野,此前衛生部發布的《人體細胞治療與基因治療臨床研究質量控制的首要考慮》解釋了細胞與基因治療在藥品管理法(DAL)的監管范圍內,此類產品的臨床試驗只有在獲得衛生部審查和批準后才能進行。此后,《新生物制品審評審批辦法》(1999)和《人體細胞治療產品研究和質量控制指南》(2003)進一步詳細說明了申請審批程序和技術考慮。
繼1998年成立SDA之后,負責監管包括細胞療法在內的醫療產品。從那時起,允許在臨床試驗中研究幾種細胞的產品,包括間充質干細胞 (MSC) 和自體免疫細胞。之后,這些產品中很少有成功地為其安全性和臨床益處提供令人信服的科學證據,而且它們都沒有被批準上市。與此同時,許多醫療機構和醫生規避法規,暗中使用未經證實的干細胞療法治療患者,并謊稱他們的療法研究,導致患者混淆,并推動評估干細胞產品的利益-風險狀況所需的嚴格監控的臨床試驗。

2009年3月衛生部實施《醫療技術臨床應用管理辦法》后,干細胞治療的監管框架與醫療技術相適應,將各種干細胞的治療歸為“III類”。醫療技術——那些被認為“存在倫理問題且仍需要臨床驗證”的技術。根據該規定,任何“三類”醫療技術在臨床使用前均應經過臨床試驗驗證,并經過衛生部的審查程序,醫療機構不得申請“三類”醫療技術。經衛生部審批。
同時,衛生部于2009年6月公布了允許臨床應用的“三類”醫療技術清單,其中包括自身免疫細胞(T細胞、NK細胞)療法和造血干細胞移植等細胞療法。造血干細胞以外的干細胞療法雖然未列入許可清單,應按規定停止,但在接下來的一段時間內繼續增長。為規范混亂局面,衛生部建議全國暫停干細胞臨床研究和治療,并要求開展為期一年的專項行動,重點檢查和整頓未經證實的干細胞治療臨床研究或應用。
干細胞治療監管新紀元始于2015年7月,國家食品藥品監督管理總局和國家衛計委聯合發布《干細胞臨床研究管理辦法》(AMSCCR),詳細規定了干細胞臨床研究的規則。《干細胞臨床研究管理辦法》是我國第一個以干細胞臨床研究管理為重點的官方文件,取消了以干細胞為基礎的“三類”醫療技術的認證和臨床使用,并明確醫院自備干細胞臨床研究只能在具有藥物臨床試驗資質以及合法且充足的干細胞研究經費支持的三甲級醫療機構(國內一流醫院)進行。負責干細胞制備和臨床研究的醫療機構,機構不得向受試者收取參加臨床研究的費用,不得發布或偽裝干細胞臨床研究廣告。
根據AMSCCR的規定,開展干細胞臨床研究的研究者應當向國家衛計委和國家食品藥品監督管理總局備案醫療機構和臨床研究項目的資料,并在中醫藥注冊管理系統進行臨床研究在線登記。國家衛生計生委和國家食品藥品監督管理總局共同成立了國家干細胞臨床研究專家委員會和倫理委員會,對材料進行審查,并會同該委員會的省級分支機構進行現場監督。備案材料經組委會受理后,方可開展臨床研究。值得注意的是,不允許在臨床研究后將醫院準備的干細胞療法用于臨床。臨床研究結果可以作為研究證據提交給CFDA,用于商業研究新藥(IND)申請的評估。
此外,AMSCCR不適用于技術規范經驗豐富的造血干細胞移植和直接向CFDA申報的干細胞產品的臨床試驗。干細胞產品的商業IND和臨床試驗由DAL監管,并附有CFDA發布的DAL實施措施(圖1)。
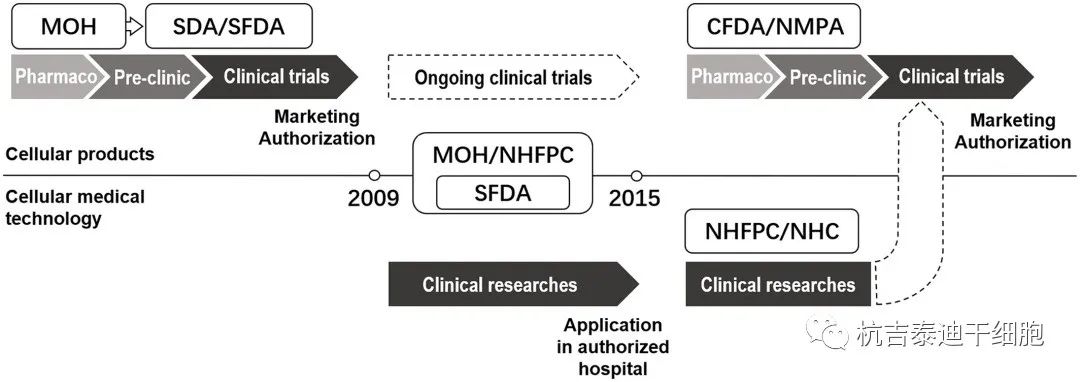
中國細胞醫學的監管框架發展
近幾十年來,政府進行了幾次重建。2008年至2013年,SFDA隸屬于衛生部。CFDA,中國食品藥品監督管理總局;衛生部,衛生部;NHC,國家衛生健康委員會;國家衛計委、國家衛生計生委;NMPA,國家藥品監督管理局;SDA,國家藥品監督管理局;SFDA、國家食品藥品監督管理局
MHC注冊的干細胞臨床研究概況和NMPA批準的干細胞產品臨床試驗
截至2020年底,已有100多家醫療機構和干細胞臨床研究項目通過AMSCCR注冊成功。這些臨床研究在中國一半以上的省份進行,最豐富的是華東地區,包括上海、廣東、北京和湖北等。(圖2A)絕大多數(83.3%)的臨床研究都在探索MSCs ,其他類型的細胞包括神經元干細胞、視網膜色素上皮細胞、羊膜上皮細胞、支氣管基底細胞和巨核細胞祖細胞。
MSCs主要來源于臍帶組織和胎盤組織、骨髓、經血和脂肪組織,也有其他來源包括胚胎干細胞和牙髓(圖2B)。而除間充質干細胞外,其他干細胞的來源包括胚胎干細胞、羊膜組織和支氣管基底層等自體組織。這些干細胞的臨床研究涉及的適應癥種類繁多,一般涉及各種器官系統的疾病,主要是消化系統、泌尿生殖系統、呼吸系統、神經系統、皮膚和皮下組織、內分泌系統、循環系統、肌肉骨骼系統和結締組織等。
自COVID-19大流行爆發以來,干細胞的療法也在治療嚴重的 COVID-19相關肺炎和急性呼吸窘迫綜合征方面進行了測試。值得注意的是,與免疫細胞療法的腫瘤聚焦趨勢相反,2C)。
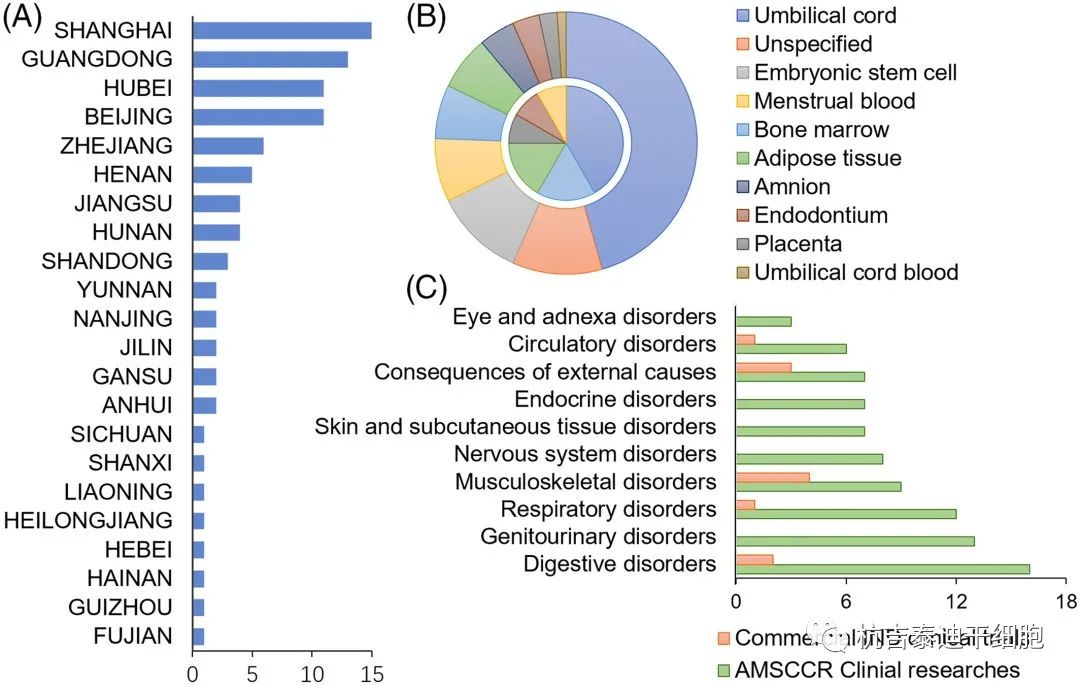
2020年底AMSCCR臨床研究和干細胞產品臨床試驗概況,(A)AMSCCR臨床研究的地域分布。(B) AMSCCR 臨床研究(外環)和商業IND臨床試驗(內環)中干細胞的起源。(C) 干細胞研究中探索的患者群體。AMSCCR,干細胞臨床研究管理辦法;IND,在研新藥
另一方面,干細胞產品的研發在中國蓬勃發展。自2019年起,NMPA啟動了干細胞和基因治療產品監管科學行動,以完善此類先進治療產品的監管框架,此后發布了有關干細胞產品開發的若干指導意見或規劃。自AMSCCR實施以來,已有數十家干細胞產品申辦者與負責在研藥物審評的國家藥監局藥品審評中心(CDE)進行了溝通。來自臍帶、骨髓、脂肪、胎盤、月經或牙髓的10多種MSC產品的臨床試驗應用已獲得CDE授權。值得注意的是,這些項目中的大多數也根據AMSCCR進行了注冊,并且這些臨床試驗中探索的適應癥譜——包括膝關節骨關節炎、移植物抗宿主病、糖尿病足潰瘍、缺血性中風、潰瘍性結腸炎、慢性牙周炎或特發性肺纖維化——與他們的對應臨床研究一致。
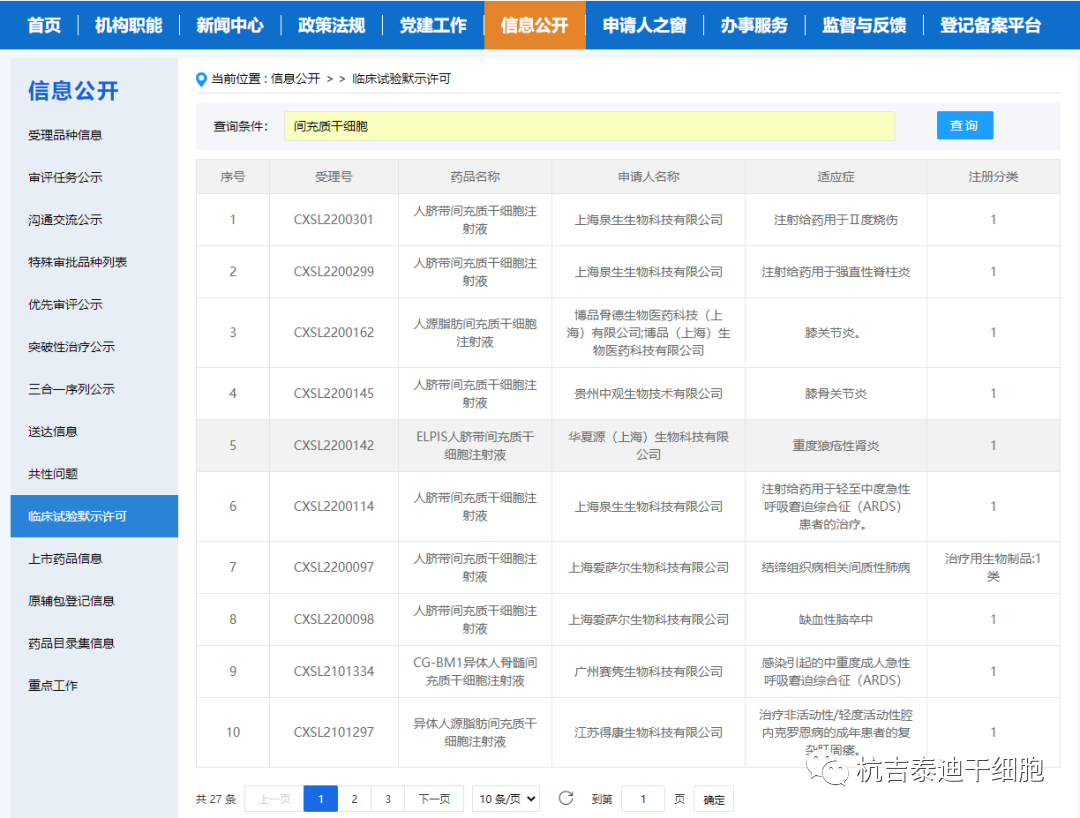
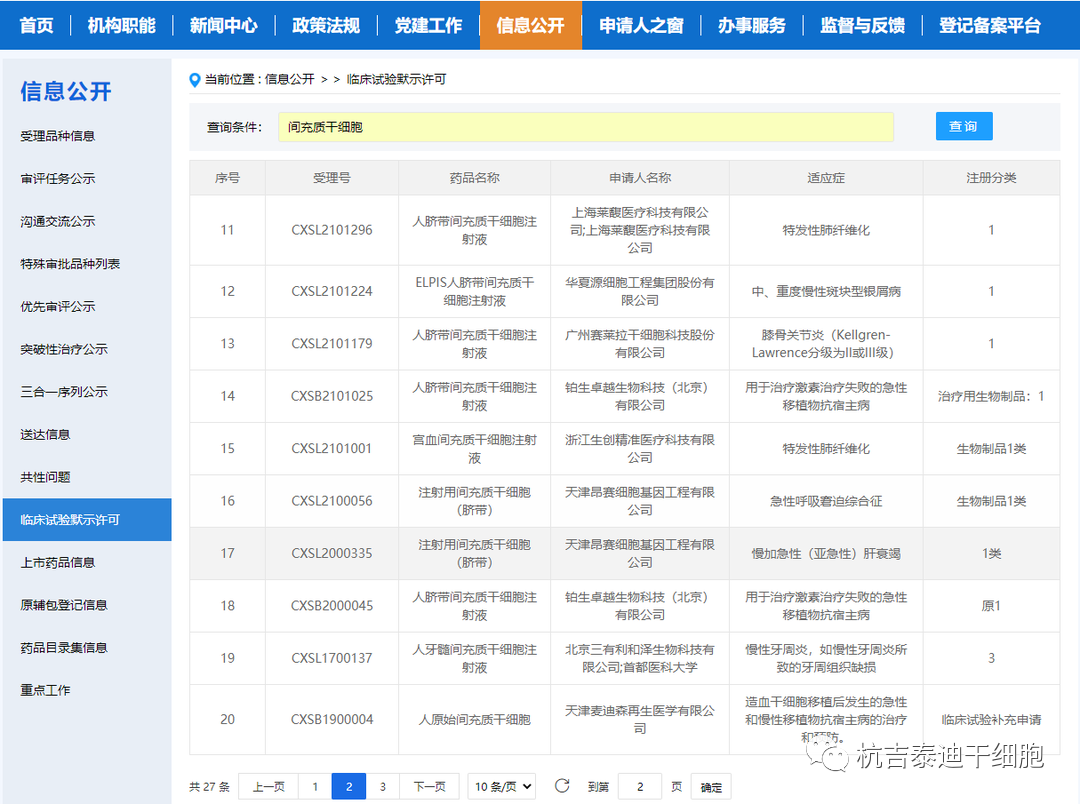
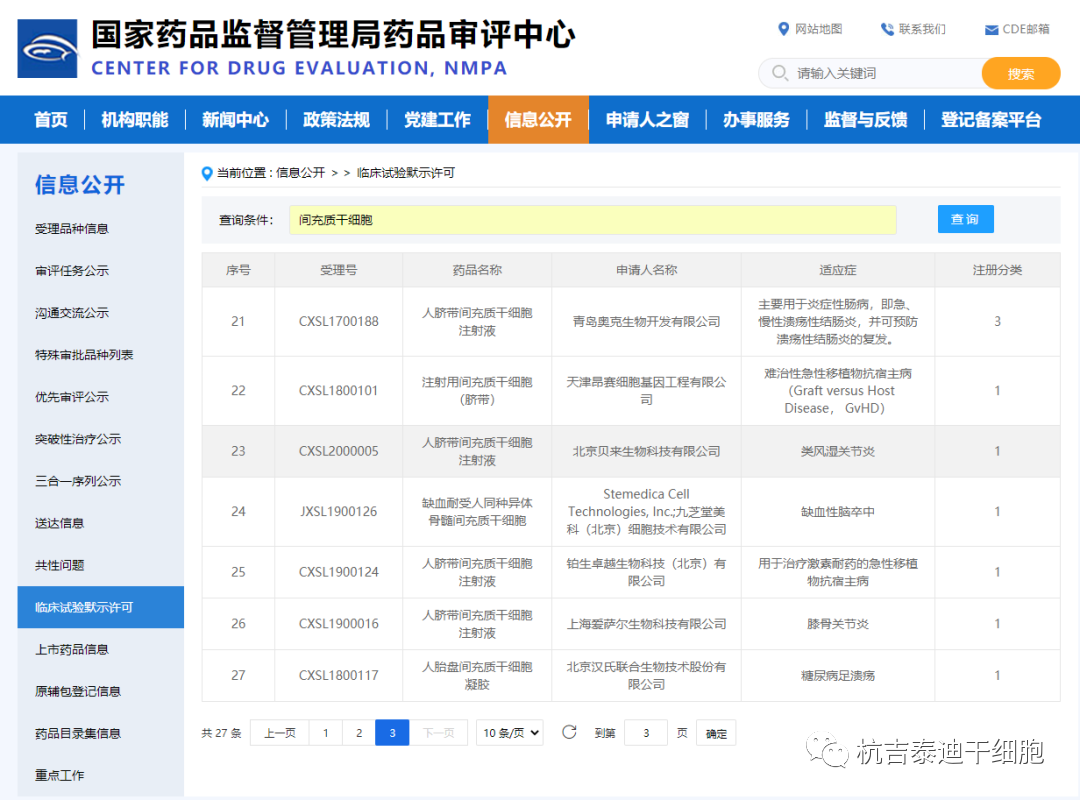
盡管源自這些注冊的基于干細胞的臨床研究的信息不能作為AMSCCR規定的藥物評估證據毫無疑問地被接受,但CDE普遍承認這些信息在初步了解測試產品的臨床效益-風險概況和開發以市場為導向的臨床試驗計劃。如果在根據AMSCCR注冊的臨床研究中發現某些基于干細胞的產品的劑量遞增效應,則對于普通IND申請而言,劑量發現試驗可能不一定要重新進行。實際上,在AMSCCR研究中獲得的安全信息,很少有干細胞的研究產品被允許進入II期臨床試驗。
中國干細胞產品臨床試驗注意事項
確定的臨床獲益是干細胞產品在中國獲得上市許可的前提。細胞和基因治療產品與其他藥物產品在臨床試驗的不同階段通常具有共同的原理和目的,即探索研究產品在早期臨床試驗、后期治療方案和效益風險概況中的劑量遞增、安全性和耐受性在晚期確認性臨床試驗的目標人群中。然而,干細胞產品的臨床試驗也有明顯不同的考慮。
倫理審查
人類生物醫學研究的倫理共識已經建立,而與其他藥物產品相比,人類干細胞研究在生物材料捐贈、細胞來源、干細胞臨床試驗監督等方面存在更多倫理困境。國際干細胞研究學會等學術團體就干細胞研究的基本倫理原則提出了不斷發展的科學觀點,例如研究企業誠信、自愿知情同意、患者福利、透明度和社會正義,我國干細胞臨床研究倫理審查中也有相關內容,詳見《人體臨床研究倫理審查委員會建設指南》。
首次人體研究
臨床前概念驗證研究對于了解干細胞的產品的作用機制、增殖、分化和遷移等生物學特性以及致瘤性等安全性問題至關重要,對確定干細胞產品具有重要意義。盡管跨物種生理差異和免疫學不相容性可能是準確推斷體內細胞行為的障礙,但臨床研究的交付方案和預測人體的分布和作用。為基于干細胞的療法創建一組信息更豐富的動物模型可能有助于克服這些缺點。
首次人體臨床試驗應謹慎開始劑量遞增方案和間隔給藥,以避免受試者同時暴露于不合理的并發癥。對于應遞送至病變部位而不是全身給藥的基于干細胞的產品,遞送系統的可行性和生物相容性,例如血管內導管插入術或心臟和中樞神經系統疾病的手術注射,也應與細胞。此外,建議對活細胞進行臨床跟蹤,因為它有利于展示干細胞在體內的生物分布、移植和清除。
收益-風險評估
以干細胞為基礎的產品已在中國廣泛的適應癥中進行了調查。在臨床效益評估中推薦與臨床實踐指南或共識一致的終點。未經證實或替代的終點,例如細胞因子或生物標志物的變化、減少或停止伴隨治療,通常不被接受為確認性臨床試驗中的主要療效評價標準,除非這些終點與患者臨床獲益之間的相關性已得到證實.
作為一種活的藥物,基于干細胞的產品通常在體內存活很長時間;重復使用基于異基因干細胞的產品可能會誘發免疫反應,從而降低其有效性和/或增加安全風險。因此,干細胞產品的效益風險評估關注療效持續時間,需要持續監測和長期隨訪以避免延遲反應的可能性,例如治療后的腫瘤形成。
結論
近年來,干細胞的治療已成為我國極具發展前景的生物醫學研究課題。隨著對干細胞研究的科學、社會和倫理方面的理解不斷加深,中國的監管框架在過去幾十年中不斷發展。盡管在國內和許多其他國家,監督和促進干細胞治療發展的最有效方式仍遠未完善,但以患者為中心的評估對于患者保護和臨床利益風險評估至關重要系統。
致謝
這項工作得到了中國藥品監管科學行動計劃的支持。科學家和專業人士為改善中國再生醫學監管所做的貢獻受到高度贊賞。
參考資料:Glyn N. Stacey, Jingyi Cao, Baoyang Hu, Qi Zhou, Manufacturing with pluripotent stem cells (PSConf 2021): Key issues for future research and development, Cell Proliferation, 10.1111/cpr.13301, 55, 8, (2022).
作者:高建超,高晨艷
國家藥品監督管理局藥品審評中心生物制品臨床評價辦公室,
中國北京中國北京市朝陽區建國路128號國家藥品監督管理局藥品審評中心生物制品臨床評價辦公室
說明:推文用于傳播知識,分享行業動態,不構成任何醫療和投資建議,如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信