近年來,干細胞療法已成為生物醫學領域最具顛覆性的研究方向之一。這類療法通過激活干細胞的多向分化潛能與免疫調節功能,為傳統藥物難以攻克的疾病(如遺傳缺陷、退行性疾病及癌癥)提供了全新的治療思路。
據統計,全球已有超過29款干細胞產品獲得監管機構批準,針對血液系統疾病、免疫紊亂及組織損傷等適應癥,而目前正在開展的臨床試驗更逾800項,其中造血干細胞(HSC)與間充質干細胞(MSC)因其獨特的生物學特性占據主導地位。
然而,盡管臨床前景廣闊,干細胞療法的轉化之路仍布滿荊棘。從細胞來源的標準化、體外擴增的效率瓶頸,到移植后存活率低、功能異質性等科學挑戰,再到監管框架與倫理爭議的全球性分歧,每一環節均需突破性創新。
干細胞療法為何難落地?-從29款獲批產品到800項試驗背后的挑戰與突破
近期,美國馬薩諸塞州哈佛大學約翰·保爾森工程與應用科學學院在期刊雜志《生物功能與轉換醫學主頁》上發表了一篇”Stem cell therapies in the clinic“的文獻綜述。

該綜述旨在系統梳理干細胞療法的臨床進展,通過分析已獲批產品與前沿臨床試驗數據,揭示造血干細胞與間充質干細胞的治療潛力與局限性,并重點探討加速其臨床轉化所需的多學科協作路徑。
科學奇跡還是現實曙光?干細胞療法的百年征程與未來猜想
細胞療法是一種通過移植活細胞材料來治療疾病的前沿醫學手段,其核心優勢在于細胞能動態響應生物信號、穿透生物屏障并可能通過單次治療實現長期療效。該療法起源于19世紀,現主要分為兩大方向:
- T細胞療法:以1986年首次癌癥過繼轉移治療為起點,歷經30年發展已革新癌癥免疫治療。FDA已批準多種血液腫瘤療法,并擴展至實體瘤領域(如晚期黑色素瘤)。
- 干細胞療法:自1959年首例白血病骨髓移植起,逐步發展出造血干細胞移植(HSCT)和1976年發現的間充質干細胞(MSC)技術。全球監管機構已建立相關標準,批準產品涉及多種疾病,但約80%療法仍處于早期臨床試驗階段,需解決制造工藝、安全性驗證及適應癥擴展等挑戰。
我們首先回顧了幾十年來指導干細胞療法發展的歷史努力。接下來,我們確定了29種已獲準在各個國家用于臨床的干細胞療法產品和800項利用干細胞作為治療方式的活躍臨床試驗。
我們的分析僅限于以干細胞為主要治療成分的治療干預,不包括主要關注干細胞以外方式的試驗和產品。
在我們的分析中,我們發現兩種不同類型的干細胞——造血干細胞 (HSC) 和間充質干細胞 (MSC)——占獲批干細胞療法產品和臨床試驗的大多數(圖1)。幾種專門的干細胞和未純化的干細胞濃縮物僅占少數療法。
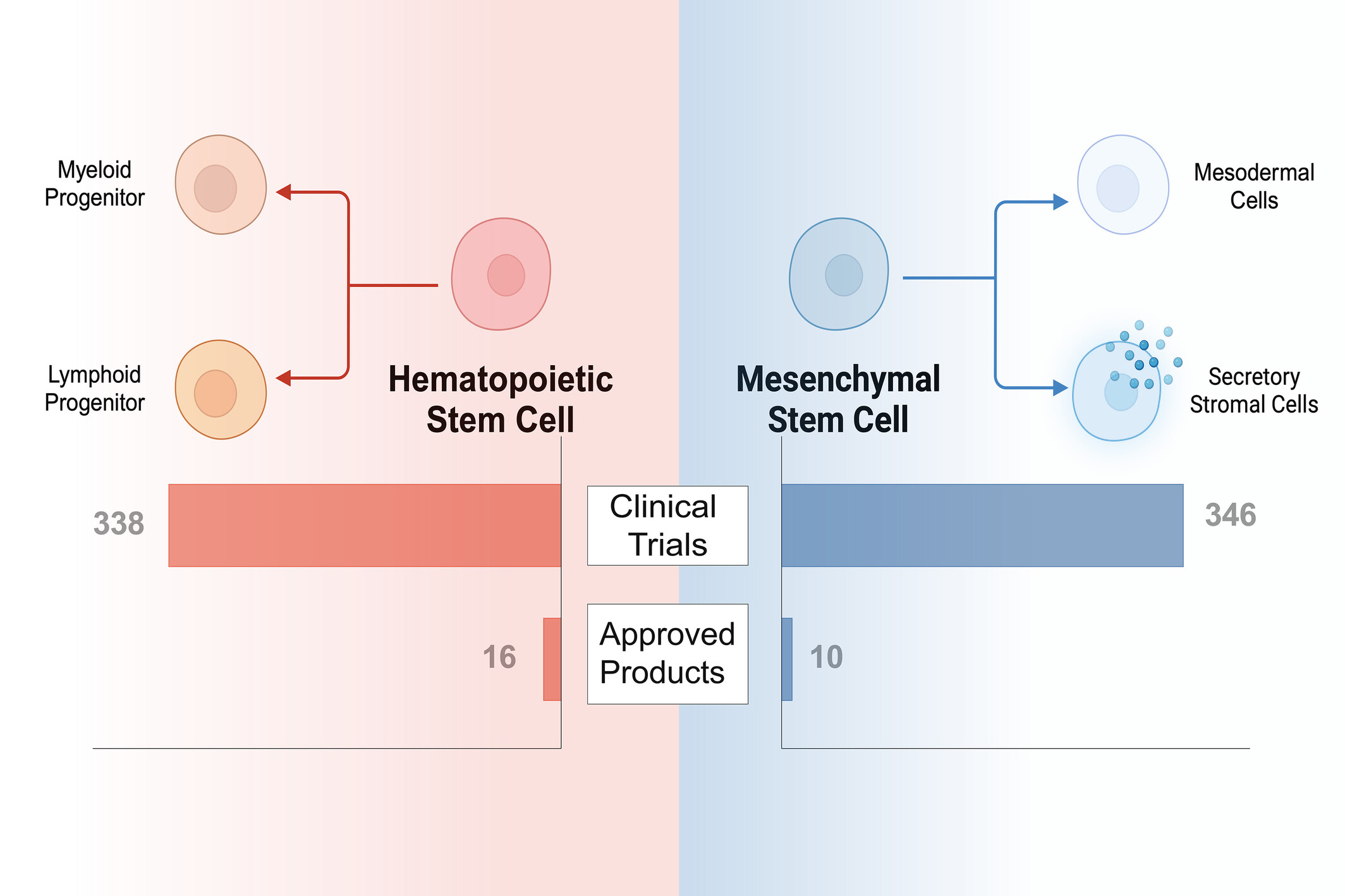
因此,我們根據干細胞類型組織討論。我們簡要概述了歷史發展,全面調查了獲批產品,對活躍的臨床試驗進行了批判性分析,并詳細分析了干細胞療法目前面臨的挑戰。這篇綜述是對我們過去對細胞療法的分析的更新,僅關注干細胞療法。
干細胞的背景-生物學及歷史發展
干細胞存在于胚胎和成年組織中,依發育潛能分為全能、多能、多能干細胞、寡能和單能細胞。
全能和胚胎多能干細胞因倫理受限。研究致力于將患者終末分化細胞轉化為誘導多能干細胞并用于治療,但誘導多能干細胞臨床研究尚處起步,占比小。當前臨床試驗主體是造血干細胞和間充質干細胞等多能干細胞,本文綜述以此為主,也會涉及其他不常見干細胞類型。
什么是造血干細胞(HSCs):
- 功能與應用:HSCs是能分化為血細胞的多能細胞,可通過重建血細胞或重編程免疫系統治療多種血液疾病。移植程序包括采集、純化和移植,部分情況會在體外修飾擴增。
- 發展歷程:始于20世紀50年代,早期因HLA不匹配患者死亡,70年代供體短缺,后通過自體外周血和異基因臍帶血方案解決。80年代可讓癌癥患者接受更高劑量放化療,但存在產品純度問題,為此開發了預處理和移植后調節方案,分MAC和RIC兩種類型,同時不斷優化方案以平衡毒性和免疫消融。
- 臨床進展:多樣化干細胞來源、靈活的HLA匹配、溫和的調節方案、高純度制劑和改進的患者管理擴大了其適用范圍。自體用于減少GvHD并發癥,異基因用于免疫治療。美國相關法案要求報告異基因移植數據,CIBMTR管理并分析數據,為進一步發展提供基準。

什么是間充質干細胞(MSCs):
- 功能與應用:是能分化為中胚層細胞并調節免疫系統的多能細胞,可用于再生和免疫調節,1995年首次用于患者。可從骨髓、脂肪、臍帶組織和胎盤等分離,能在體外培養擴增并分化為多種間充質組織。
- 體內應用挑戰與益處:體內應用存在再生性能和植入率問題,但因分泌生物活性分子,通過抗凋亡和營養機制促進再生。
- 免疫調節機制:經炎性因子刺激可分泌抗炎因子,用于免疫過度激活疾病,但免疫調節活性需特定預處理激活。
- 機械轉導作用:過去20年發現底物彈性和細胞微環境粘彈性可調節 MSCs命運。盡管療效不一,但安全性佳,是治療多種疾病的多功能工具。
應用現狀
- 典型臨床劑量為1-1.5億細胞,需特定預處理激活免疫調節功能。
- 盡管多數試驗處于早期階段,MSCs在組織修復和免疫疾病中的潛力持續推動臨床研究。

全球批準的細胞治療產品
雖然干細胞已在臨床上應用了50多年,但定義明確、經機構批準的細胞產品直到2010年代才首次面世。首個經機構批準的干細胞療法是Queencell? (Anterogen),這是一種用于治療皮下組織缺損的MSC產品,于2010年獲得韓國食品藥品安全部 (SK MFDS) 的批準。在接下來的十年中,干細胞療法的臨床應用顯著擴大,獲得了世界各地監管機構的多項批準(圖2)。
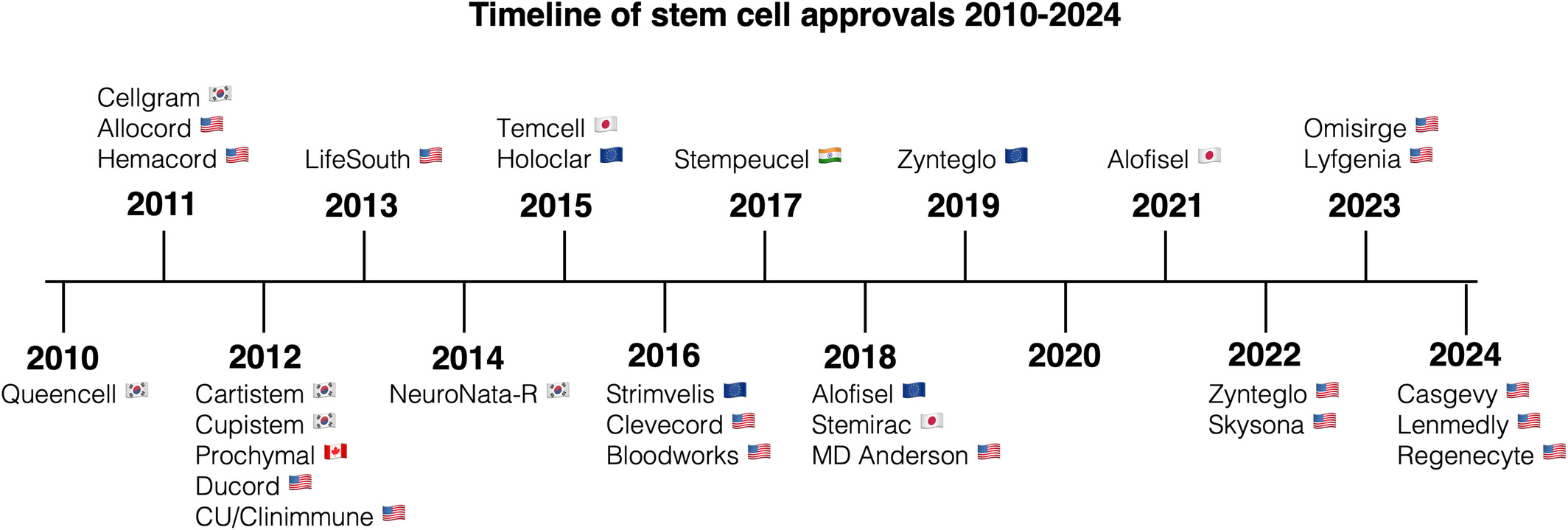
根據我們對文獻和政府數據庫的搜索,全球共有27種干細胞產品獲得29次批準,其中包括16種HSC產品、12種MSC產品和1種角膜緣干細胞 (LSC) 產品(圖3a)。干細胞類型、來源和批準適應癥的變化似乎與區域趨勢相關(圖3b)。
更正:目前應該是29款干細胞產品。
- 28:間充質干細胞新藥時代來臨!美國首款間充質干細胞(MSC)產品獲FDA批準!
- 29:2025年1月2日,CCTV13新聞報道了一則振奮人心的重磅消息——我國首款干細胞治療藥品正式獲批上市!
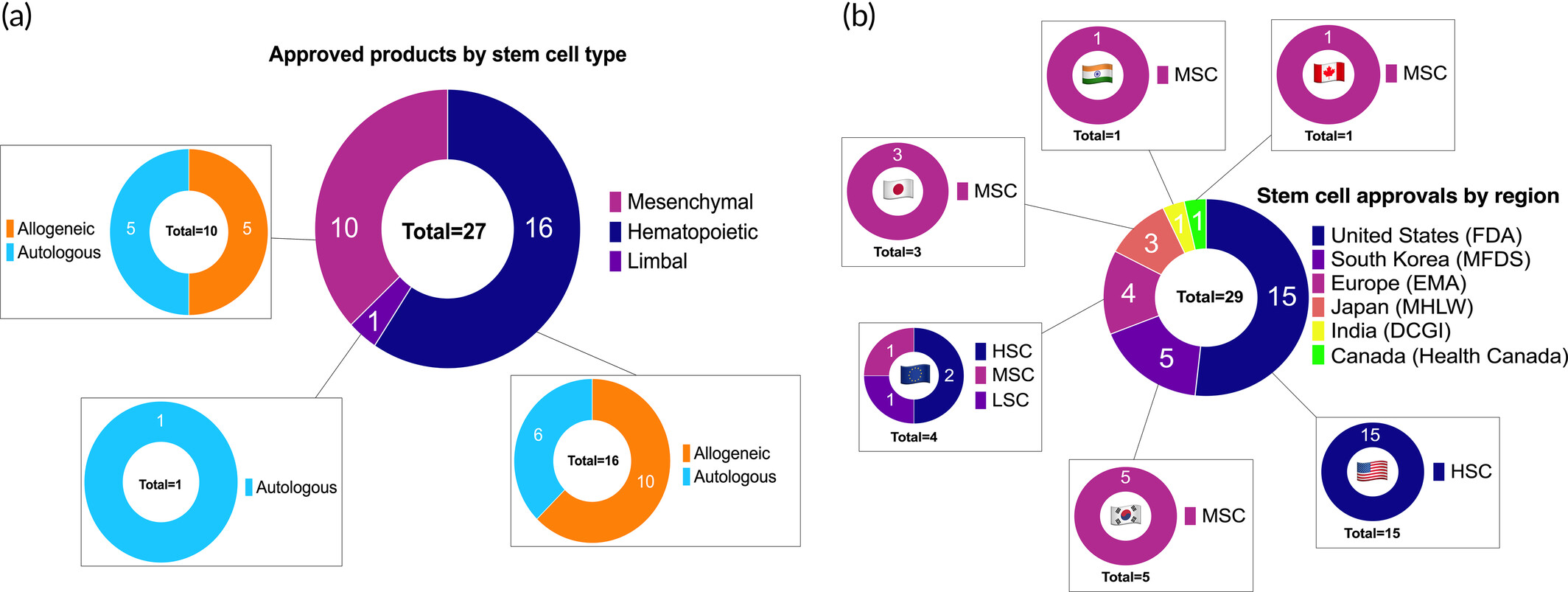
(a)按干細胞類型對已批準產品進行分類。(b)按地區對干細胞批準進行分類。
已批準的造血干細胞產品
截至2024年11月,美國(FDA)和歐洲(EMA)共批準16種HSC療法產品,其中:1種獲FDA和EMA雙重批準,14種僅獲FDA批準,1種僅獲EMA批準。值得注意的是,盡管全球每年開展數萬例造血干細胞移植(HSCT),但僅有FDA和EMA對HSC產品進行正式監管審批。
全球造血干細胞移植的應用趨勢
- 規模:1957至2019年全球累計完成150萬例HSCT,且異移植比例持續上升。
- 區域分布:美歐年移植量超7萬例(美國2萬+/歐洲近5萬),仍為最大市場。非洲、東地中海等資源有限地區HSCT增速最快,尤其在急性髓系白血病治療中表現顯著。
監管標準與豁免條件
根據FDA規定,符合以下條件的HSC療法無需審批:
- 最小化處理:未涉及細胞工程或制造工藝改變(如常規骨髓移植)。
- 同源用途:用于重建原有功能(如造血系統再生)。
反之,經工程改造或復雜工藝的HSC產品需接受嚴格質控與安全審查。
創新造血干細胞產品案例
功能增強型
- Omisirge?(Gamida Cell,2023年獲批):煙酰胺體外擴增HSC,縮短中性粒細胞恢復時間并降低感染風險。
基因改造型
- Zynteglo? & Lyfgenia?(Bluebird Bio):慢病毒載體修復β-珠蛋白基因,治療血紅蛋白病。
- SKYSONA?(Bluebird Bio,2022年):治療兒童腦腎上腺腦白質營養不良(CALD)。
- Lenmedly?(Orchard Therapeutics,2024年):治療異染性腦白質營養不良(MLD)。
- REGENECYTE(StemCyte Inc.,2024年11月獲批):臍帶血HSC療法,用于造血與免疫系統重建。
已批準的間充質干細胞與角膜緣產品
間充質干細胞(MSC)產品
目前全球已有12項間充質干細胞產品獲得13次批準
- 美國FDA(1項):2024年12月18日,美國食品藥品管理局(FDA)正式批準了首個間充質基質細胞(MSC)療法——Ryoncil(remestemcel-L-rknd),用于治療2個月及以上兒科患者的類固醇難治性急性移植物抗宿主病(SR-aGVHD)。
- 其他國家:共批準12種MSC產品,主要分布于:
- 亞洲(占90%):韓國(5)、日本(3)、中國(1)、印度(1)
- 歐美:歐洲(1)、加拿大(1)
間充質干細胞新藥適應癥分類
獲批MSC產品覆蓋四大治療領域:
- 軟組織再生(如Queencell?、Cupistem?)
- 骨關節炎(如Cartistem?、Stempeucel?)
- 中樞神經系統疾病(如NeuroNata-R?治療漸凍癥、Stemirac治療脊髓損傷)
- 移植物抗宿主病(GvHD)(如Prochymal?、TEMCELL?)
間充質干細胞新藥來源分析
- 骨髓來源(8/12):自體(Cellgram?)與異體(Prochymal?)均有,適應癥覆蓋全部四類。
- 脂肪來源(3/12):僅用于軟組織再生(如Queencell?)。
- 臍帶血來源(1/12):Cartistem?用于骨關節炎軟骨修復。
角膜緣干細胞(LSC)產品:里程碑突破
- Holoclar?(2015年EMA批準):全球首個獲批的干細胞療法,用于治療角膜緣干細胞缺陷癥(如化學燒傷致盲)。
- 技術核心:取自患者健康角膜緣的1-2mm2活檢樣本,經人纖維蛋白支架體外擴增后移植,重建透明無血管角膜。
- 臨床價值:為角膜再生提供精準解決方案,標志著眼科再生醫學的實質性進展。
- 現狀與展望:LSC療法仍處于早期階段,Holoclar?是唯一獲批產品,但其成功為其他眼科適應癥(如干眼癥、角膜潰瘍)奠定技術基礎。
未來需解決規模化生產、長期安全性驗證及成本可及性問題。
總結對比
| 干細胞類型 | 獲批產品數 | 核心適應癥 | 技術成熟度 |
|---|---|---|---|
| HSC | 16(美歐) | 血液疾病、免疫重建 | 高度成熟 |
| MSC | 12(日韓中美) | 軟組織修復、GvHD等 | 中低成熟 |
| LSC | 1(歐洲) | 角膜再生 | 新興領域 |
正在進行的造血干細胞、間充質干細胞的臨床試驗
研究人員通過系統檢索“ClinicalTrials.gov”數據庫,以“干細胞”“HSC”“MSC”為關鍵詞,篩選出狀態為 “尚未招募”“正在招募”“正在進行但不招募”“邀請招募” 的干預性研究,經人工篩選確定了800項將干細胞作為主要治療成分的臨床試驗。
隨后從干細胞類型(圖4a)、試驗階段(圖4b)、試驗狀態(圖4c)、細胞來源(圖4d)、給藥方式和適應癥等方面對這些試驗進行詳細分析。為避免重復計數,對于跨多個疾病類別的適應癥只歸入一個類別,但承認這種分類在數據分析中存在不一致性。
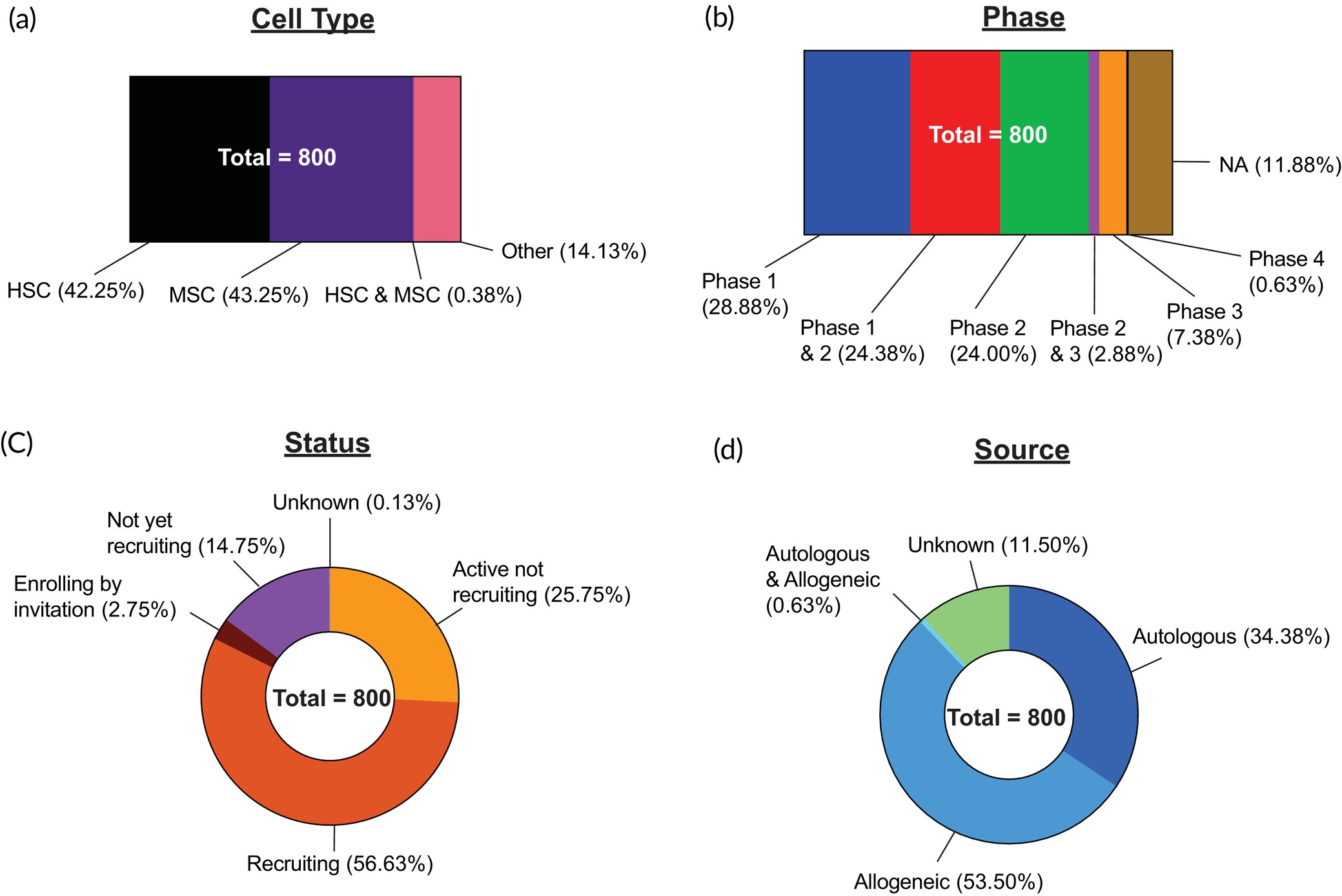
對800項干細胞臨床試驗進行了分析,并根據以下標準進行分類:(a) 細胞類型;(b) 試驗階段;(c) 試驗狀態;(d) 細胞來源。不適用 (NA)。
臨床試驗分為不同階段,每個階段的目的不同:
- 第1階段-在小群體(20-80人)中研究治療的安全性和副作用;
- 第2階段-在大群體(100-300人)中確定治療的有效性;
- 第3階段-確認有效性、監測副作用,并將治療與既定標準進行比較;
- 第4階段-在藥物批準后跟蹤安全性并尋求有關該藥物的更多信息。
在分析的800項活躍試驗中,HSC(n?=338,42.25%)和MSC(n=346,43.25%)的試驗數量幾乎相等。就細胞來源而言,53.50%為同種異體,而34.38%為自體。
造血干細胞(HSC)臨床試驗的新興趨勢
在分析的臨床試驗中,42.3%(n=338)涉及造血干細胞(HSC)的應用。其中,44%處于臨床Ⅰ期,34%處于臨床Ⅱ期,僅10%進入臨床Ⅲ期(圖5a)。盡管HSC已廣泛用于治療多種疾病,但早期階段試驗的主導地位表明學界對推進HSC向下一代療法發展的強烈興趣。這些早期試驗包括探索新型藥物與HSC移植協同作用的可能性。
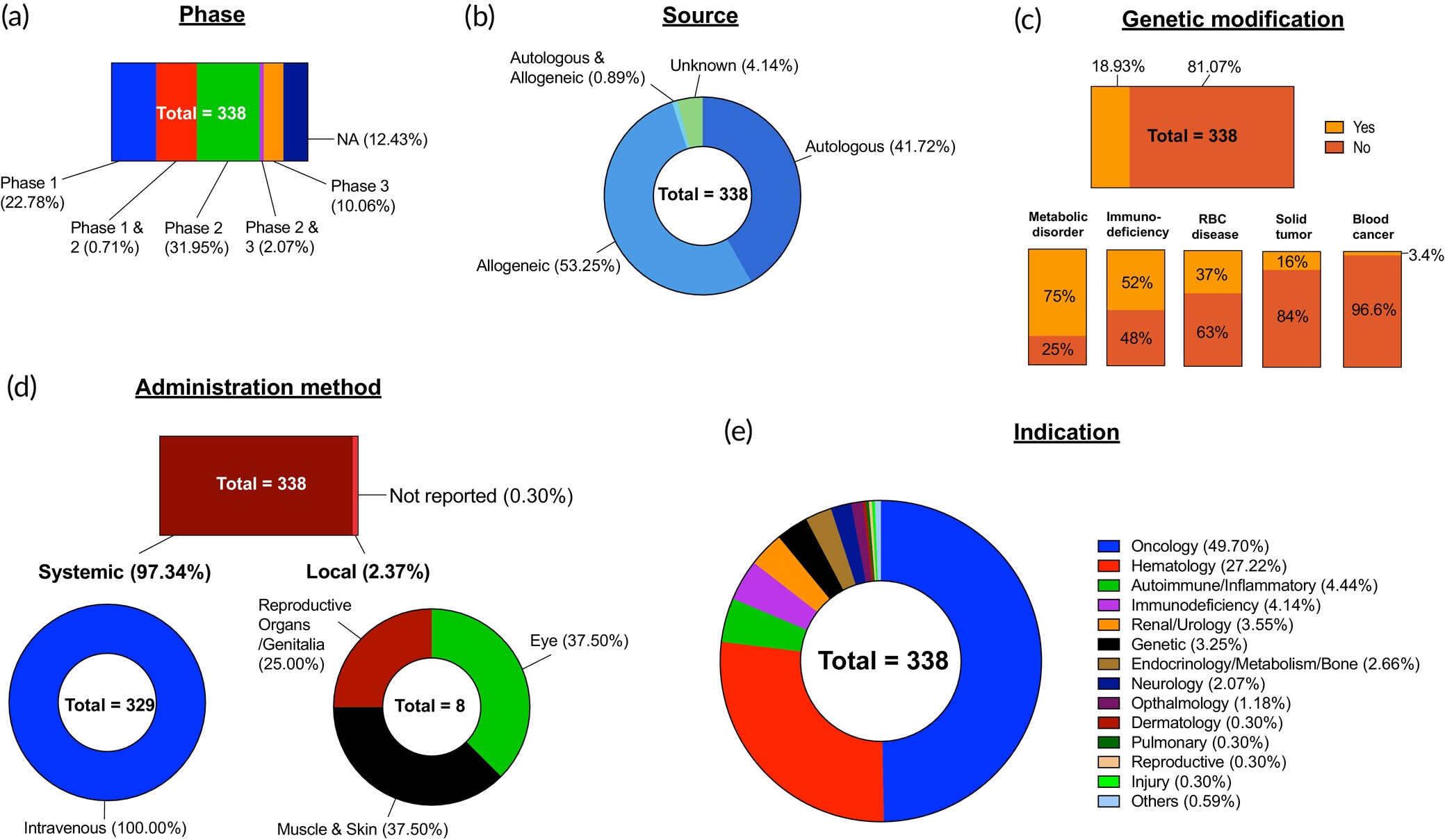
對338項HSC臨床試驗進行了分析,并根據以下方面進行了分類:(a) 試驗階段;(b) 細胞來源;(c) 基因改造;(d) 給藥方法,進一步分為全身和局部途徑;(e) 適應癥類型。不適用 (NA)。
預移植聯合方案旨在優化靶向清除特定免疫細胞(如T細胞、B細胞)的藥物選擇,而移植后聯合方案則利用現有免疫調節劑控制基礎疾病并支持移植后急性期的植活。涉及的藥物/技術包括:
- 預處理期免疫耗竭抗體(如抗CD3抗體NCT00319657、抗CD45抗體NCT03670966)
- 體外T/B細胞去除裝置(如NCT03653338、NCT02061800)
- 移植后免疫調節劑(如PD-1抑制劑NCT05137886、抗CD38抗體NCT04268498等)
- 免疫細胞療法(如T細胞NCT05239676、NK細胞NCT05654038)
- 樹突狀細胞疫苗(如NCT03334305)
這一研究熱潮源于近期發現:通過選擇性清除供體HSC和受體患者體內的適應性免疫細胞(如B/T細胞),可預防急性和慢性移植物抗宿主病(GvHD),從而減少移植后免疫抑制的需求,并允許采用更溫和甚至無毒的預處理方案,顯著改善患者生活質量。
造血干細胞創新應用探索
部分早期試驗正拓展HSC的傳統適應癥范圍,包括:
- 精神疾病:如酒精相關抑郁癥(NCT03265808)
- 器官移植耐受:肺(NCT03500731)、腎移植(NCT00319657)
- 腫瘤靶向治療:通過基因修飾HSC靶向實體瘤標志物(如NY-ESO-1;NCT03240861)、抵抗HIV感染(NCT02797470)、化療耐藥(P140K MGMT;NCT05052957)
- 精準遞送:腫瘤特異性細胞因子遞送(NCT03866109)
- 再生醫學:修復缺血性或退化性視網膜病變(NCT03981549)
造血干細胞的臨床Ⅲ期試驗特點
僅有10%的HSC試驗進入臨床Ⅲ期,其中:
- 82%聚焦于血液系統疾病(如白血病、代謝紊亂、遺傳性血液病),部分療法已獲批;
- 18%探索非傳統適應癥,包括眼癌(NCT00554788)、腦癌(NCT00085202)、乳腺癌(NCT01646034)及腎移植排斥(NCT03363945)。
療效終點因疾病類型和試驗設計差異顯著,主要包括:
- 毒性指標:GvHD嚴重程度、劑量限制性毒性、治療中斷率;
- 有效性指標:移植物排斥率、植活率、微小殘留病陰性率、復發率、無進展生存期等。
目前,HSC臨床試驗的終點設定復雜多樣,跨階段、跨疾病的系統性趨勢分析面臨挑戰。
HSC臨床試驗呈現兩大方向:
- 優化現有療法:通過新型免疫調節策略減少GvHD風險,提升患者生存質量;
- 拓展適應癥:探索其在腫瘤免疫治療、器官移植耐受及再生醫學中的潛力。
臨床Ⅲ期研究仍集中在血液系統疾病,但實體瘤和器官排斥領域的突破性應用值得關注。
造血干細胞療法的來源
在分析的臨床試驗中,異體HSCT(53.3%,n=338)略多于自體HSCT(41.7%,圖5b),這與當前臨床實踐(自體HSCT更常用)形成鮮明對比。然而,隨著無關供體注冊數量的增加,異體HSCT可能在臨床中逐漸超越自體HSCT。
供體類型的選擇不僅涉及物流問題,還直接影響治療效果:
- 異體HSCT可通過移植物抗宿主反應(GvHD)靶向受體體內的惡性細胞(如白血病細胞),對癌癥患者產生免疫治療效應,或對自身免疫病患者產生免疫抑制效應。
- 自體HSCT因耐受性好,主要用于從放化療毒性中恢復患者,或糾正血液系統疾病(如遺傳性或獲得性障礙)。
值得注意的是:
- 90.6%的體外基因編輯HSCT試驗使用自體細胞,因其常用于修復患者自身HSC的遺傳缺陷。
- 87.5%的實體瘤治療HSCT試驗也采用自體細胞,這可能與20世紀早期異體HSCT的腫瘤靶向效果有限有關,導致其使用率下降。
目前,HSCT在實體瘤治療中的主要目標是減輕放化療的毒性作用。
造血干細胞的組織來源
臨床中造血干細胞的三大來源為:
- 骨髓干細胞(髂骨穿刺采集);
- 動員外周血干細胞(通過粒細胞集落刺激因子G-CSF聯合白細胞分離術獲取);
- 臍帶血干細胞(分娩時采集)。
臨床偏好與挑戰:
- 外周血干細胞因避免骨髓穿刺疼痛且移植后更快植活,成為成人首選,但其較高的適應性免疫細胞含量可能增加GvHD風險。
- 骨髓干細胞雖在兒童中使用更普遍(因G-CSF在兒童中應用受限且慢性GvHD風險更低),但在成人中占比已降至少數。
- 臍帶血干細胞因HSC產量低、重建速度慢,臨床應用最有限,通常需多個單位聯合移植。
造血干細胞治療疾病適應癥分布
HSCT的臨床試驗覆蓋廣泛疾病類型(圖5e),具體特點如下:
血液相關疾病(82.5%)
- 血液癌癥(53%):以異體HSCT為主(86.3%),探索新型預處理方案(如CRISPR-Cas9敲除CD33基因抵抗化療)。3.4%的試驗采用基因編輯HSCT(如抗HIV基因導入)。
- 遺傳性紅細胞疾病(33%):自體基因編輯HSCT占37%(如鐮刀型細胞病),通過單次干預實現終身治愈;其余多用異體HSCT以避免免疫并發癥。
- 免疫系統疾病(14%):80%采用自體HSCT(通過高劑量清髓實現免疫重置),20%嘗試異體HSCT聯合低強度預處理以建立混合嵌合體。
非血液相關疾病(17.5%)
- 實體腫瘤(37.5%):以自體HSCT為主(87.5%),目標為修復放化療損傷的骨髓/免疫系統。30%的腦癌試驗進入III期,探索HSCT歸巢腫瘤的機制(如靜脈注射后定向遷移)。
- 器官移植耐受(22%):92%為腎臟移植試驗,通過供體來源的HSCT重建受體免疫系統,減少終身免疫抑制劑需求。
- 代謝性疾病(20.3%):75%采用自體基因編輯HSCT(如溶酶體儲存病),主要使用慢病毒載體,CRISPR技術或成主流。
間充質干細胞(MSC)臨床試驗概況
在分析的346項臨床試驗中,MSC作為治療實體占比最大,但試驗階段分布呈現明顯早期主導特征:
- Ⅰ期(34.10%)、Ⅰ/Ⅱ期(27.46%)和Ⅱ期(21.10%)合計占82.66%,僅5.20%進入Ⅲ期(圖6a)。
- Ⅲ期試驗聚焦多領域:包括COVID-19(NCT05689008等)、骨關節炎(NCT05086939等)和心肌梗死(NCT01652209等)。此外,5項Ⅳ期試驗正在評估已上市產品(如Stempeucel?治療肢體缺血、Darvadstrocel治療肛周瘺)的長期效果。
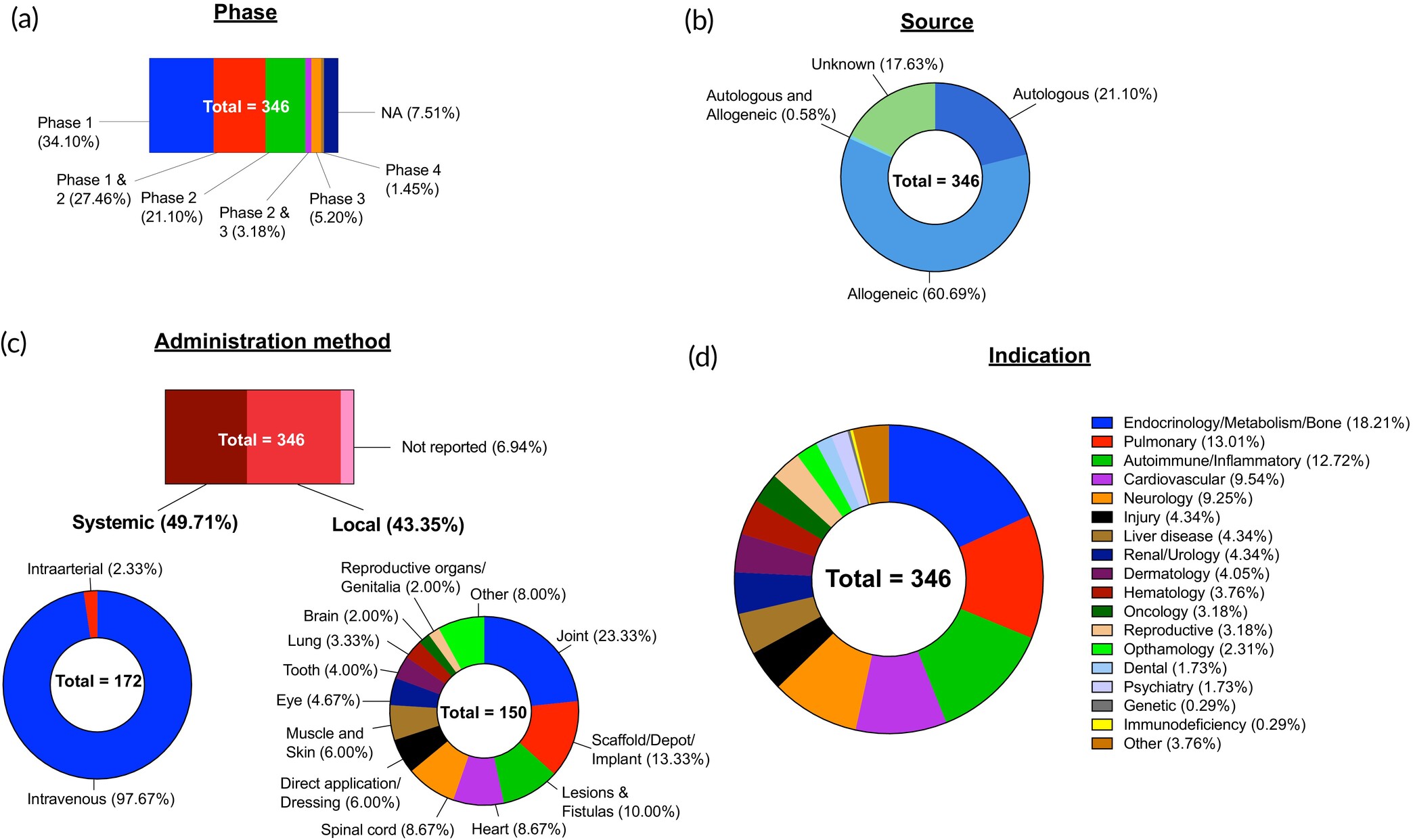
對346項MSC臨床試驗進行了分析,并根據以下標準進行了分類:(a) 試驗階段;(b) 細胞來源;(c) 給藥方法,進一步分為全身和局部途徑;(d) 適應癥類型。不適用 (NA)。
間充質干細胞來源
- 異體MSC占主導(60.96%),主要因其“免疫特權”假設(低免疫原性)和可即用性優勢;但近年研究發現其可能引發免疫排斥,挑戰了這一傳統認知。
- 自體與異體對比試驗(如NCT05086939、NCT05789719)將為臨床選擇提供依據。
間充質干細胞遞送方法
MSC遞送方式因疾病而異,局部與全身遞送各占約43%和49%:
1、全身遞送(靜脈/動脈注射):
- 常用于COVID-19、自身免疫病、神經系統及肝病,以抗炎和免疫調節為主。
- 靜脈注射安全性高,但存在非特異性分布問題。
2、局部遞送:
- 關節內注射(23.33%):針對骨關節炎,因軟骨低血管化需直接靶向。
- 鞘內注射(8.67%):治療ALS、腦癱及脊髓損傷。
- 心肌內/冠狀動脈注射(8.67%):修復心臟損傷,后者創傷更小但需專用設備。
- 肌肉注射(6%):通過緩釋作用延長細胞滯留,并通過分泌組產生系統性效應。
3、生物材料技術(13.33%局部試驗):
- 如透明質酸水凝膠(Cartistem?)聯合臍帶MSC修復軟骨、膠原支架(NeuroRegen?)促進脊髓損傷功能恢復,顯著提升療效。
間充質干細胞治療疾病適應癥分布
MSC的免疫調節與再生特性推動其廣泛應用于多領域(圖6d):
內分泌/代謝/骨骼疾病(18.21%):
- 糖尿病:靜脈輸注MSC可調節炎癥因子,減少胰島素依賴(Ⅰ型)或降糖(Ⅱ型)。
- 骨關節炎:關節內注射MSC促進軟骨再生,改善關節功能。
自身免疫/炎癥疾病(12.72%):
- COVID-19 ARDS:8項試驗顯示MSC通過抑制過度免疫反應降低死亡率。
- GvHD:利用MSC免疫調節特性輔助HSCT治療。
心血管疾病(9.54%):
- 心肌梗死患者經MSC治療可提高左心室射血分數。
呼吸系統疾病(13.01%):涵蓋COPD、肺纖維化等。
其他新興領域:
- 生殖功能障礙、干眼癥、遺傳性疾病(如亨廷頓病)等均開展探索。
關于間充質干細胞的核心結論
- 階段分布特征:MSC臨床試驗高度集中于早期階段,成熟療法有限,需加速Ⅲ期驗證。
- 來源爭議:異體MSC雖占主流,但自體與異體的優劣需通過頭對頭試驗明確。
- 遞送優化:局部遞送結合生物材料技術可提升靶向性,全身遞送則需解決非特異性分布問題。
- 適應癥擴展:從傳統血液/免疫疾病拓展至代謝、神經退行性疾病及腫瘤輔助治療,展現廣泛應用潛力。
- 基因編輯滯后:當前僅1項試驗探索基因工程MSC(TRAIL ligand修飾治療肺癌),技術成熟度不足。
未來需通過技術創新(如CRISPR編輯、智能遞送系統)和大規模臨床驗證,推動MSC向精準治療轉化。
其他干細胞臨床試驗
在分析的臨床試驗中,113項(14.13%)涉及非HSC或MSC的其他干細胞類型,包括未純化的骨髓濃縮物、脂肪組織細胞、臍帶血,以及特定譜系的干細胞(如神經干細胞、視網膜干細胞、角膜緣干細胞、心臟干細胞和誘導多能干細胞[iPSC]衍生細胞)(圖7)。
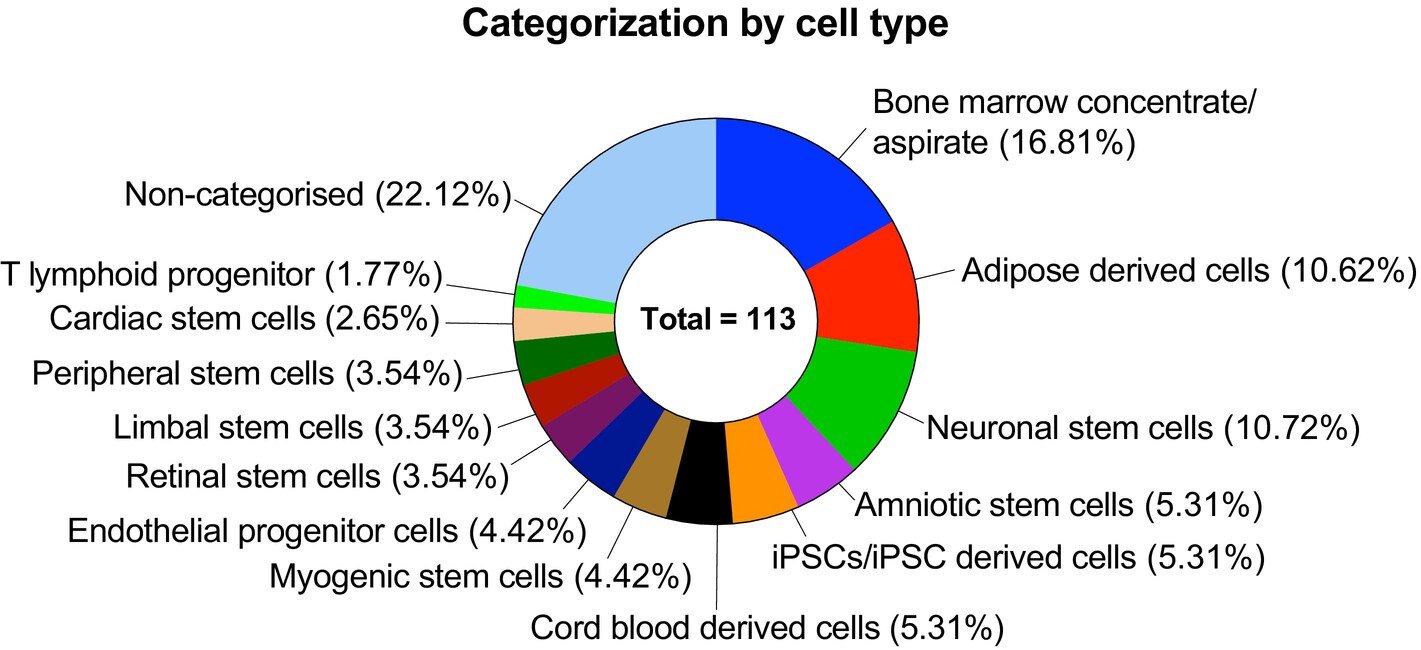
其中僅47項為特異性干細胞試驗,主要原因如下:
- 分化潛力與功能多樣性有限(相較于HSC和MSC);
- 來源與規模化制備難度較高(需達到治療劑量)。
主要研究方向與案例
眼科疾病(因易于操作、免疫特權環境和所需細胞量少成為重點):
- 角膜緣干細胞(4項):用于治療角膜緣干細胞缺乏癥(如NCT03957954);
- 視網膜干細胞(4項):探索黃斑變性治療(如NCT05187104)。
中樞神經系統修復(12項):
- 神經干細胞通過旁分泌和再生機制修復損傷(如NCT03684122)。
心臟疾病(3項):
- 心臟干細胞或iPSC衍生心肌細胞通過旁分泌和再生機制治療心臟病(如NCT03406884)。
- 內皮祖細胞(5項):因強效的血管生成能力被用于心肌梗死(如NCT00936819)和肝硬化(如NCT03109236)治療。
其他領域:
- 局部遞送(約65%)為主流,例如心臟(冠狀動脈/心肌內注射)和腦部(顱內注射);
- 系統性遞送多用于未純化的粗提物(如骨髓濃縮物、脂肪組織)。
試驗階段與典型案例
多數試驗處于早期階段(Ⅰ/Ⅱ期),少數進入Ⅲ期(如NCT02781922:冠狀動脈注射心臟干細胞治療左心發育不全)。
創新案例:角膜緣干細胞通過局部移植修復角膜(NCT03957954);iPSC衍生細胞用于心肌再生(NCT03406884)。
干細胞治療臨床轉化的五大挑戰
盡管在臨床前和臨床領域都取得了重大進展,但在干細胞療法全面應用于臨床之前,仍有幾個重大挑戰需要解決。一些關鍵考慮因素包括:
- 確定可行的干細胞來源,
- 解決安全性和免疫原性問題,
- 管理功能異質性,
- 確保移植后的生物活性和活力,以及?
- 優化靶向遞送和遷移能力(圖8)。
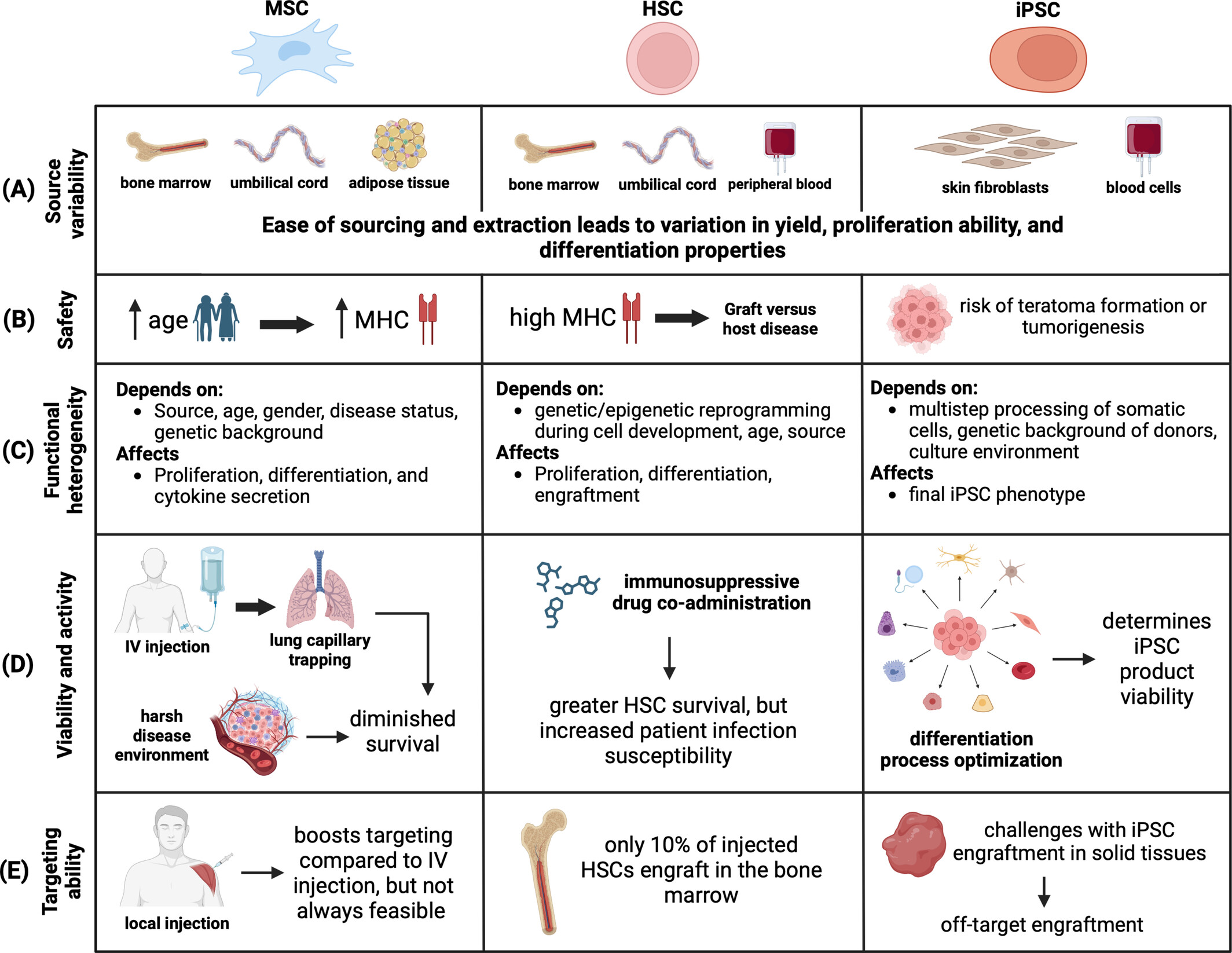
對于MSC、HSC和iPSC細胞類型,已識別并根據以下方面對各種挑戰進行了分類:(a) 來源多變性;(b) 安全性;(c) 功能異質性;(d) 活力和活性;以及 (e) 靶向能力。
本節主要討論這些挑戰,因為它們與廣泛使用的干細胞(如MSC和HSC)有關,同時也研究了與iPSC相關的具體問題,iPSC正成為一種有前途的新型干細胞療法。
干細胞療法盡管挑戰存在,未來仍充滿希望
干細胞作為生命系統中具內在自我更新與多向分化潛能的細胞群體,其治療價值已突破傳統醫學范式。全球范圍內,基于干細胞的創新療法已在血液系統疾病、遺傳缺陷修復及退行性疾病領域取得突破性進展,數十項產品獲得監管機構批準,臨床療效顯著。
隨著對干細胞功能機制的深入解析,研究者正著力拓展其應用邊界至腫瘤免疫治療、器官再生及代謝疾病干預等新興領域,充分體現這一領域的多元化發展趨勢。
盡管前路荊棘,干細胞療法在臨床實踐中的持續突破——如CAR-T細胞治療血液腫瘤的革命性成功、iPSC衍生視網膜組織修復黃斑病變的突破性進展——已充分印證其作為下一代醫學核心工具的巨大潛力。隨著生物技術與工程技術的深度融合,這一領域有望在未來十年迎來爆發式增長,重塑人類疾病治療范式。
參考資料:Ekrani ST, Mahmoudi M, Haghmorad D, et al. Manipulated mesenchymal stem cell therapy in the treatment of Parkinson’s disease. Stem Cell Research & Therapy. 2024 Dec;15(1):476. DOI: 10.1186/s13287-024-04073-9. PMID: 39696636; PMCID: PMC11657756.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信