骨關節炎 (OA) 是一種主要影響老年人的退行性關節疾病,其特征是軟骨退化、滑膜炎和骨贅形成。盡管OA發病率很高,但目前尚無有效的治療方法能夠逆轉關節軟骨退化,導致許多患者不得不接受關節置換術等侵入性手術。間充質干細胞 (MSC),尤其是源自脂肪組織的MSC,因其能夠分化為軟骨細胞并可能再生軟骨,已成為一種頗具前景的治療方法。雖然骨髓和臍帶來源的MSC已被證實可有效治療OA,但脂肪來源的 MSC (ADMSC) 更易于獲取且更具成本效益。
干細胞治療膝骨關節炎療效如何?三盲試驗證實疼痛與軟骨改善,但功能改善未達預期
近日,知名期刊雜志“Stem Cell Research & Therapy”刊發了一篇“The role of adipose-derived stem cells in knee osteoarthritis treatment: insights from a triple-blind clinical study”(脂肪源性干細胞在膝關節骨關節炎治療中的作用:一項三盲臨床研究的啟示)[1]。

最終,臨床研究結果表明同種異體脂肪間充質干細胞在減輕20名膝關節OA患者疼痛(基于VAS評分)和增加軟骨厚度方面安全有效。然而,與安慰劑相比,它們并未顯著改善生活質量或日常活動能力。需要進一步開展更大樣本量和更長隨訪期的研究來證實這些發現并確定最佳給藥策略。
骨關節炎的流行病學與病理特征
隨著人口老齡化和預期壽命延長,骨關節炎(OA)作為與年齡高度相關的退行性關節疾病,已成為全球重大公共衛生挑戰。其病理特征包括關節軟骨退化、軟骨下骨硬化及滑膜炎癥,可引發骨贅形成、滑膜炎及髕下脂肪墊纖維化等形態學改變,主要累及機械應力集中的負重關節(如膝關節),并伴隨神經性疼痛、抑郁和睡眠障礙,顯著加重社會疾病負擔。
骨關節炎的治療困境與探索方向
目前OA尚無逆轉軟骨退化的有效療法,傳統治療以緩解癥狀為主,終末期患者常需接受創傷性關節置換術。盡管自體軟骨細胞移植可修復軟骨缺損,但其依賴侵入性手術獲取細胞且再生能力有限,推動研究者轉向微創再生醫學策略。近十年間,基于間充質干細胞(MSC)的組織工程技術興起,通過其多向分化潛能(成骨、成脂、成軟骨),為全層軟骨再生提供了新方向。
干細胞治療骨關節炎的進展與局限
間充質干細胞可來源于骨髓、脂肪等組織,其中脂肪來源間充質干細胞(ADMSC)因獲取便捷、成本低而備受關注。既往研究表明,自體或同種異體ADMSC移植可改善輕中度OA患者癥狀,本團隊亦通過胎盤MSC研究驗證其療效。然而,ADMSC臨床應用仍面臨證據不足的挑戰,尤其是同種異體移植的安全性與長期效果需進一步驗證。
開展干細胞治療骨關節炎的研究目標與臨床意義
基于上述背景,本研究聚焦同種異體ADMSC治療膝關節OA的有效性與安全性評估,旨在解決傳統療法侵入性高、再生效率低的核心痛點,同時填補ADMSC臨床證據空白,為開發低成本、易推廣的OA再生治療方案提供科學依據。研究人群為2015年就診于物理醫學與康復診所的OA患者,重點關注ADMSC對疼痛緩解、功能恢復及關節結構修復的短期與長期影響。
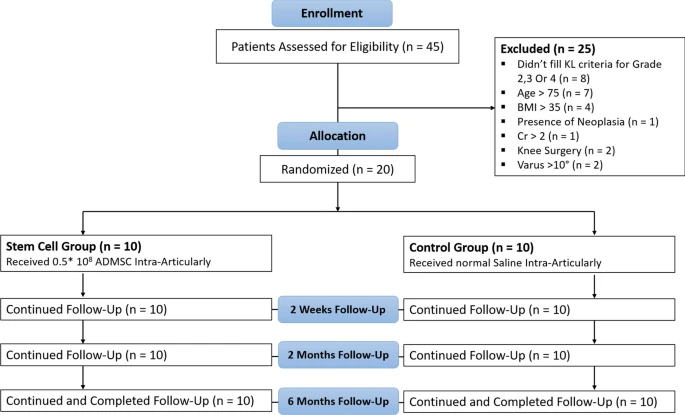
方法:這項三盲介入性臨床試驗納入了20例符合美國風濕病學會 (ACR) 標準的特發性膝關節骨關節炎 (OA) 患者。患者被隨機分配接受關節內注射0.5×108個同種異體ADMSC或生理鹽水(對照組)。
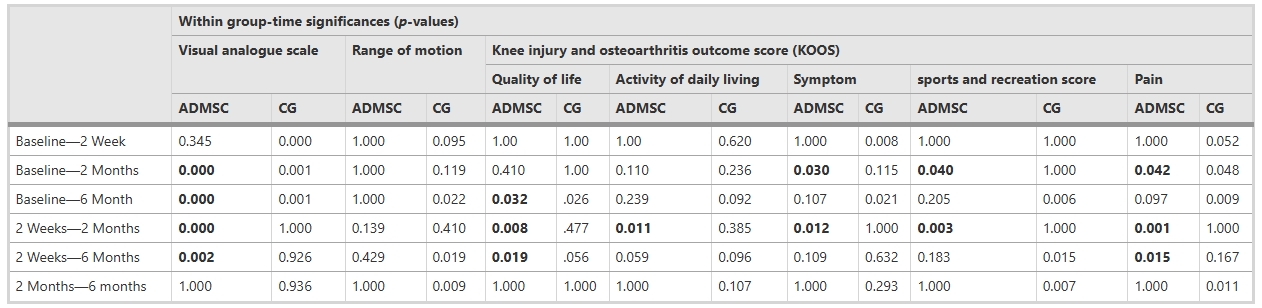
研究人員在基線以及注射后2周、2個月和6個月評估了參與者的炎癥臨床體征,并使用臨床評估方法,包括視覺模擬評分法 (VAS)、膝關節損傷和骨關節炎結果評分 (KOOS)、關節活動度 (ROM) 和磁共振關節造影 (MRA)(圖1)。
一項三盲試驗論證脂肪干細胞治療膝骨關節炎的臨床結果
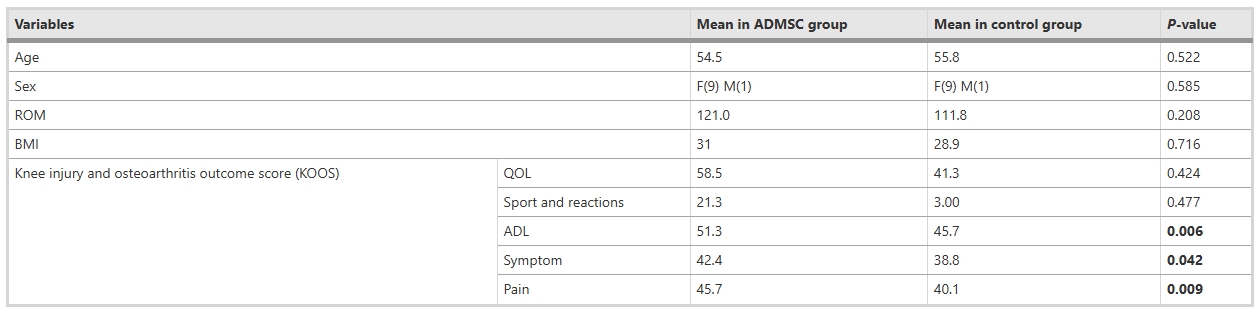
共20例患者納入本研究并全部完成。由于樣本量較小,采用Fisher精確概率法比較兩組間的性別分布,結果顯示兩組間無顯著差異(p值=0.585)。此外,兩組受試者的年齡和體質指數(BMI)也較為相似(p值>0.05,p值分別為0.52和0.71)。兩組間其他變量的比較情況見表1。
非放射學結果
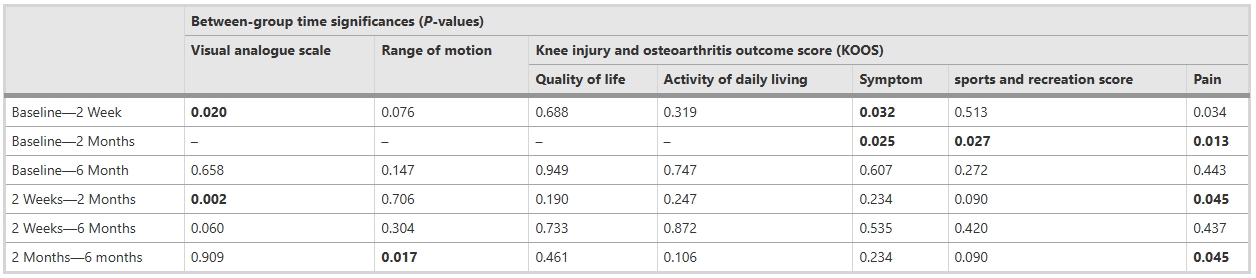
疼痛與關節活動度分析表明:疼痛得到改善:視覺模擬量表(VAS)評估顯示,基線時兩組疼痛評分存在顯著差異(協變量校正后),組別與時間的交互作用顯著。干細胞組中,首次隨訪與第3、4次隨訪間疼痛顯著改善,而安慰劑組僅在所有隨訪與基線間存在差異。運動范圍(ROM)的組別-時間交互作用不顯著,干細胞組在注射前后均未觀察到ROM顯著變化。
KOOS生活質量與日常功能得到顯著改善:KOOS生活質量(QOL)評分中,組別-時間交互作用無統計學意義,兩組行為趨勢一致。日常生活能力(ADL)和癥狀評分因基線差異進行協變量調整后,交互作用仍不顯著;但干細胞組內ADL在2周與2個月隨訪間(*p*=0.011),癥狀在基線與2個月、2周與2個月間出現顯著改善。
運動功能與疼痛改善特征:娛樂/體育活動評分交互作用不顯著,但干細胞組在基線與2個月、2周與2個月間改善顯著。疼痛評分組間差異無統計學意義,而干細胞組內基線與8周、2周與6個月隨訪間疼痛顯著緩解。
結果總結與數據關聯:綜合非放射學指標,干細胞治療在疼痛緩解和運動功能恢復上呈現時間依賴性改善,但關節活動度(ROM)和ADL等核心功能未顯著提升。上述結果提示干細胞干預可能優先作用于疼痛調控而非結構修復,具體數據詳見表2-4。需結合影像學與長期隨訪進一步驗證療效持續性。

放射學結果
關鍵區域軟骨厚度得到改善:放射學評估顯示,組別與時間的交互作用對軟骨厚度的影響在SLP(max)、LFF(max)及LCN(max)區域顯著,表明ADMSC治療6個月后,上述高負荷區域軟骨厚度呈現特異性改善,但其余測量部位未達統計學差異。進一步分析發現,ADMSC組在24周隨訪時,28個測量位點中有10個(如MLP(max)、TCL(max)、MCN(max)等)軟骨厚度顯著增加(表5),提示治療對局部生物力學敏感區域更具修復潛力。
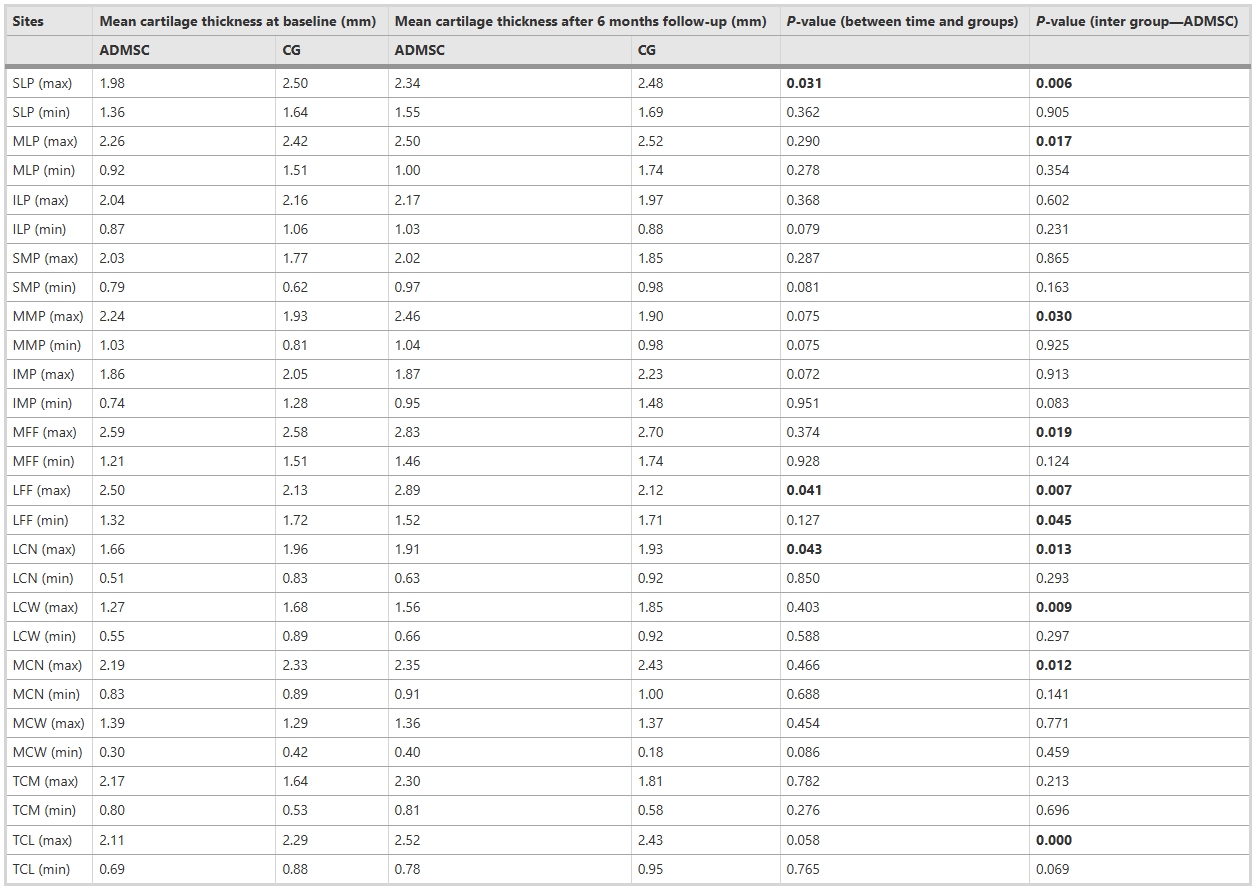
療效特征與機制推測:顯著增厚的軟骨區域集中于關節最大接觸壓力位點(如LCW(max)、MFF(max)),可能與ADMSC的力學響應性分化或抗炎-修復協同機制相關。然而,非負荷區(如LFF(min))及部分功能位點(MMP(max))的改善差異,提示療效受局部微環境影響。這些結果印證了ADMSC療法的空間選擇性修復特征,為優化靶向遞送策略提供依據(詳見表5數據)。
不良反應
在任何研究參與者中,干細胞注射后及隨訪期間均未觀察到嚴重不良反應。
脂肪間充質干細胞治療骨關節炎的結果討論
脂肪間充質干細胞治療骨關節炎的核心療效與功能局限性
本研究表明,同種異體ADMSC治療可顯著緩解膝關節OA患者疼痛,干預組6個月后VAS評分下降(組間交互作用),但關節活動度(ROM)改善未優于安慰劑。生活質量(QOL)、日常活動能力(ADL)及癥狀評分在組間無顯著差異,提示干細胞療法對疼痛調控的優先級高于功能恢復。值得注意的是,ADMSC組內隨訪間隔分析顯示ADL(2周vs2月)、癥狀(基線vs2月)及體育活動(基線vs2月)等指標顯著改善,與既往MSC研究結論一致,表明其臨床獲益需通過精細化時間窗評估。
本研究結果表明,基于視覺模擬評分 (VAS),與對照組相比,該治療干預措施對減輕患者疼痛具有顯著影響。ADMSC組患者的VAS評分在六個月后有所下降。在關節活動度 (ROM) 評估中,兩組在特定時間間隔內觀察到的變化并無顯著差異。這表明干細胞在改善患者ROM方面的作用并不優于安慰劑。此外,生活質量 (QOL)、日常生活活動能力 (ADL)、癥狀評分以及體育和娛樂活動平均評分的結果表明,兩組之間沒有顯著差異。
脂肪間充質干細胞治療骨關節炎的安慰劑效應與機制探討
對照組在KOOS多個維度(如疼痛、ADL)的隨訪期改善揭示了膝關節OA干預中顯著的安慰劑效應,其機制可能與患者心理預期或治療環境干預相關,尚需神經影像或生物標志物研究進一步解析。ADMSC組雖未在功能評分上全面超越對照組,但其定向改善特征(如疼痛時間依賴性緩解、局部軟骨增厚)提示干細胞可能通過旁分泌抗炎或力學微環境調節發揮修復作用。未來需結合長期隨訪與多模態評估,明確ADMSC療效的生物學靶點及最佳干預時機。
MSCs是一種多功能細胞,存在于骨髓、骨膜、骨小梁、脂肪墊組織、滑膜等各種組織中。它們能顯著刺激軟骨細胞生長并將其轉化為軟骨,因此對組織再生極為有價值。治療用MSCs的主要來源是骨髓和脂肪組織。值得注意的是,來自不同組織的MSCs均可分化為軟骨。此外,值得注意的是,MSCs中主要組織相容性復合體 (MHC) 蛋白和T細胞共刺激分子的下調,使這些細胞能夠安全有效地進行全身和局部治療,而不會產生嚴重的免疫反應。
MSCs對OA關節修復的主要作用是通過旁分泌信號刺激局部微環境。MSCs已證明能夠通過其旁分泌信號促進組織再生。然而,這些過程的確切機制目前仍在研究中。此外,如何有效地確定MSCs的最佳劑量以有效治療膝關節OA也是目前正在研究的課題。關于增強OA癥狀所需的最佳干細胞數量仍存在爭議。
脂肪間充質干細胞治療骨關節炎的優勢和局限性
研究優勢與創新性:本研究作為少數聚焦異基因脂肪間充質干細胞(ADMSC)治療膝關節骨關節炎(OA)的臨床試驗,其核心優勢在于采用多維評估體系,整合臨床指標(如關節活動度)、患者報告結果(KOOS問卷、VAS評分)及磁共振血管造影(MRA)軟骨厚度定量分析,全面解析療效機制。嚴格的受試者納入標準(年齡、BMI、OA分級)保障了樣本的臨床異質性及代表性,為ADMSC治療輕中度OA提供了高可信度的初步證據。
局限性與未來方向:研究受限于小樣本量(n=20)及短期隨訪(6個月),可能削弱統計效力并影響結論外推性。盡管采用固定細胞劑量,但ADMSC最佳治療濃度尚未明確,需通過劑量梯度研究平衡療效與安全性。此外,干預對其他膝關節結構(如滑膜、髕下脂肪墊)的影響未被評估,未來需結合長期隨訪、多組織生物標記物檢測及生物力學模擬,系統性揭示ADMSC的空間修復特性與作用閾值。
結論
同種異體ADMSC用于治療膝關節OA患者是安全的,可以改善疼痛(基于VAS評分)以及與疾病相關的放射學表現。然而,在改善生活質量、日常活動和體育活動方面,它們并不比安慰劑更有優勢。需要進一步研究將其納入膝關節OA患者的治療方案。
參考資料:[1]:Sajadi, S., Khadembashiri, M.A., Raissi, G.?et al.?The role of adipose-derived stem cells in knee osteoarthritis treatment: insights from a triple-blind clinical study.?Stem Cell Res Ther?16, 242 (2025). https://doi.org/10.1186/s13287-025-04233-5
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信