炎癥、神經遞質和神經元凋亡是重度抑郁癥 (MDD) 進展的關鍵因素。先前的研究表明,間充質干細胞 (MSC) 對神經炎癥和神經保護具有積極作用。
從基礎到臨床試驗:間充質干細胞能通過緩解神經炎癥改善慢性應激引起的抑郁和焦慮
近期,“Journal of Neuroimmune Pharmacology”發表了一篇“人臍帶間充質干細胞通過緩解神經炎癥改善慢性不可預測的輕度應激引起的抑郁和焦慮”的研究文章[1]。

初步的研究結果表明:MSCs可以緩解神經炎癥,抑制中樞神經系統小膠質細胞的活化,從而防止神經元凋亡。hUC-MSCs還可以提高5-HT、DA和BDNF的水平,從而有助于緩解抑郁和焦慮行為。
抑郁癥介紹
重度抑郁癥 (MDD) 是一種復雜且異質性的神經退行性疾病,其特征是情緒、精神運動和認知障礙。據估計,MDD影響全球超過3.5億人,每年有超過70萬人死于自殺,是全球致殘的主要原因。單胺類抗抑郁藥的缺陷,包括耐藥性和起效延遲,凸顯了開發新型抗抑郁藥物的迫切需求。

神經炎癥:解析抑郁癥病理機制的新維度與治療靶向策略
現有研究顯示,單胺類神經遞質(如5-HT和DA)在腦區獎賞預測功能中的特異性作用,但其抗抑郁療效延遲提示MDD存在其他機制。
近年發現神經炎癥在MDD病理中起關鍵作用,臨床證據顯示干擾素治療可誘發抑郁,MDD患者外周炎癥因子水平顯著升高,且炎癥水平與獎賞系統功能障礙程度相關。神經炎癥通過激活小膠質細胞破壞血腦屏障,形成炎癥增強-單胺合成受阻-神經營養信號受損的惡性循環,最終導致神經元功能異常。
神經炎癥機制不僅解釋了傳統單胺假說的局限性,更揭示了MDD的多維度病理特征。從外周炎癥因子水平異常到中樞神經炎癥級聯反應,從血腦屏障損傷到神經元功能障礙,這一系統性病理過程為MDD治療提供了新方向——靶向抑制神經炎癥可能成為改善抑郁癥狀的有效策略。
人臍帶間充質干細胞治療抑郁癥的生物分布、作用機制及臨床研究進展
間充質干細胞是一種多能干細胞,來源廣泛、具有自我更新和分化能力,免疫原性低,倫理問題較少。MSCs因其歸巢能力、免疫調節特性和旁分泌作用,具有治療神經退行性疾病的潛力。
大量臨床前研究表明,hUC-MSCs可以通過調節C3a-C3aR信號轉導來改變小膠質細胞極化,從而抑制海馬 (Hip) 中IL-1β和TNF-α的水平,改善慢性不可預測性溫和應激模型 (CUMS) 引起的抑郁癥。hUC-MSCs調節小膠質細胞活化以減少神經炎癥和修復神經結構,改善抑郁樣和焦慮樣行為。
本文章總結了人臍帶間充質干細胞 (hUC-MSC) 在CUMS小鼠模型中的療效和治療機制。目前很少有研究表明間充質干細胞 (MSC) 定位于重度抑郁癥 (MDD) 動物的腦部。因此,我們旨在評估hUC-MSC的生物分布,以闡明hUC-MSC參與治療MDD的機制。另外,闡述了近些年干細胞在治療抑郁癥方面的臨床研究進展。
方法:為此,我們將人臍帶間充質干細胞 (hUC-MSC) 注入慢性不可預測性輕度應激模型 (CUMS) 小鼠體內,以評估其對炎癥、神經遞質、小膠質細胞、神經元活化和神經元凋亡的影響。利用CM-Dil標記的hUC-MSC檢測hUC-MSC在腦內的分布。
人臍帶間充質干細胞治療抑郁癥大鼠模型的結果
hUC-MSCs改善CUMS誘發的抑郁和焦慮樣行為
實驗通過慢性應激(CUMS)小鼠模型評估人臍帶間充質干細胞(hUC-MSCs)的抗抑郁及抗焦慮效果。研究發現,hUC-MSCs能劑量依賴性地逆轉CUMS誘導的體重下降,其中最高劑量組(2×10?細胞/小鼠)效果最顯著,且優于傳統抗抑郁藥氟西汀(Flu)(圖1)。
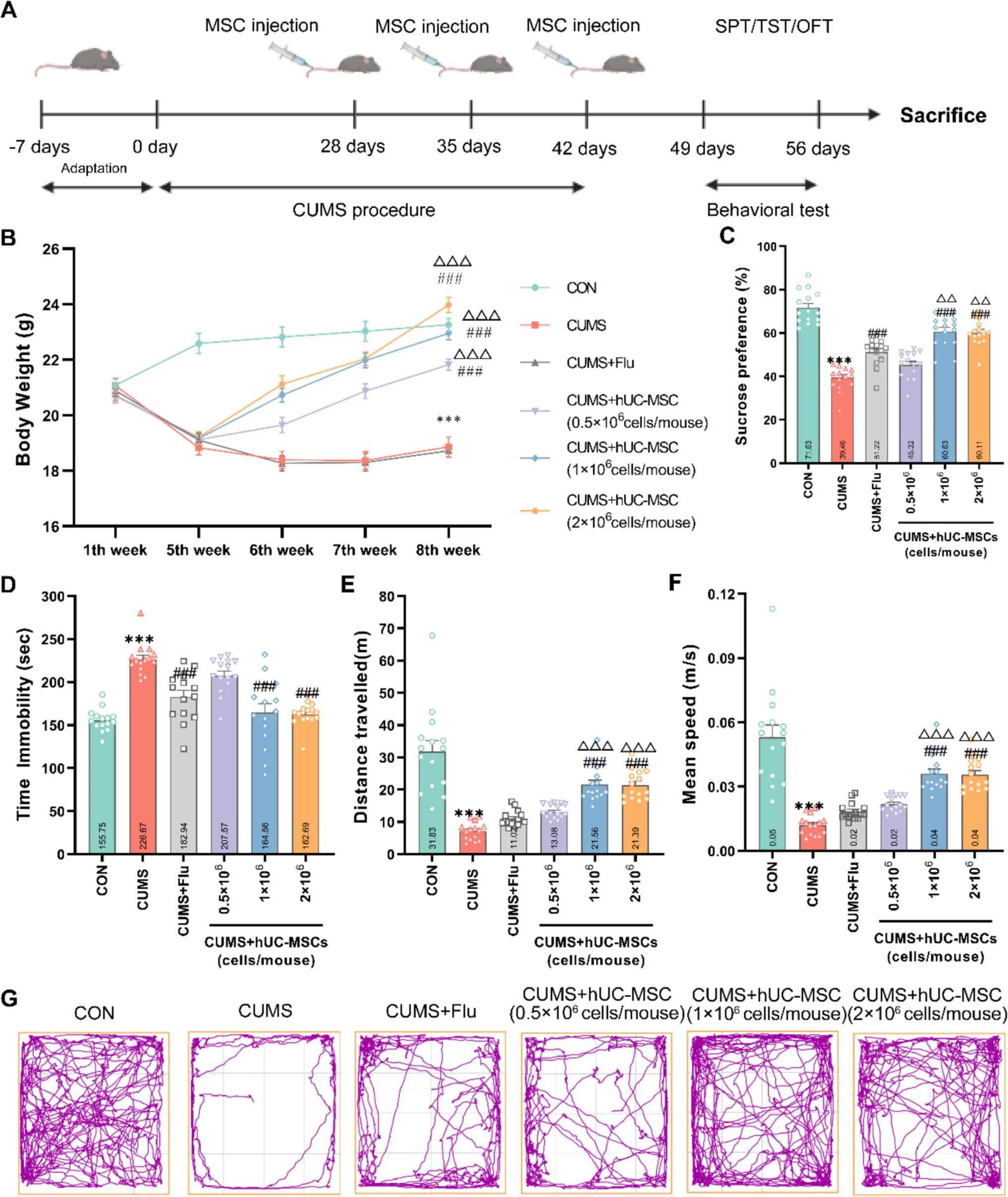
A實驗時間線示意圖。B實驗期間測量體重。C 測量了hUC-MSCs在蔗糖偏好測試 (SPT)、(?D?)懸尾測試 (TST)、(E) 距離、(F) 平均速度和 (G)開放場測試(OFT) 圖形表示中的效果。
在行為學測試中,hUC-MSCs顯著改善抑郁相關癥狀:糖水消耗測試顯示高劑量組快感缺失緩解優于Flu組;懸尾實驗表明其縮短不動時間的效果與Flu相當;開野實驗進一步揭示,hUC-MSCs(尤其是高劑量組)在提升運動活力和緩解焦慮方面顯著優于Flu,且效果與劑量正相關。
研究從多維度驗證hUC-MSCs對CUMS模型的行為改善作用,揭示了其劑量依賴性的治療特性。相較于Flu,hUC-MSCs不僅更有效恢復應激導致的生理指標異常(如體重),還在核心抑郁癥狀(快感缺失、行為絕望)和焦慮樣行為中表現出優勢。
這一發現提示,hUC-MSCs可能通過多重機制協同作用,為開發基于干細胞的抑郁癥治療策略提供了實驗依據,尤其強調劑量優化在臨床應用中的重要性。
hUC-MSCs減輕MDD小鼠的神經元損傷
本研究通過檢測CUMS抑郁模型小鼠多個腦區(海馬、前額葉皮層、基底外側杏仁核及中縫背核)的神經元凋亡標志物(TUNEL及Cleaved Caspase-3/NeuN),發現hUC-MSCs能顯著減少凋亡細胞數量,緩解神經元損傷(圖2)。
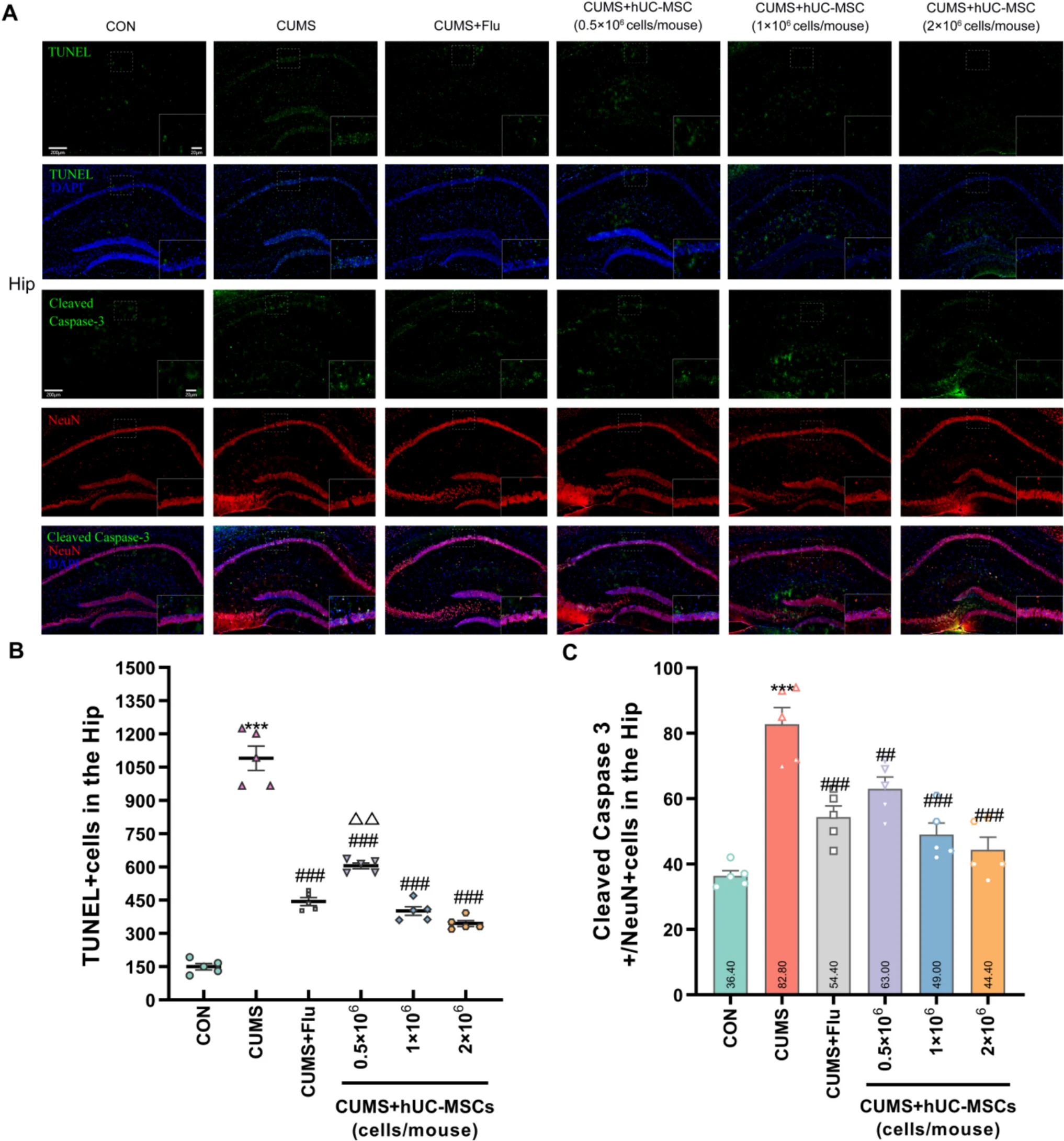
其中,高劑量hUC-MSCs(2×10?細胞/小鼠)在逆轉海馬、前額葉皮層和杏仁核損傷方面效果最優,且部分腦區(如中縫背核)的治療效果顯著優于傳統藥物氟西汀。
實驗證實,hUC-MSCs的神經保護作用具有劑量依賴性,其通過抑制神經元凋亡通路,為抑郁癥的細胞治療提供了重要證據。
hUC-MSCs修復CUMS小鼠神經元活動異常
即刻早期基因c-Fos表達是神經科學中表征腦功能活動的標志物。抑郁癥(MDD)小鼠腦區c-Fos表達升高提示神經元活動異常激活。
本研究通過檢測神經元活動標志物c-Fos表達,發現hUC-MSCs能有效逆轉CUMS小鼠海馬、前額葉皮層、中縫背核及基底外側杏仁核的神經元活動異常(圖3)。高劑量hUC-MSCs(2×10?細胞/小鼠)在降低c-Fos表達方面顯著優于傳統抗抑郁藥氟西汀(除前額葉皮層外),提示其通過調控多腦區神經元功能亢進發揮治療作用。

實驗證實,hUC-MSCs通過修復神經元活動異常改善抑郁表型,進一步闡明其抗抑郁機制與神經元功能穩態調節密切相關。
hUC-MSCs調節CUMS小鼠的神經遞質和腦源性神經營養因子 (BDNF) 水平
本研究揭示了hUC-MSCs對CUMS小鼠神經遞質系統的調節作用。CUMS模型導致海馬、前額葉皮層等腦區及血清中5-HT和DA水平顯著下降,而hUC-MSCs治療(尤其是1×10?和2×10?細胞/小鼠劑量組)能劑量依賴性地逆轉這一趨勢,其效果在多數腦區優于傳統抗抑郁藥氟西汀(Flu)。
例如,在PFC中劑量hUC-MSCs組的DA水平提升顯著強于Flu組,表明hUC-MSCs可能通過更高效的神經遞質穩態重建發揮治療優勢(圖4)。

除神經遞質外,hUC-MSCs還顯著提升CUMS小鼠腦區及血清中的BDNF水平,但其效果與Flu組無顯著差異,提示BDNF上調可能是hUC-MSCs與Flu共有的抗抑郁機制之一。
綜合神經遞質與BDNF的協同調控作用,hUC-MSCs通過多靶點修復突觸可塑性障礙,為解釋其抗抑郁療效提供了分子層面的證據。研究進一步支持hUC-MSCs作為抑郁癥細胞療法的潛力,并強調劑量優化對其臨床轉化的重要性。
hUC-MSCs調控中樞神經系統炎癥水平并抑制小膠質細胞激活
研究證實,CUMS小鼠腦區及外周炎癥因子(IL-6、IL-1β、TNF-α)水平顯著升高,而hUC-MSCs治療可劑量依賴性地抑制炎癥反應,其中高劑量組(2×10?細胞/小鼠)效果與氟西汀(Flu)相當。
值得注意的是,hUC-MSCs的抗炎作用在低、中劑量組即已顯現,且高劑量組對炎癥因子的調控未表現出與Flu的顯著差異(圖5),提示其抗炎效能接近或達到傳統藥物水平。

進一步分析小膠質細胞激活狀態發現,hUC-MSCs顯著抑制CUMS誘導的Hip和PFC中IBA1+細胞數量增加,且高劑量組效果顯著優于Flu組,凸顯其獨特的神經免疫調節優勢。
機制上,hUC-MSCs通過雙重路徑——降低促炎細胞因子水平與抑制小膠質細胞過度激活——協同減輕神經炎癥,為解釋其抗抑郁作用提供了免疫微環境層面的證據。研究強調,hUC-MSCs的劑量依賴性效應為其臨床應用的精準化治療策略提供了重要依據。
hUC-MSCs穿透血腦屏障并改善CUMS小鼠BBB通透性
研究證實,CUMS小鼠BBB通透性顯著增加(表現為EB外滲增多),而hUC-MSCs治療可有效減少EB滲漏,其效果優于傳統藥物氟西汀(Flu)(圖6)。通過熒光標記技術進一步發現,hUC-MSCs能夠穿過受損BBB并定位于海馬、前額葉皮層等關鍵腦區,提示其具有直接作用于中樞神經系統的能力。
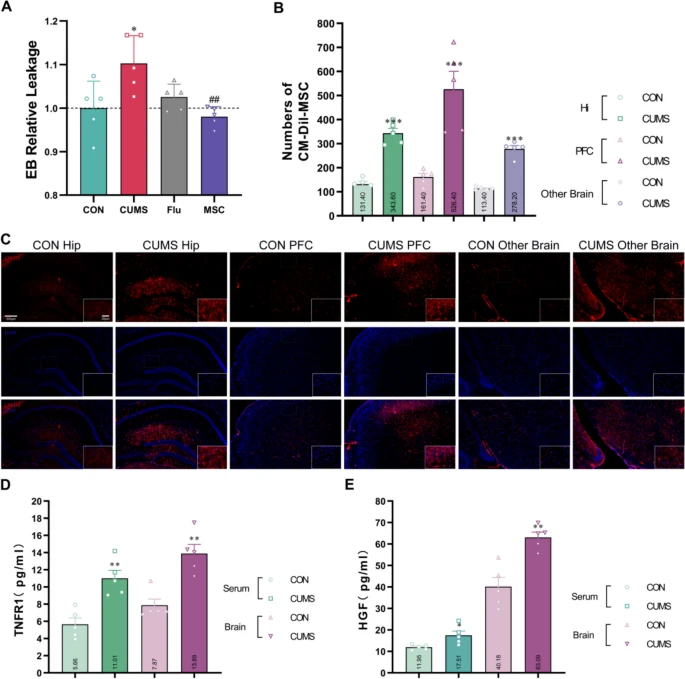
機制研究表明,hUC-MSCs通過分泌sTNFR1(抑制炎癥信號)和HGF(促進血管修復)雙重途徑修復BBB結構完整性。這一發現不僅解釋了hUC-MSCs降低BBB通透性的分子基礎,還揭示了其通過調控神經血管單元功能實現抗抑郁作用的潛在機制,為基于干細胞的BBB靶向治療策略提供了新依據。
討論:研究表明,炎性細胞因子在神經細胞信號通路和神經內分泌系統功能中發揮著關鍵作用。我們的研究結果表明,hUC-MSC能夠穿透CUMS小鼠的大腦,同時保持血腦屏障 (BBB) 的完整性。此外,我們的研究還揭示,hUC-MSC能夠抑制小膠質細胞活化,從而減少神經炎癥并增加神經遞質,這有助于減少神經元凋亡并維持正常的神經元活動。
因此,hUC-MSC能夠有效改善CUMS引起的抑郁癥。我們的研究為hUC-MSC治療重度抑郁癥 (MDD) 的機制提供了新的見解,并支持其作為一種可行且有前景的 MDD 治療策略的潛力。
除此之外,近些年干細胞治療抑郁癥的臨床研究進展有哪些?
2016年,“實驗生物學和醫學公報”報道了一項“臍帶血細胞對難治性抑郁癥患者的療效”的臨床研究結果。

初步表明:科研人員(我們)研究了臍帶血細胞在女性難治性抑郁狀態治療中的療效。我們注射了2.5億個濃縮臍帶血細胞(注射4次,間隔1周)。對照組接受安慰劑。兩組患者均觀察到抑郁癥狀減少,低心境障礙嚴重程度降低。輸注細胞濃縮物有助于延遲治療耐藥性的糾正,并將抑郁癥嚴重程度降至中度。
在主要組中,我們在認知領域觀察到了顯著、持久且長期的積極動態。臍帶血細胞濃縮物的治療潛力可用于克服抑郁癥患者形成的治療耐藥性。
目前,我已經在Clintrial.gov平臺上找到了三項干細胞治療抑郁癥的臨床試驗,旨在評估干細胞和外泌體用于治療抑郁癥的安全性、有效性和耐受性。
第一項:2019年,澳大利亞國立大學進行了一項異基因人類間充質干細胞(hMSCs)輸注治療難治性抑郁癥患者的臨床試驗。

ClinicalTrials.gov ID:NCT02675556
研究的目的:旨在評估異基因人類間充質干細胞輸注與安慰劑相比對難治性抑郁癥患者的安全性和潛在療效。
目前臨床試驗最新動態:截止2025年5月,ClinicalTrials.gov顯示臨床終止。主要原因為招募和籌資困難。
第二項:2024年,美國德克薩斯大學休斯頓健康科學中心開展了一項輔助性異基因間充質干細胞治療難治性雙相抑郁的臨床研究。

ClinicalTrials.gov ID:NCT03522545
研究的目的:研究人員的總體目標是評估從血源性骨髓分離的同種異體骨髓衍生的多能間充質基質細胞 (MSC) 對治療難治性雙相抑郁癥患者 (TRBD) 的治療效果和耐受性。
目前臨床試驗最新動態:招募臨床患者當中。
第三項:2025年,美國德克薩斯大學里奧格蘭德河谷分校進行了一項同種異體人間充質干細胞輸注與安慰劑在酒精使用障礙和重度抑郁癥中的療效對比的臨床研究。

ClinicalTrials.gov ID:NCT03265808
研究目的:本研究的目的是考察干細胞治療酒精使用障礙和重度抑郁癥 (AUD-MD) 患者的安全性。
目前臨床試驗最新動態:正在進行中,但是未發布相關結果,不招募患者。
寫在最后:干細胞治療抑郁癥憑借其多靶點調控優勢(抗炎、神經再生、BBB修復),為難治性患者提供了突破傳統單胺假說的新希望。
盡管臨床轉化仍面臨安全性驗證、標準化生產及機制解析等挑戰,隨著技術革新與跨學科協作,干細胞療法有望在未來十年內成為抑郁癥治療的重要支柱。
正如項鵬教授所言:“從肺-腦軸到代謝微環境,干細胞研究的每一次突破都在重塑我們對抑郁癥復雜病理的認知,并為治愈帶來更多可能。”
未來的研究需在嚴謹的臨床驗證與機制探索中穩步推進,最終將這一“生命工程師”的潛力轉化為患者切實的福音。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。
文章來源:[1]:Liu, G., Miao, L., Niu, H.?et al.?Human Umbilical Cord Mesenchymal Stem Cells Ameliorated Chronic Unpredictable Mild Stress-Induced Depression and Anxiety by Alleviating Neuroinflammation.?J Neuroimmune Pharmacol?20, 45 (2025). https://doi.org/10.1007/s11481-025-10198-2



 掃碼添加微信
掃碼添加微信