間充質干細胞/基質細胞 (MSC) 因其多能性、免疫調節特性和促進組織修復的能力,已成為再生醫學領域極具前景的治療藥物。近期研究表明,MSC 的治療作用主要由其旁分泌釋放細胞外囊泡 (EV) 介導,其中包括外泌體,這是一種促進細胞間通訊的膜結合小顆粒。MSC衍生的EV (MSC-EV) 富含蛋白質、RNA和脂質,可以調節受損組織的微環境,增強細胞遷移、增殖和分化等再生過程。本章重點介紹MSC-EV及其治療潛力。
解碼間充質干細胞外囊泡:從生物發生機制到臨床轉化全景
文中涵蓋了各種EV分離方法,并探討了EV的儲存、表征和臨床應用,表明它們提供了一種比傳統細胞療法更安全、更具可擴展性的替代方案。然而,將MSC-EV的生產、分離和表征標準化以供臨床使用仍然具有挑戰性。未來的研究應側重于優化流程、了解MSC-EVs藥代動力學以及針對最大治療潛力的機制[1]。

1、簡介
間充質干細胞治療潛力與機制認知演變
間充質干細胞(MSCs)因其多向分化潛能(可分化為成骨細胞、脂肪細胞和軟骨細胞)及自我更新能力,成為再生醫學領域的明星療法。傳統理論認為,移植的MSCs能歸巢至損傷部位,通過直接分化為目標細胞(如軟骨細胞)修復組織。但最新研究表明,MSCs主要通過旁分泌途徑釋放生長因子、趨化因子和細胞因子發揮治療作用,而非直接分化。盡管其修復機制尚未完全闡明,MSCs仍被廣泛用于免疫調節和組織再生臨床試驗。
間充質干細胞在臨床應用面臨的多重挑戰
MSC療法存在顯著局限性:供體差異(健康狀態、遺傳背景、年齡性別)導致細胞異質性;組織來源(骨髓、脂肪、臍帶等)影響干性及分化能力;培養條件(融合度、氧氣濃度、傳代次數)改變擴增效率;免疫相容性受宿主微環境(如炎癥狀態)調控,可能觸發MHC-II類分子表達。此外,給藥方式、移植位點及載體材料也制約細胞歸巢效能。
外泌體療法的突破性進展
新證據揭示MSCs通過分泌營養因子協調再生過程(細胞遷移、增殖、基質合成等)。2010年研究發現,MSCs衍生的外泌體(MSC-Exos)可緩解心肌缺血再灌注損傷,此后其在軟骨修復中展現潛力。目前臨床試驗主要采用脂肪、骨髓或臍帶來源的MSC-Exos,其中脂肪組織為臨床研究首選來源,且因外泌體低免疫原性,異體移植成為主流方案。但MSC-Exos尚無標準化制備流程。
細胞外囊泡的研究進展
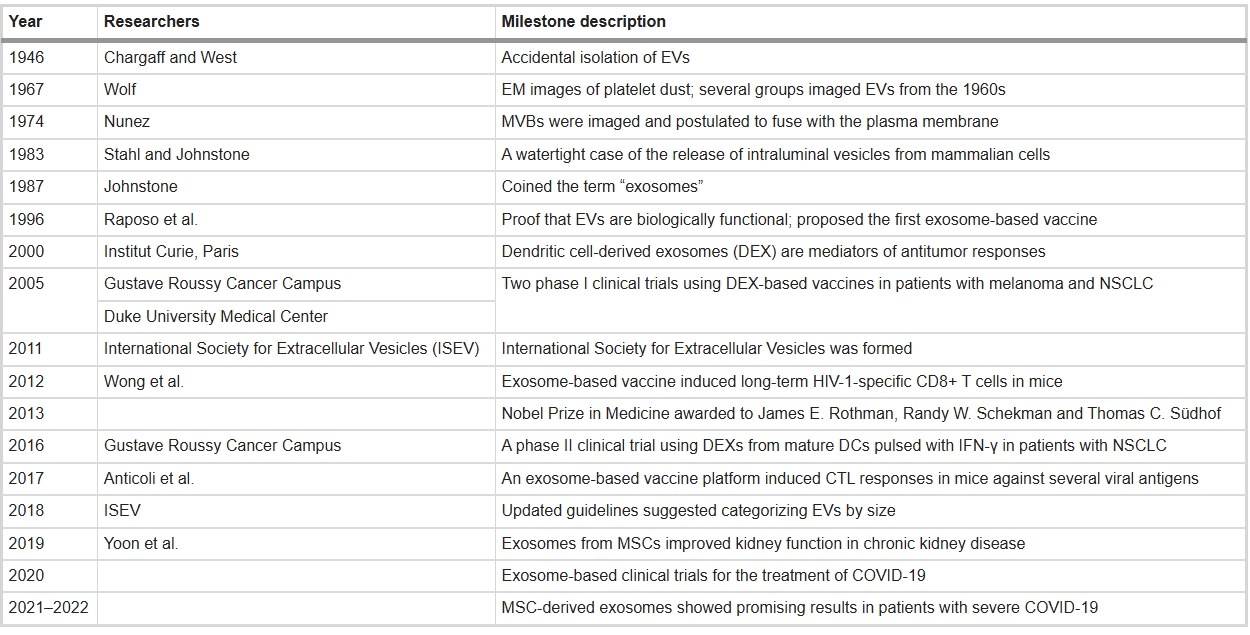
細胞外囊泡(EVs)是脂質雙分子層包裹的納米顆粒,攜帶跨膜蛋白、RNA及代謝物,介導細胞間通訊。自1946年首次在血液中被發現,EVs歷經數十年研究:1960年代稱”血小板塵埃”;1980年代在直腸腺瘤細胞中被觀測;1987年”外泌體”術語正式確立。77年來,學界確認幾乎所有細胞均分泌EVs,其廣泛存在于生物體液中,成為疾病診療的新靶點(表1)。
2、細胞外囊泡的分類
EVs的核心功能與生物意義
細胞外囊泡(EVs)是細胞間通訊的關鍵信使,負責傳遞包括蛋白質、核酸、代謝物甚至完整細胞器在內的多種“貨物”。它們在多種生物體的生理和病理條件下促進細胞間通訊的作用已被廣泛研究。所有細胞類型(包括干細胞)均可分泌EVs,并存在于唾液、淚液、血漿、血清、腦脊液、支氣管液、滑膜液、羊水、母乳、尿液、精液、淋巴液、膽汁和胃酸等體液中。
值得注意的是,EVs的分泌和成分可適應不同生物環境,因此成為多種疾病的重要生物標志物。此外,科學家已將EVs開發為藥物遞送載體,并將其作為獨立治療劑使用。
分類體系的演變與爭議
EVs是由各類細胞釋放到胞外空間的膜性納米顆粒,在細胞間通訊中發揮關鍵作用。它們攜帶獨特的“貨物”(包括核酸、蛋白質和信號分子),反映源細胞的狀態。國際細胞外囊泡學會(ISEV)2018年指南提出了分類系統,但傳統的三分類法仍普遍使用:根據尺寸、生物形成機制和表面標志物,EVs可分為外泌體、微囊泡(MVs)和凋亡小體(表2)。
- 外泌體(直徑30–150nm):通過多囊泡體(MVBs)與質膜融合形成;
- 微囊泡(直徑50–1000 nm):由質膜向外出芽并脫落產生;
- 凋亡小體(直徑50–5000 nm):細胞凋亡過程中產生。
由于三分類法中存在表面標志物不明確和尺寸重疊的問題,ISEV建議采用修訂方案:按物理特性(如<200 nm為小型EVs,>200 nm為大型EVs)、密度(低/中/高)、表面標志物(如CD63+或膜聯蛋白V染色的EVs)、細胞來源(如MSC衍生的EVs)或細胞狀態(如缺氧EVs)分類。
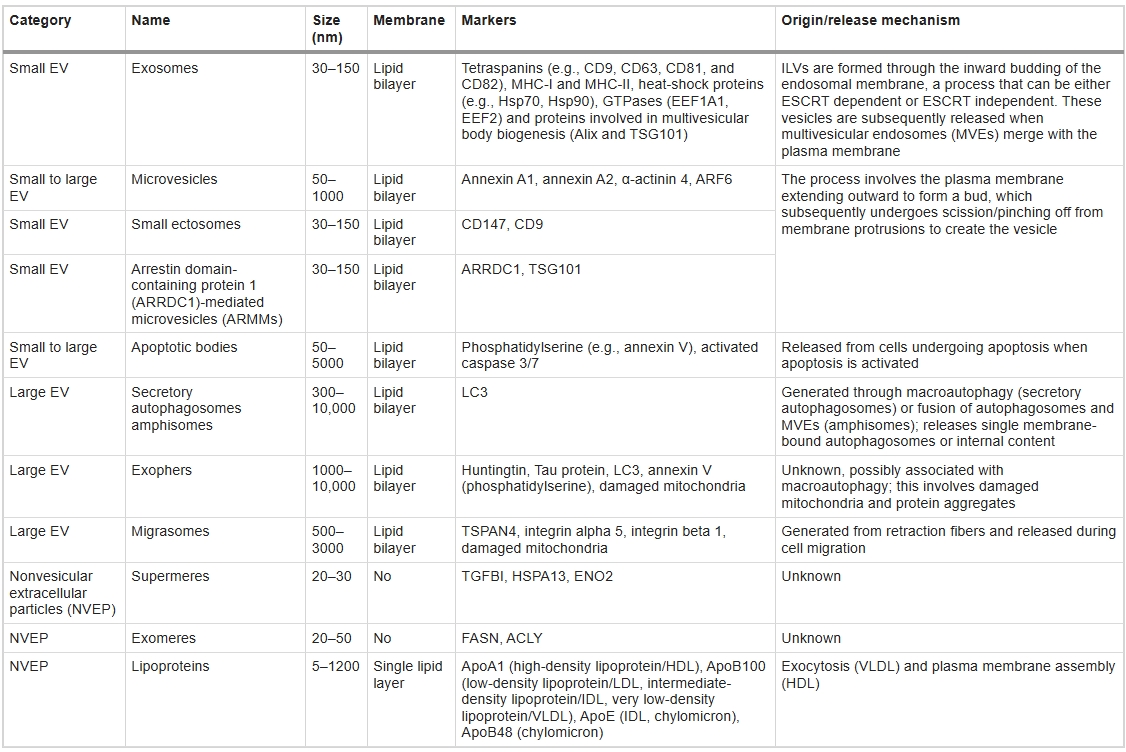
新型非囊泡顆粒的突破性發現
隨著分離技術進步,EV領域擴展到非囊泡細胞外顆粒(NVEPs)——這類無脂質雙層的顆粒包括脂蛋白、穹窿體,以及新發現的外泌聚合體(exomeres,~35nm)和超級聚合體(supermeres)。外泌聚合體含糖酵解酶等特定蛋白,可通過不對稱流場流分離技術(AF4)獲取;超級聚合體則在外泌聚合體上清液中發現,具有獨特蛋白/RNA組成,能穿越血腦屏障,在結直腸癌細胞中攜帶大量胞外RNA,并可介導代謝重編程與耐藥性傳遞,為疾病機制研究開辟新方向。
3、EV的生物合成和吸收
EVs的攝取機制
靶細胞通過受體介導內吞、網格蛋白包被小窩、脂筏、吞噬作用、小窩蛋白介導內吞及巨胞飲等多種途徑攝取完整EVs。囊泡進入靶細胞后可逃逸內體/溶酶體以釋放內容物。EVs與靶細胞膜相互作用可誘導兩種結果:一是通過配體-受體相互作用觸發細胞內信號傳導,二是外泌體直接與細胞膜融合,將內容物釋放至胞質。值得注意的是,EVs的靶細胞涵蓋癌細胞、損傷實質細胞及免疫細胞,凸顯其在細胞通訊與生理過程中的廣泛影響[23,33]。
外泌體的生物發生核心
外泌體在內體系統中形成:晚期內體膜向內出芽,在多泡內體(MVEs)內形成腔內囊泡(ILVs)。此過程重定位跨膜蛋白(胞外域朝外、胞質尾朝內)并封裝貨物。MVEs與細胞膜融合后,釋放30–150 nm的外泌體[27,33,35]。ESCRT復合物(運輸所需內體分選復合體)在ILVs分選及外泌體形成中起關鍵作用,同時參與細胞膜向外出芽釋放囊泡和病毒的過程[36]。
關鍵調控蛋白的作用
Syntenin 1與四跨膜蛋白(TSPANs,如CD9/CD63/CD81)共同調控外泌體形成與貨物裝載[27,37-39]。Syntenin 1雖主要富集于小型EVs,但也存在于大型EVs中;TSPANs雖是經典外泌體標志物,但最新研究發現含TSPAN的小型EVs可直接源自細胞膜(稱為胞外體或微囊泡)。其中CD63通過介導質膜與細胞器間的循環通路定向引導EV貨物分選。
RAB蛋白的精密調控
小G蛋白RAB家族(如RAB7/11/35/27A/27B)協調囊泡運輸與外泌體釋放:
- RAB7調控內質網(ER)-內體接觸位點,促進外泌體生成;
- RAB27A介導ARL8B向RAB27A的轉化,驅動ILVs向細胞膜運輸;
- RAB13負責釋放含β1-整合素的小EVs(區別于CD63+外泌體);
- RAB31參與ESCRT非依賴的外泌體形成通路。抑制這些RAB蛋白將阻斷外泌體分泌。
生物發生的雙路徑機制
| ESCRT依賴途徑 | ESCRT非依賴途徑 |
|---|---|
| 晚期內體膜向內出芽形成ILVs | 神經酰胺-鞘磷脂轉換介導ILVs生成 |
| MVB成熟后與質膜融合釋放外泌體 | 微囊泡(MVs)通過質膜向外出芽形成 |
| 主導跨膜蛋白分選 | 涉及細胞骨架降解等機制 |
EVs釋放后的三大歸宿
- 鄰近細胞捕獲:影響局部細胞通訊與微環境;
- 親代細胞重吸收:形成復雜反饋調節環路;
- 進入循環系統:被遠端器官細胞攝取,實現長程跨組織通訊。
此過程凸顯EVs作為系統性信號載體的核心功能。
4、EV的生物學功能
EVs的生理與病理全景作用
近期有力證據表明,胞外囊泡在正常生理過程和疾病等各個領域發揮著重要作用。正常生理過程包括發育、組織穩態、衰老、代謝調節、運動、應激反應、晝夜節律、妊娠期分子轉移、母乳喂養、進食和寄生蟲相互作用。疾病可分為非感染性疾病和感染性疾病,包括癌癥、炎癥、代謝紊亂、自身免疫、神經退行性疾病、慢性肺阻塞性疾病和成癮,以及由病毒、原生動物、真菌、蠕蟲、節肢動物和其他病原體引起的各種傳染病。
核心生物學機制解析
EV在細胞自主和互動功能中都發揮著關鍵作用,包括供體細胞中的蛋白質質量控??制、介導信號傳導、分子轉移和 ECM 重塑。蛋白質質量控??制的關鍵機制是外泌體生物合成,它能夠快速、選擇性地從質膜上消除蛋白質。
其中,EVs的核心功能包括:
蛋白質質控:通過外泌體生物發生清除質膜異常蛋白;
廢物清除:分泌未屏蔽RNA、化學修飾RNA及淀粉樣蛋白(amyloidogenic proteins);
多信號傳遞:作為”復合信號粒子”轉移功能性受體/效應器;
ECM調控:參與骨形成、血栓啟動及神經退行病變中淀粉樣聚集體擴散。
5、間充質干細胞療法的瓶頸與認知革新
MSC 具有一系列有益特性,包括免疫調節、促血管生成、促神經生成、抗凋亡和抗炎能力,這些特性歸因于其固有的歸巢至損傷部位的能力。
最初,人們認為MSC通過歸巢至受損組織并植入,然后分化取代受損細胞來介導愈合。然而,后續研究表明,MSC 的旁分泌作用才是其治療益處的主要原因。然而,MSC的典型細胞活動(包括自我復制和分化)會帶來風險,包括致癌轉化和免疫介導的排斥反應。因此,由于相關風險,MSC在人體中的臨床應用僅限于特定的細胞類型和疾病。相比之下,MSC-EVs復制了若干母細胞特性,有時甚至超越它們,尤其是在免疫和炎癥環境中。
與其祖細胞不同,MSC-EVs不具有復制和分化特性。它們在細胞外環境中具有更高的安全性、高效的運輸和有效的組織穿透性,這些優勢非常顯著,尤其是在體內給藥方面。MSC-EVs獨特的運作機制表明,它們缺乏其親本細胞的多種結構和功能特性,從而增強了其安全性和治療潛力(表3)。
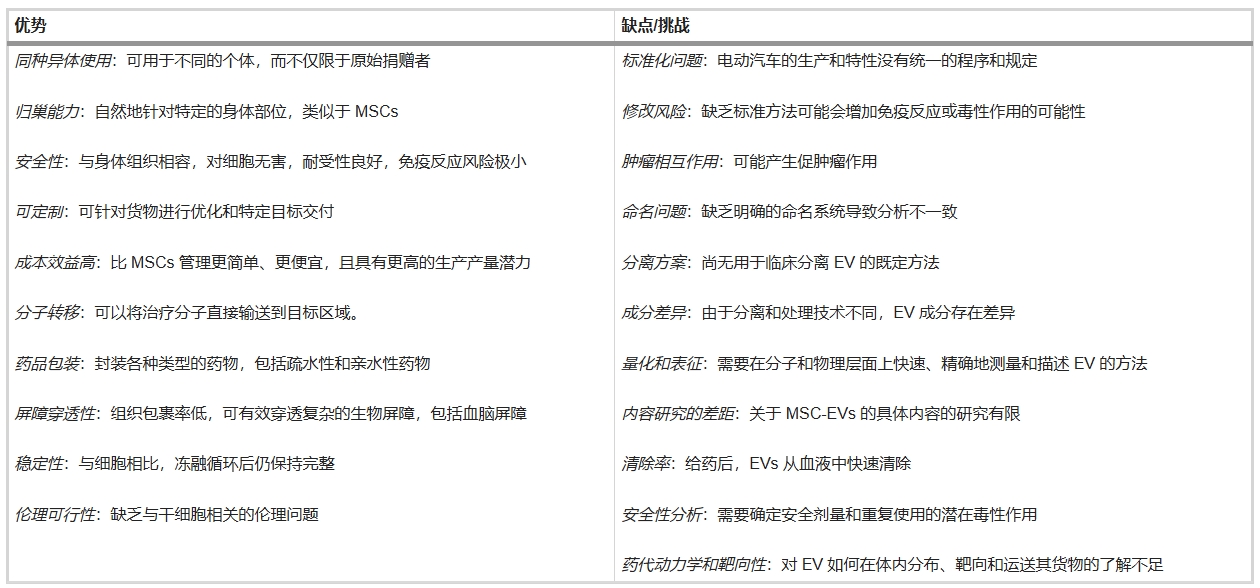
MSC-EVs的突破性治療優勢
相較于MSCs,MSC來源EVs(MSC-EVs) 具備革命性優勢:
- 安全性:無自我復制/分化能力,規避癌變風險;
- 免疫兼容性:無細胞療法免疫原性,避免排斥反應;
- 微環境穩定性:不受病變組織微環境影響(如胰腺癌中MSCs會促癌);
- 遞送效率:直徑僅100-300nm,可穿透血腦屏障,避免肺毛細血管滯留(MSCs直徑15-30μm會致肺部栓塞)。
EVs的臨床轉化核心價值
| 特性 | MSCs | MSC-EVs |
|---|---|---|
| 直徑 | 15-30 μm | 100-300 nm |
| 體內滯留 | 肺/肝/脾聚集 | 全身長效循環 |
| 免疫風險 | 引發排斥反應[54] | 幾乎無免疫原性 |
| 工程化潛力 | 困難 | 易基因改造裝載藥物 |
| 靶向修飾 | 不可行 | 表面蛋白可定向修飾 |
臨床應用前景與挑戰
臨床前研究表明MSC-EVs副作用顯著低于細胞療法,但需解決:
標準化定量:尚無統一EVs給藥計量標準;
藥效評估:需完善藥代/藥效動力學研究;
工程化優化:改造后EVs雖潛力更大,但需建立標準化制備流程。EVs療法有望成為下一代無細胞治療平臺。
6、MSC-EVs的組成
異質性來源與尺寸多樣性
MSC-EVs的組成異質性源于其尺寸差異(30-2000 nm)及細胞來源特異性:
- 生產機制:多泡體(MVB)膜的不均勻內陷導致囊泡內容物(蛋白質/核酸/液體)分布不均;
- 分離方法:不同分離技術(如超速離心、尺寸排阻色譜)可能混雜其他EV亞型,造成尺寸混雜;
- 亞群存在:先進分餾技術證實,小EVs(含外泌體)內部存在按尺寸定義的亞群(如30-50nm vs. 80-150nm)。
關鍵影響:尺寸差異直接影響貨物載量及靶細胞相互作用效率。
分子組成:膜蛋白與胞質貨物
膜相關組分
| 類別 | 代表性分子 | 功能 |
|---|---|---|
| 跨膜蛋白 | CD9, CD63, CD81 (TSPAN家族), MHC II復合物 | 細胞黏附、免疫識別 |
| ESCRT復合物 | TSG101, Alix | 囊泡出芽與貨物分選 |
| 信號分子 | 整合素家族, RAB GTP酶 (RAB4/11/27) | 細胞通訊與囊泡運輸調控 |
| 脂筏標志物 | 膽固醇, 鞘磷脂, GPI錨定蛋白, Flotillin | 維持膜結構穩定性 |
胞質貨物
- 結構蛋白:肌動蛋白(Actin)、微管蛋白(Tubulin)、絲切蛋白(Cofilin);
- 分子伴侶:熱休克蛋白Hsp70/Hsp90;
- 核酸結合蛋白:RNA結合蛋白(RBPs)、核糖核蛋白復合物。
核酸成分:爭議與特征
DNA:存在性爭議
- 否定觀點:基于蛋白質組學分析,外泌體不含雙鏈DNA及組蛋白,細胞外DNA分泌依賴自噬-MVE通路;
- 肯定證據:成像流式細胞術證實外泌體攜帶雙鏈DNA,核內容物可通過未知機制裝載。
RNA:組成與功能瓶頸
| RNA類型 | 平均長度 | 富集特征 | 功能限制 |
|---|---|---|---|
| miRNA | 18-24 nt | MSC-EVs中濃度比母細胞高10倍 | 單囊泡僅含1.3個pre-miRNA分子 |
| mRNA | 100-400 nt | 片段化嚴重 | 無法翻譯全長功能蛋白[66,80-83] |
| 非編碼RNA | circRNA, tRNA | 選擇性富集 | 調控受體細胞基因表達 |
miRNA裝載機制:
- nSMase2依賴途徑
- SUMO化hnRNPs依賴途徑
- miRNA 3′序列依賴性途徑
- miRISC相關途徑
脂質雙層結構與動態性
- 厚度:5nm ;
- 核心脂質:膽固醇、鞘磷脂、神經酰胺、磷脂酰絲氨酸(保守性強,跨細胞類型差異小);
- 功能關聯:脂筏結構(含膽固醇/GPI錨定蛋白)介導靶向運輸。
組成影響因素與純度挑戰
動態變量
- 微環境調控:缺氧/炎癥狀態改變EVs的蛋白質組(如ECM蛋白、代謝酶);
- 分離方法:蛋白酶污染可能導致跨膜蛋白(CD44/CD73/CD90)酶切,形成游離片段污染;
- 標志物異質性:同一批EVs中特定貨物(如miRNA)豐度差異顯著,需謹慎選擇純化標志物。
純度評估標準
- 正向標志物:跨膜蛋白(CD9/CD63/CD81)、MSC表面抗原(CD44/CD73/CD90);
- 負向標志物:脂蛋白、載脂蛋白(APOA1/2, APOB)、白蛋白(提示肝細胞污染);
- 建議策略:量化污染物清除效率,而非依賴二元檢測。
細胞內源污染物
部分EVs可能攜帶非典型組分(如線粒體、高爾基體片段),但小EVs(<200 nm)中極少富集。
總結:MSC-EVs的組成是其功能多樣性的物質基礎,但異質性、動態變化及純度問題仍是臨床轉化的核心挑戰。未來需結合單囊泡分析技術深化機制研究。
7、MSC-EVs的6種分離方法
EVs的分離方法對后續研究與生產至關重要。目前主要采用以下六種技術:
- 超速離心法(UC)
- 密度梯度離心法(DGC)
- 超濾法
- 尺寸排阻色譜法(SEC)
- 聚合物沉淀法
- 免疫親和純化法
下文將概述這些現代分離技術的原理與應用。
根據密度差異,EV可與乳糜微粒、VLDL、IDL 和 LDL 區分開來(表4);這些顆粒的密度低于EV(<1.063 g/mL)。相反,高密度脂蛋白的密度與 EV 相似(1.06~1.21 g/mL),只能通過尺寸差異與EV分離(參見表2)。分離EV的方法多種多樣(表5),每種方法都有其獨特的優點和缺點。
| 粒子類型 | 尺寸(納米) | 密度(克/毫升) |
|---|---|---|
| 乳糜微粒 | 75–1200 | <0.95 |
| 乳糜微粒殘留物 | 30–80 | 0.95–1.006 |
| 極低密度脂蛋白(VLDL) | 30–80 | 0.95–1.006 |
| 中密度脂蛋白(IDL) | 23–27 | 1.006–1.019 |
| 低密度脂蛋白(LDL) | 18–23 | 1.019–1.063 |
| 高密度脂蛋白(HDL) | 7–13 | 1.063–1.21 |
| 細胞外囊泡 | 30–1000 | 1.06–1.21 |
| 方法 | 原理 | 優勢 | 局限性 |
|---|---|---|---|
| 超速離心法 (UC) | 利用高速離心力沉降EVs | 可高效沉淀EVs | 對小尺寸/低密度顆粒效率低;重復離心降低得率(囊泡損失與結構損傷) |
| 密度梯度離心法 (DGC) | 基于浮力密度差異,在蔗糖等梯度介質中分離EVs | 可分離密度相近的顆粒 | 可能共分離密度相似的非EV顆粒;導致EVs損失和損傷 |
| 尺寸排阻色譜法 (SEC) | 依據分子尺寸分離,大分子EVs先于小分子蛋白洗脫 | 操作溫和,保留囊泡完整性 | 無法排除非EV物質;洗脫液稀釋需額外濃縮步驟;需合并多組分 |
| 超濾法 | 通過膜孔徑截留大尺寸EVs | 快速、可處理大體積樣本 | 存在外泌體形變風險;小分子流體成分易污染樣本 |
| 聚合物沉淀法 | 體積排阻聚合物(如PEG)沉淀EVs及相似尺寸顆粒,低速離心收集 | 操作簡單,適合臨床轉化 | 蛋白去除率低,存在蛋白污染風險 |
| 免疫親和純化法 | 抗體靶向捕獲特定表面標志物(如CD63)的EV亞群 | 特異性與純度高 | 耗時長、成本高(需延長抗原-抗體結合時間);試劑質量要求嚴格;僅獲特定EV亞群 |
8、細胞外囊泡的存儲
儲存條件對于維持MSC條件培養基中EV的特性至關重要,包括其穩定性、顆粒數、聚集性和功能性。對于MSC條件培養基和分離的EV,提供其儲存方式的具體細節(包括所用容器類型、儲存溫度和儲存時間)至關重要。在儲存過程中,主要問題之一是高純度EV的損失,這可能是由于它們粘附在儲存容器表面造成的。
目前,?80°C被認為是MSC條件培養基和分離的EV的最佳儲存溫度。然而,一些研究表明,在此溫度下儲存會導致EV特性隨時間發生變化。無論使用防腐劑還是冷凍保護劑,在?80°C下儲存均已證實會降低EV濃度和純度,并改變粒度和zeta電位。此外,建議避免反復凍融循環,因為這會對EV質量產生潛在的有害影響。
9、結論
EV分類學的演變與挑戰
歷史上,EVs 被稱為不同囊泡的組合,包括外泌體(小型 EVs)、微囊泡(大型 EVs)和外泌體(小型/大型 EVs)。早期研究經常互換使用這些術語。然而,最近的進展使得這些 EVs 之間的區別更加清晰,關注的是它們的物理特性,而不僅僅是它們的生物發生機制。雖然基于大小的分類很實用,但它并不總是能準確區分 EVs 的類型,例如微囊泡和外泌體。迄今為止,創新技術能夠在復雜混合物中識別和表征 EVs 亞型。為了準確分類,這種方法需要考慮多種特征,包括表面標志和大小,強調詳細特征而不是簡單的測量指標,例如大小。
胞外囊泡(EV)是細胞間運輸關鍵物質(蛋白質、RNA、脂質和碳水化合物)的重要信使,其成分主要與來源細胞相似。越來越多的研究表明,MSC-EV 具有與 MSC 類似的功能,參與 MSC 的旁分泌信號傳導,可能有助于其他干細胞的進展和分化,促進組織再生,并發揮免疫調節作用。
MSC-EVs的治療優勢與產業化瓶頸
與目前的細胞方法相比,MSC-EVs更易于管理、更具成本效益,且易于大規模生產。然而,其作為一種更優的臨床治療策略的發展受到諸多挑戰的阻礙。MSC-EVs在體外和體內研究中的標準化應用仍然不足,阻礙了臨床試驗的開展。不同研究方法的不一致影響了可比性,需要建立可重復的EVs純化和表征技術。
| 治療屬性 | 產業化挑戰 |
|---|---|
| 繼承MSCs旁分泌功能:促進干細胞分化、組織再生與免疫調節 | 標準化缺失:分離/表征方法不統一阻礙臨床試驗 |
| 無細胞治療優勢:易儲存運輸、無免疫排斥、無倫理爭議 | 規模化生產瓶頸:缺乏符合GMP標準的量產工藝 |
| 工程化潛力:可修飾增強靶向性 | 藥效學盲區:靶向機制與藥代動力學不明 |
臨床轉化路徑與未來方向
MSC-EVs作為治療手段的應用與MSCs大規模培養和臨床應用的進展密切相關,展現出巨大的治療前景。MSC-EVs 具有諸多優勢,包括易于儲存和運輸、保質期更長、免疫排斥風險更低以及比細胞療法更少的倫理問題。然而,其臨床應用仍需解決幾個關鍵問題,包括開發大規模生產方法、實現精準定量和表征、了解其藥代動力學和靶向機制以及全面評估其安全性。
未來的關鍵方向之一是標準化和可擴展的EVs生產工藝,以優化功能和儲存條件。此外,提高EVs的分離效率和選擇性也至關重要。TFF已成為一種備受青睞的首選方法,與免疫沉淀和密度梯度離心 (UC) 等傳統技術相比,它具有可擴展性和可靠性。進一步的研究還將探討環境條件和工程設計如何影響MSC-EVs的功能,從而增強其在再生醫學中的治療效果。盡管MSC-EV療法具有巨大的潛力,但擴大GMP級EV藥物的生產和開展全面的臨床試驗仍然面臨重大挑戰。
參考資料:[1]Huang, CY. (2025). Biology of Extracellular Vesicles from Mesenchymal Stem Cells. In: Liem, N.T., Forsyth, N.R., Heke, M. (eds) Cell Therapy. Springer, Singapore. https://doi.org/10.1007/978-981-96-1261-1_6
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信