1型糖尿病(T1D)是一種因自身免疫系統破壞胰島β細胞導致的慢性代謝性疾病,全球約4.2億糖尿病患者中,T1D占比約5%-10%。患者需終身依賴外源性胰島素治療,但現有方案難以完全模擬生理胰島素分泌模式,且長期并發癥(如視網膜病變、腎衰竭)發生率高達30%以上。
當前,1型糖尿病治療領域有兩個備受關注的方向:一是作為 “現有最優解” 的胰島素泵,二是被寄予 “治愈厚望” 的干細胞療法。兩者分別代表了 “控制癥狀” 與 “根源修復” 的不同思路,也讓患者和醫生看到了突破治療瓶頸的可能。
本文從機制、現狀、挑戰及未來前景等多方面維度,對干細胞療法和胰島素泵在1型糖尿病治療中的優缺點進行系統對比,為患者帶來最新的前沿資訊。

干細胞療法vs胰島素泵|1型糖尿病的未來治療方向對比
1型糖尿病的現狀與挑戰
1型糖尿病是一種自身免疫性疾病,患者體內負責分泌胰島素的β細胞被免疫系統攻擊破壞,導致胰島素嚴重不足。這類患者需要一輩子依賴外源性胰島素維持生命,不僅日常管理起來很繁瑣,還得時刻提防高低血糖波動的風險。
實際上,現在1型糖尿病的治療一直停留在“替代療法”階段:患者要么打針注射胰島素,要么佩戴設備,以此來模仿胰腺分泌胰島素的節奏。但這種辦法有個天生的毛病 —— 既不能完全跟上人體血糖的實時變化(像飯后血糖突然升高、半夜可能出現低血糖這些情況),也沒辦法阻止免疫系統對剩下β細胞的持續傷害,病情還是會慢慢發展。
胰島素泵是現在最先進的控糖設備了,雖然能在一定程度上解決控糖精度的問題,但說到底還是沒跳出 “被動補糖” 的圈子;而干細胞療法呢,是想從根本上重新建立胰島β細胞的功能,改變一輩子依賴胰島素的狀況,只不過現在還處在臨床研究階段。
因此,胰島素泵代表的是“當下能用的現實手段”,而干細胞療法則寄托著“未來可能實現的希望”。兩者的對比,更像是現實與未來之間的權衡。

胰島素泵:穩定控制的現實選擇
現代胰島素泵通過持續皮下輸注胰島素,模擬胰腺生理性分泌,提供基礎量和餐時大劑量胰島素,更貼合人體正常胰島素分泌模式。
胰島素泵的優勢
胰島素泵的核心優勢在于提供更平穩的血糖控制,減少低血糖事件,控制高血糖,提高治療靈活性,顯著提升患者生活質量。
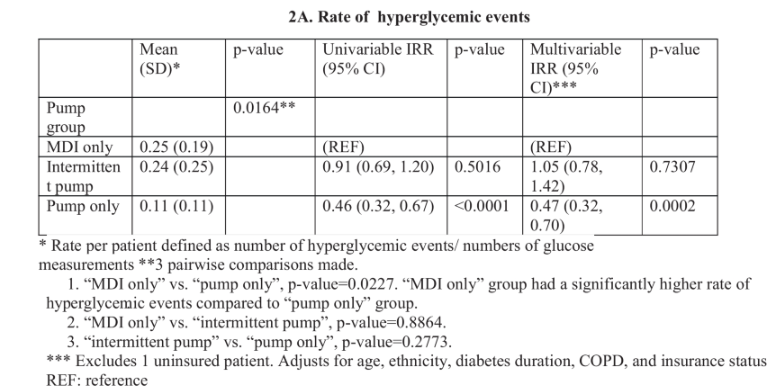
以一項2024年4月,美國紐約州北岸大學醫院醫學部發表在《Journal of General Internal Medicine》雜志上的研究為例,該研究對比了胰島素泵與皮下胰島素治療1型糖尿病患者的血糖控制差異的臨床成果。[1]

該研究納入了78名平均年齡51歲的患者,分為“僅使用泵”組18名患者,“僅使用皮下胰島素(MDI)”組50名患者,“間歇性使用泵”組10名患者。
結果顯示,住院期間“僅用泵”組的高血糖比例明顯低于“僅用MDI”組(泵組高血糖比例約0.11,MDI約0.25);校正混雜因素后,僅使用泵高血糖事件發生率約為MDI的一半左右(發生率比約0.47)。此外,平均血糖方面,僅使用泵組也比MDI組更低(約173mg/dLvs196mg/dL)。
這項研究的結論很直白:在住院場景下,合理選擇并堅持使用胰島素泵,能夠更好地控制血糖,且安全性可控。
胰島素泵的局限性
胰島素泵??依賴設備??、需要患者具備較強的學習和管理能力。價格較高,每個泵需數萬元,且每周更換管路耗材需百元左右。泵需要隨身攜帶,洗澡等活動需斷開,可能帶來不便和感染風險。最重要的是,它??不能阻止疾病進程??,只是替代性治療而非根治方案。
干細胞療法:探索中的未來希望
干細胞療法旨在通過重建功能性胰島β細胞或調節異常免疫反應,通過移植健康的干細胞到患者體內,修復或替代受損的胰島β細胞,從而恢復內源性胰島素分泌功能,從根本上治療1型糖尿病。
主要策略包括:分化干細胞為胰島樣細胞進行移植,或利用干細胞的免疫調節功能抑制自身免疫攻擊。
干細胞療法的優勢
干細胞療法的最大優勢就是有望??重建胰島功能??,實現??生理性血糖調控??,從根本上解決胰島素絕對缺乏問題。它可能使患者完全擺脫胰島素依賴,甚至實現糖尿病的緩解或治愈。
2024年9月,南開大學醫學院天津第一中心醫院器官移植中心移植醫學研究所的王樹森等人在國際頂尖期刊《細胞》(Cell)上發表了一項里程碑式研究成果:首次通過干細胞再生療法實現1型糖尿病的功能性治愈。[2]

團隊采用自體誘導多能干細胞(iPSC)分化出的胰島樣細胞進行移植,報告稱這一策略使部分患者實現了脫離外源胰島素的目標。首位接受治療的是一名25歲女性患者:在移植后3個月內,她的胰島功能逐步恢復,最終停止了胰島素注射。
隨訪顯示,這位患者在移植后數月開始出現穩定的內源性胰島素分泌,血糖多數時間維持在目標區間,相關良好狀態在隨后的隨訪中已維持了一年。
此外,2025年6月20日,福泰制藥(Vertex)在美國糖尿病協會(ADA)科學年會上震撼發布FORWARD-101臨床試驗的1/2/3期的最新研究結果,并更新了1/2期試驗的最新臨床數據,相關結果發表在國際期刊《新英格蘭醫學雜志》上。[3]
該研究聚焦于zimislecel(原名VX-880),一種基于干細胞的完全分化胰島細胞療法,旨在治療伴有低血糖意識障礙和嚴重低血糖事件(SHE)的1型糖尿病(T1D)患者。

在這項FORWARD-101試驗中,12名接受單次全劑量Zimislecel輸注的1型糖尿病患者被隨訪至少一年。
結果顯示,所有受試者的內源性胰島素分泌均出現恢復,嚴重低血糖事件徹底消失,血糖控制達到臨床目標(糖化血紅蛋白HbA1c<7%,血糖在目標范圍時間占比TIR>70%)。
并且治療后,受試者的外源性胰島素使用量顯著降低,平均減少約92%,其中10人(83%)完全停用胰島素注射。治療相關的不良事件主要與胰島輸注過程及常規免疫抑制方案一致,未出現新的嚴重安全問題。
總體而言,這項隨訪研究提供了頗具希望的初步證據:干細胞療法能夠在一年內大幅減少甚至終結胰島素依賴,同時改善血糖穩定性。
相關閱讀:2025干細胞治療1型糖尿病最新進展:距離臨床還有多遠?
干細胞療法的局限性
盡管干細胞療法在糖尿病等疾病的研究中展現出令人鼓舞的結果,但其應用仍存在不少挑戰。目前治療費用較高,臨床研究的樣本量和隨訪時間都比較有限,尚不足以全面評估長期效果和安全性。未來仍需要更大規模、更長期的研究來確認它的可靠性和普適性。
干細胞療法vs胰島素泵:核心維度對比
| 對比維度 | 胰島素泵 | 干細胞療法 |
|---|---|---|
| 作用原理 | 外部輸注胰島素 | 重建胰島素分泌細胞 |
| 治療目標 | 控制血糖,減少并發癥風險 | 實現 “功能性治愈”,擺脫胰島素依賴 |
| 適用人群 | 所有1型糖尿病患者 | 選擇性患者群體 |
| 發展階段 | 成熟技術(第四代閉環系統) | 臨床研究階段 |
| 治療方式? | 設備依賴,持續使用 | 單次或數次治療 |
| 價格成本 | 設備數萬元,月耗材數百元 | 單次數萬元 |
| 療效持久性 | 需要終身使用 | 可能實現長期緩解 |
| 風險隱患? | 設備故障、感染、低血糖 | 免疫排斥、致瘤性、倫理問題 |
未來展望:協同發展,走向精準治療
短期內,胰島素泵特別是人工胰腺系統(閉環系統)仍是1型糖尿病管理的主力軍。技術迭代將帶來更智能、更便捷的設備,進一步減輕患者管理負擔。
中長期來看,干細胞療法有望取得突破,但仍需更多臨床驗證其安全性、有效性和持久性。首款干細胞衍生胰島細胞產品可能在未來幾年內獲批,適用于特定患者群體。
未來可能的治療模式是干細胞與智能設備的結合:干細胞移植提供內源性胰島素分泌功能,智能設備則負責實時監測和精細調節,形成完整的生理性血糖調控系統。
結語
對于1型糖尿病患者和家庭,胰島素泵和干細胞療法代表不同層面的希望:胰島素泵提供當下更優質的生活,而干細胞療法承載未來的治愈夢想。
理性看待新技術突破的同時,不應忽視當下科學的疾病管理方式。在期待干細胞療法帶來革命性變化的同時,把握好現有的治療手段,保持血糖良好控制,才是應對1型糖尿病的務實之道。
參考資料:
[1]Ye, Y., Acevedo-Mendez, B.A., Izard, S.?et al.?Differences in Glycemic Control for Inpatients with Type 1 Diabetes on Insulin Pump Versus Subcutaneous Insulin Therapy.?J GEN INTERN MED?39, 1895–1900 (2024). https://doi.org/10.1007/s11606-024-08736-4
[2]Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patientWang, Shusen et al.Cell, Volume 187, Issue 22, 6152 – 6164.e18
[3]https://www.nejm.org/doi/10.1056/NEJMoa2506549
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信