概括:使用間充質干細胞(MSC)進行骨關節炎的關節內治療已顯示出良好的結果,并且正在越來越多地在臨床中實施。自體干細胞是治療的主要來源,但與細胞擴增、患者年齡和急性治療相關的問題引發了對同種異體MSC的需求。然而,在第一次至第二次治療中使用同種異體間充質干細胞時,報告了有問題的免疫反應,如疼痛、關節腫脹、蕁麻疹和MSC破壞。正如本綜述所述,在決定自體或同種異體間充質干細胞治療時需要考慮多種因素。
骨關節炎是一種疼痛、退行性和炎癥性關節疾病。不幸的是,尚無有效治愈或減緩疾病的治療方法,但近幾十年來,間充質干細胞 (MSC) 治療在關節愈合、延緩疾病進展和緩解疼痛方面顯示出良好的效果。
自體干細胞與異體干細胞治療骨關節炎的優點和缺點
研究表明,間充質干細胞通過直接分化、局部祖細胞的旁分泌激活以及調節免疫系統使環境變得更有利于愈合來發揮作用。在臨床上,自體間充質干細胞主要用于骨關節炎治療,但與細胞增殖、患者年齡和急性治療相關的問題引發了對同種異體干細胞治療骨關節炎的渴望。
同種異體移植的一個挑戰是潛在的免疫異物反應,當受體的免疫細胞識別出細胞表面的主要組織相容性復合體(MHC)與其自身不同時,就會引發這種反應。MHC有兩個類別(I和II),又分為幾個人類白細胞抗原亞類。
歷來認為MSC不含MHCII類,并且具有非常低水平的MHCI類,利用MHCI類,它們可以逃避/最小化T細胞識別和不需要的免疫反應,理論上允許同種異體干細胞治療。然而,最近的研究表明,不幸的是情況并非總是如此,因為已在MSC表面鑒定出I類和II類MHC的異質類型。體外研究表明,在炎癥因子刺激后,間充質干細胞中MHCII類的表達上調,而炎癥因子在骨關節炎關節中升高。MHC錯配可能會在同種異體治療期間引起免疫反應,這已在從第一次治療到第二次治療的重復治療中得到證實(圖1)。

用于治療骨關節炎的同種異體、市售人類干細胞產品目前正在歐盟開發,并已在亞洲和歐盟市場上銷售。自體和同種異體干細胞療法越來越多地用于骨關節炎患者,使得對相關優點和缺點以及為個體患者選擇最合適的治療方法而需要考慮的因素進行基于證據的討論變得非常重要。因此,這篇狀態文章的目的是闡明自體干細胞與異體干細胞治療骨關節炎的優點和缺點。
自體間充質干細胞治療關節炎
從各種類型的組織(包括脂肪組織和骨髓)中收獲的間充質干細胞用于骨關節炎的關節內治療。臨床研究表明,其具有積極作用,可降低疼痛評分、減少軟骨破壞,并且在一些研究中還可以增加再生軟骨的形成。
目前,自體間充質干細胞治療主要用于骨關節炎患者,即從患者自身采集干細胞。從這里開始,干細胞要么直接在手術室中進行一步操作,例如微碎片脂肪組織和濃縮骨髓抽吸物,要么在實驗室中進一步純化和增殖后使用。與擴增MSC治療(通常為10-100×106)相比,一步程序中的干細胞數量相對較低(通常<1×106) 。
對擴增細胞的MSC劑量反應研究表明,較高劑量在骨關節炎治療中具有更好的長期效果。因此,通過注射前細胞的體外增殖可以潛在地改善間充質干細胞治療。細胞的增殖需要良好的生產實踐實驗室以及多個監管許可。此外,細胞增殖既耗時又昂貴,因此排除了用增殖的自體細胞進行急性治療。這可能是有問題的,因為間充質干細胞治療骨關節炎已顯示出主要在骨關節炎早期階段的軟骨保護和再生效果。
研究還表明,間充質干細胞的分裂能力有限,大量的細胞復制會對間充質干細胞產生負面影響,使它們無法再形成軟骨和骨組織,而是變得“衰老”(衰老)并分泌抑制性信號傳導物質對周圍細胞的影響。因此,起始材料中的細胞數量必須足夠高,以便大規模生產不會對細胞造成損害。
如果使用自體高劑量間充質干細胞進行重復治療時細胞需求較高,則MSC有限的增殖能力可能會出現問題,這可能會延長積極的治療效果。在I/II期隨機對照試驗中,Matas等人表明,在12個月的隨訪中,兩次MSC治療膝骨關節炎(間隔6個月)比單次治療對疼痛評分有更好的效果。然而, Freitag等人在比較膝骨關節炎的一種或兩種MSC治療方法時發現疼痛評分沒有差異。然而, Freitag等人的研究使用的MSC (100 ×106) 是Matas等人(20×106)的五倍,這可能是一個促成因素。
多項研究表明,間充質干細胞的數量和質量隨著供體年齡的增加而下降,通常在50歲左右報告顯著下降。一些研究表明沒有年齡影響,并且與骨髓MSC相比,脂肪組織MSC對衰老的敏感性較低。因此,細胞數量和細胞增殖可能是自體治療中的限制因素,而在同種異體治療中,這不是一個挑戰,因為異體治療中可以使用來自多個(年輕)供體的細胞。因此,在自體治療和干細胞類型的選擇時應考慮患者的年齡,這可能是一個挑戰,因為骨關節炎經常發生在老年患者中。
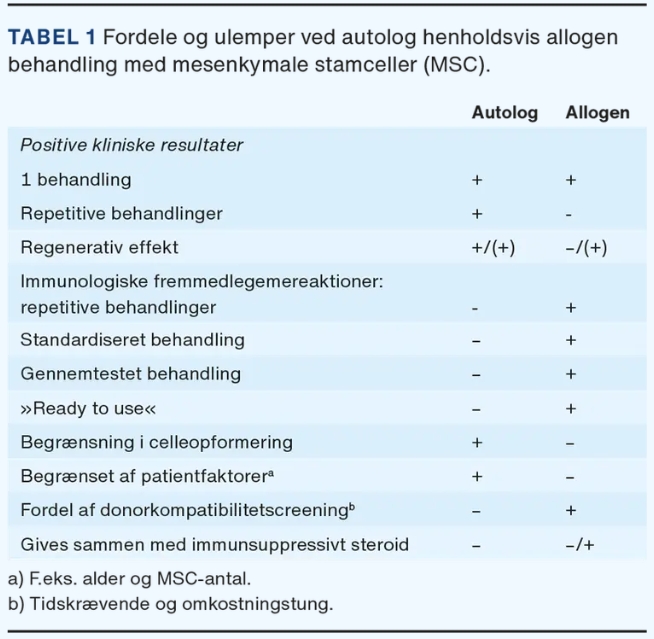
自體治療的明顯優勢是異物反應的風險最小化,并且無需篩選供體兼容性(表1)。與培養細胞相比,封閉式自體一步式手術所需的監管許可更少,感染風險也更低。Wiggers等人進行的系統評價包括408名膝骨關節炎患者的14項自體MSC治療隨機對照試驗,其中進行了1次 (79%)、2次 (14%) 或3次 (7%) 關節內治療。研究表明,治療一年后,與對照組相比,間充質干細胞治療后26項患者報告的結果測量 (PROM) 中有19項 (73%) 顯著改善。隨機對照試驗通常質量參差不齊,其中一些試驗存在較高的結果偏倚風險,但在治療后四年內,任何隨機對照試驗基本上都未報告自體間充質干細胞治療的顯著副作用。
同種異體間充質干細胞治療關節炎
商業化的同種異體間充質干細胞治療骨關節炎將很有吸引力。單次注射同種異體MSC已用于多項骨關節炎研究,臨床改善且無明顯副作用。
- Copp等人的一項審查表明,六分之五 (83%) 的骨關節炎臨床試驗采用同種異體、擴展MSC治療,導致PROM顯著改善。當用自體MSC治療時,這個數字是九分之八 (89%)。然而,
- Frisbie等人的一項研究報告稱,與同種異體間充質干細胞治療相比,單次注射自體間充質干細胞可以對軟骨損傷產生更好的再生反應,增加骨贅和軟骨形成,但在大多數參數上,這種治療并不比僅注射纖維蛋白凝膠明顯更好。
- de Windt等人的I期研究進一步表明,通過用同種異體間充質干細胞治療軟骨損傷獲得的再生組織僅由患者自身的DNA組成,并且同種異體間充質干細胞的主要作用是通過旁分泌信號傳導。
然而,MHC錯配已被證明會導致重復同種異體治療的免疫反應。同種異體間充質干細胞治療的副作用包括關節疼痛、關節腫脹、蕁麻疹和MSC破壞。這是有問題的,因為骨關節炎的重復MSC治療可能會產生更好的長期結果。
如果MSC暴露于骨關節炎樣炎癥刺激,它們也可以上調其MHCII類表達。Oh等人的一項研究表明,在正常生長條件下,1.1%的人骨髓間充質干細胞表面具有II類MHC,但在腫瘤壞死因子-α的炎癥刺激后,這種情況上調至28.7%的間充質干細胞,發現關節炎關節中的濃度增加。這使得僅使用MHCII類陰性MSC進行同種異體治療存在問題,因為MSC在注射到骨關節炎關節后將暴露于炎癥。然而,通過敲除I類和II類MHC的基因操作,使該基因不再存在于MSC中,已顯示出MSC在移植到不匹配的免疫活性小鼠后具有存活的潛力。
在治療前可以對患者和供體進行單倍型分析和匹配,但涉及一個耗時且昂貴的過程,這就是為什么目前在同種異體細胞的臨床骨關節炎研究中沒有進行這種操作。此外,由于MSC增殖能力有限,同種異體治療通常包含來自多個供體的MSC,這使得完全匹配變得困難。特征明確的干細胞庫可以幫助解決這個問題。
細胞記憶被進一步認為是同種異體異物反應的原因。
- 2014年, Ryan等人表明,在同種異體大鼠模型中,間充質干細胞分化為軟骨細胞會導致其基因表達發生變化,從而導致它們失去免疫抑制能力,并被同種異體T細胞降解。細胞發起的免疫反應。分化的人類間充質干細胞在體外也失去了免疫抑制能力。未分化的間充質干細胞在大鼠模型中引起的免疫反應明顯較低,但在再生關節治療中,立即需要間充質干細胞的高分化能力,這與它們的旁分泌信號一起可以促進關節的再生。可能需要不良免疫抑制類固醇治療來降低異物反應的風險。
同種異體療法的優點是一種更加標準化和經過測試的治療方法,可以快速使用 – 最好來自最佳供體。從具有高干細胞潛力的(年輕)供體中選擇間充質干細胞是可能的,這可能會改善(老年)骨關節炎患者的治療效果。來自多個供體的細胞也可以用于商業用途的大規模細胞增殖(表1)。
討論與結論
使用自體和同種異體間充質干細胞治療骨關節炎已顯示出有希望但各不相同的結果。這可能是由于研究設計、患者年齡、采集組織和方法、MSC劑量、治療次數等方面的差異所致。
據報道,使用自體間充質干細胞對患者來說是安全的,而同種異體治療可能會發生免疫異物反應,特別是重復注射。如果自體治療遇到困難,例如患者年齡較大和迫切需要治療,可以考慮單一同種異體間充質干細胞治療。
目前,關于自體或同種異體間充質干細胞治療骨關節炎患者的普遍使用尚無定論。用間充質干細胞治療骨關節炎仍必須被視為實驗性的,并且只能在受控的環境中進行,并對患者進行結構化的隨訪。
參考文獻:
- Matas J, Orrego M, Amenabar D et al. Umbilical cord-derived mesenchymal stromal cells (MSCs) for knee osteoarthritis: repeated MSC dosing is superior to a single MSC dose and to hyaluronic acid in a controlled randomized phase I/II trial. Stem Cells Transl Med. 2019;8(3):215-224. doi: 10.1002/sctm.18-0053.
- Lamo-Espinosa JM, Mora G, Blanco JF et al. Intra-articular injection of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: multicenter randomized controlled clinical trial (phase I/II). J Transl Med. 2016;14(1):246. doi: 10.1186/s12967-016-0998-2.
- Andersen C, Uvebrant K, Mori Y et al. Human integrin α10β1-selected mesenchymal stem cells home to cartilage defects in the rabbit knee and assume a chondrocyte-like phenotype. Stem Cell Res Ther. 2022;13(1):206. doi: 10.1186/s13287-022-02884-2.
- Li JJ, Hosseini-Beheshti E, Grau GE et al. Stem cell-derived extracellular vesicles for treating joint injury and osteoarthritis. Nanomaterials (Basel). 2019;9(2):261. doi: 10.3390/nano9020261.
- Danisovic L, Oravcova L, Krajciova L et al. Effect of long-term culture on the biological and morphological characteristics of human adipose tissue-derived stem cells. J Physiol Pharmacol. 2017;68(1):149-158.
- Bagge J, Berg LC, Janes J et al. Donor age effects on in vitro chondrogenic and osteogenic differentiation performance of equine bone marrow- and adipose tissue-derived mesenchymal stromal cells. BMC Vet Res. 2022;18(1):388. doi: 10.1186/s12917-022-03475-2.
- Frederiksen HR, Doehn U, Tveden-Nyborg P et al. Non-immunogenic induced pluripotent stem cells, a promising way forward for allogenic transplantations for neurological disorders. Front Genome Ed. 2021;2:623717. doi: 10.3389/fgeed.2020.623717.
- Schnabel LV, Pezzanite LM, Antczak DF et al. Equine bone marrow-derived mesenchymal stromal cells are heterogeneous in MHC class II expression and capable of inciting an immune response in vitro. Stem Cell Res Ther. 2014;5(1):13.
- Oh JY, Kim H, Lee HJ et al. MHC class I enables MSCs to evade NK-cell-mediated cytotoxicity and exert immunosuppressive activity. Stem Cells. 2022;40(9):870-882. doi: 10.1093/stmcls/sxac043.
- Eliopoulos N, Stagg J, Lejeune L et al. Allogeneic marrow stromal cells are immune rejected by MHC class I- and class II-mismatched recipient mice. Blood. 2005;106(13):4057-65. doi: 10.1182/blood-2005-03-1004.
- Pezzanite LM, Fortier LA, Antczak DF et al. Equine allogeneic bone marrow-derived mesenchymal stromal cells elicit antibody responses in vivo. Stem Cell Res Ther. 2015;6(1):54. doi: 10.1186/s13287-015-0053-x.
- Joswig AJ, Mitchell A, Cummings KJ et al. Repeated intra-articular injection of allogeneic mesenchymal stem cells causes an adverse response compared to autologous cells in the equine model. Stem Cell Res Ther. 2017;8(1):42. doi: 10.1186/s13287-017-0503-8.
- Lee WS, Kim HJ, Kim K Il et al. Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase IIb, randomized, placebo-controlled clinical trial. Stem Cells Transl Med. 2019;8(6):504-511. doi: 10.1002/sctm.18-0122.
- Wiggers TG, Winters M, van den Boom NA et al. Autologous stem cell therapy in knee osteoarthritis: a systematic review of randomised controlled trials. Br J Sports Med. 2021;55(20):1161-1169. doi: 10.1136/bjsports-2020-103671.
- Hudetz D, Bori? I, Rod E et al. The effect of intra-articular injection of autologous microfragmented fat tissue on proteoglycan synthesis in patients with knee osteoarthritis. Genes (Basel). 2017;8(10):270. doi: 10.3390/genes8100270.
- Bagge J, H?lmich P, Nehlin JO et al. Microfragmentation for processing stem cells from adipose tissue is promising when compared to enzymatic digestion for the treatment of osteoarthritis. Scandinavian Sports Medicine Congress, 2022.
- Copp G, Robb KP, Viswanathan S. Culture-expanded mesenchymal stromal cell therapy: does it work in knee osteoarthritis? A pathway to clinical success. Cell Mol Immunol. 2023;20(6):626-650. doi:10.1038/s41423-023-01020-1.
- Freitag J, Bates D, Wickham J et al. Adipose-derived mesenchymal stem cell therapy in the treatment of knee osteoarthritis: a randomized controlled trial. Regen Med. 2019;14(3):213-230. doi: 10.2217/rme-2018-0161.
- Zhou S, Greenberger JS, Epperly MW et al. Age-related intrinsic changes in human bone-marrow- derived mesenchymal stem cells and their differentiation to osteoblasts. Aging Cell. 2008;7(3):335-43. doi: 10.1111/j.1474-9726.2008.00377.x.
- Choudhery MS, Badowski M, Muise A et al. Donor age negatively impacts adipose tissue-derived mesenchymal stem cell expansion and differentiation. J Transl Med. 2014;12:8. doi: 10.1186/1479-5876-12-8.
- Justesen J, Stenderup K, Eriksen EF et al. Maintenance of osteoblastic and adipocytic differentiation potential with age and osteoporosis in human marrow stromal cell cultures. Calcif Tissue Int. 2002;71(1):36-44. doi: 10.1007/s00223-001-2059-x.
- Chen HT, Lee MJ, Chen CH et al. Proliferation and differentiation potential of human adipose-derived mesenchymal stem cells isolated from elderly patients with osteoporotic fractures. J Cell Mol Med. 2012;16(3):582-93. doi: 10.1111/j.1582-4934.2011.01335.x.
- Geburek F, Mundle K, Conrad S et al. Tracking of autologous adipose tissue-derived mesenchymal stromal cells with in vivo magnetic resonance imaging and histology after intralesional treatment of artificial equine tendon lesions – a pilot study. Stem Cell Res Ther. 2016;7:21. doi: 10.1186/s13287-016-0281-8.
- Vega A, Martín-Ferrero MA, Del Canto F et al. Treatment of knee osteoarthritis with allogeneic bone marrow mesenchymal stem cells: a randomized controlled trial. Transplantation. 2015;99(8):1681-90. doi: 10.1097/TP.0000000000000678.
- Song JS, Hong KT, Kim NM et al. Implantation of allogenic umbilical cord blood-derived mesenchymal stem cells improves knee osteoarthritis outcomes: Two-year follow-up. Regen Ther. 2020;14:32-39. doi: 10.1016/j.reth.2019.10.003.
- de Windt TS, Vonk LA, Slaper-Cortenbach ICM et al. Allogeneic mesenchymal stem cells stimulate cartilage regeneration and are safe for single-stage cartilage repair in humans upon mixture with recycled autologous chondrons. Stem Cells. 2017;35(1):256-264. doi: 10.1002/stem.2475.
- Frisbie DD, McCarthy HE, Archer CW et al. Evaluation of articular cartilage progenitor cells for the repair of articular defects in an equine model. J Bone Joint Surg Am. 2015;97(6):484-93. doi: 10.2106/JBJS.N.00404.
- Nauta AJ, Westerhuis G, Kruisselbrink AB et al. Donor-derived mesenchymal stem cells are immunogenic in an allogeneic host and stimulate donor graft rejection in a nonmyeloablative setting. Blood. 2006;108(6):2114-20. doi: 10.1182/blood-2005-11-011650.
- Halm D, Leibig N, Martens J et al. Direct comparison of the immunogenicity of major histocompatibility complex-I and -II deficient mesenchymal stem cells in vivo. Biol Chem. 2021;402(6):693-702. doi: 10.1515/hsz-2020-0306.
- Ryan AE, Lohan P, O’Flynn L et al. Chondrogenic differentiation increases antidonor immune response to allogeneic mesenchymal stem cell transplantation. Mol Ther. 2014;22(3):655-667. doi: 10.1038/mt.2013.261.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信