在神經科學與再生醫學不斷交織發展的前沿領域,對于帕金森病治療方法的探索始終是研究的重中之重。過去幾十年間,科學家們在理解帕金森病的發病機制方面取得了顯著進展,明確了多巴胺能神經元的進行性退變是導致該病的核心病理改變。
基于此,眾多治療策略相繼涌現,藥物治療在早期雖能改善癥狀,但長期使用往往伴隨著諸多副作用,且無法阻止疾病的惡化;手術治療如深部腦刺激等也存在一定局限性。隨著干細胞技術的迅猛發展,間充質干細胞憑借其多向分化潛能、免疫調節特性以及低免疫原性等優勢,逐漸成為攻克帕金森病難題的新焦點。
帕金森病治療:基于間充質干細胞改造的應用與突破探尋
在神經退行性疾病的治療探索領域,帕金森病(PD)一直是備受關注的焦點之一。作為一種與年齡密切相關,主要困擾65歲以上人群的復雜疾病,PD因黑質中多巴胺能神經元的退化,導致紋狀體多巴胺(DA)水平下降,從而引發了一系列運動和非運動障礙。過往的治療多圍繞藥物緩解癥狀展開,卻難以從根本上解決問題。
相比之下,治療帕金森病的細胞療法旨在為患者提供長期癥狀緩解并替換退化的神經元。
已研究了四種類型的干細胞用于治療帕金森病:間充質干細胞 (MSC)、神經干細胞 (NSC)、誘導性多能干細胞 (iPSC) 和胚胎干細胞 (ESC) 。其中,MSC因其多能性、免疫調節作用、自我更新能力、遷移能力、長期存活和沒有倫理問題而具有獨特的優勢。
但不可忽視的是,基于間充質干細胞治療帕金森病的療法面臨著諸多阻礙,從技術層面到安全性考量都有待完善。
基于間充質干細胞治療帕金森病:未來這些經過處理改造的方法,很關鍵!
近日,醫學雜志《Stem Cell Research & Therapy》發表了一篇“經處理的間充質干細胞療法在治療帕金森病中的應用”的期刊綜述,在這篇綜述文章中,我們評估了這些改進間充質干細胞治療帕金森病的方法。

本文獻綜述著重圍繞經改造的間充質干細胞在治療帕金森病中的應用展開(圖1),力求在重重困難中找尋其突破的路徑,為改善帕金森病治療現狀貢獻力量。
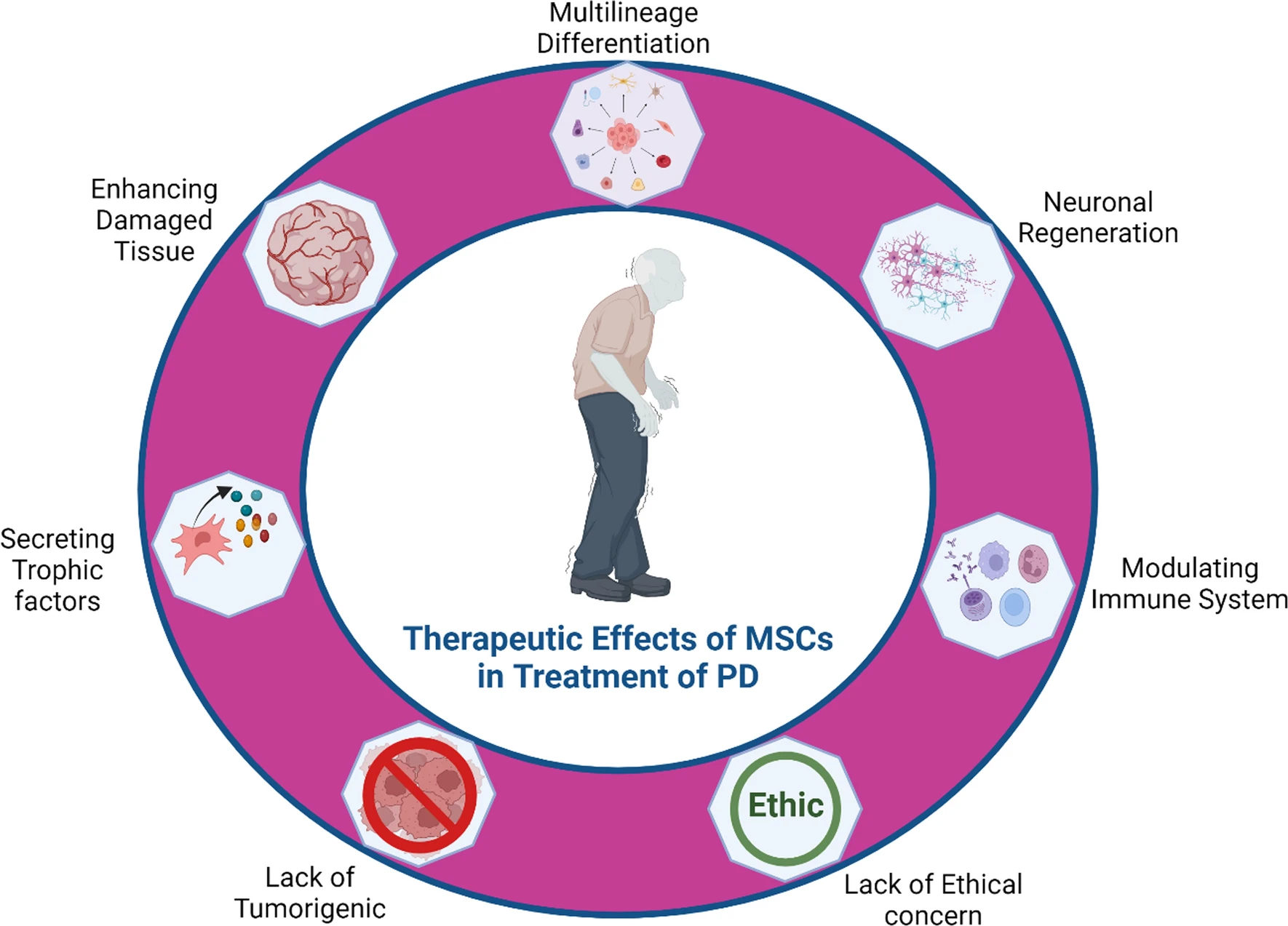
MSC分泌營養因子和細胞因子,有助于組織修復和再生。它們還通過與免疫細胞相互作用和調節抗炎作用來調節免疫系統,并促進神經發生,這有助于失去的神經元的功能恢復,而不會引起PD患者的倫理問題和致瘤方面的問題。
間充質干細胞治療帕金森病的臨床前研究簡要概述
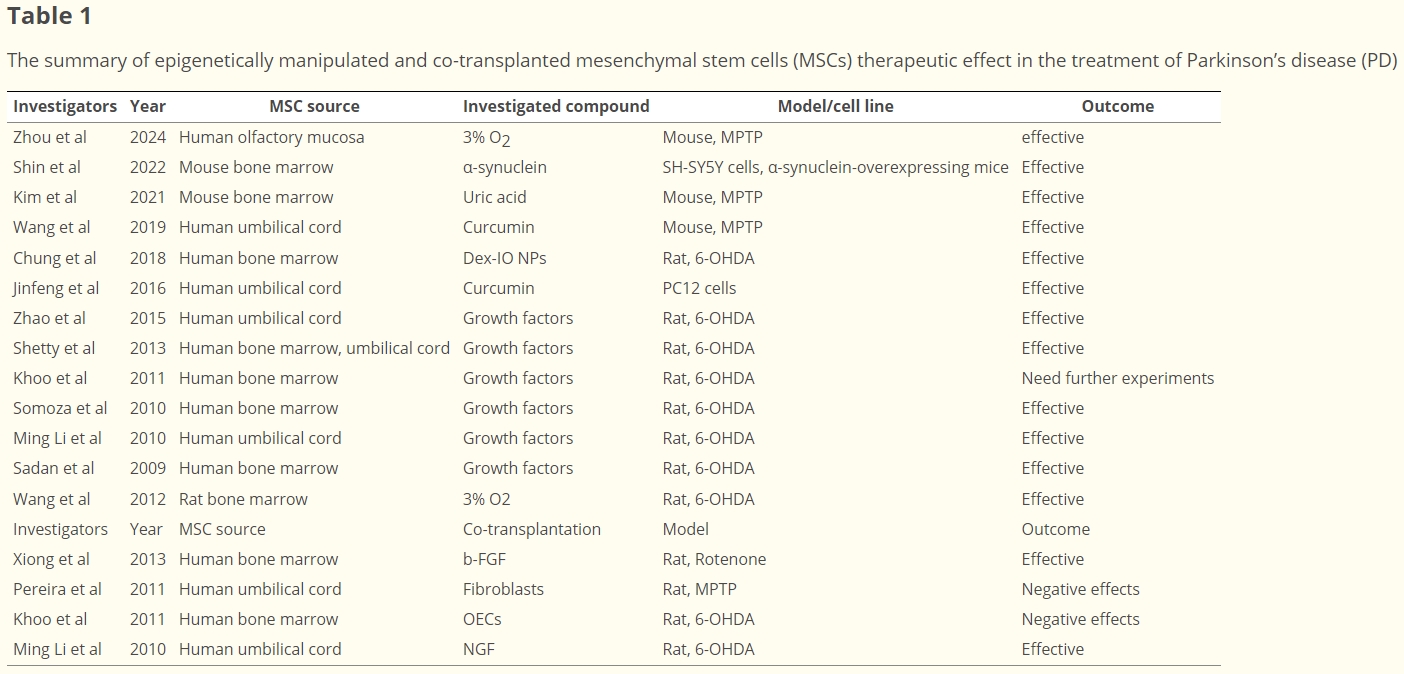
- 骨髓間充質干細胞(BMSC)在小鼠模型中的應用:2001年,Li等選用成年雄性C57BL/6小鼠的骨髓間充質干細胞(BMSC)對MTPT帕金森病模型展開治療。通過立體定向手術將BMSC注入小鼠紋狀體,在移植一個月后,這些細胞呈現出酪氨酸羥化酶(TH)免疫反應性,同時小鼠的行為與神經功能均得到改善和恢復。
- BMSC在大鼠模型中的應用及分化誘導:2004年,Dewaza等先是通過轉染 Notch胞內結構域(NICD)基因,并結合堿性成纖維細胞生長因子(bFGF)、福斯高林和睫狀神經營養因子等營養因子對大鼠和人類BMSC進行處理,使其分化為功能性多巴胺能神經元,隨后通過紋狀體內途徑將其注射到6-羥基多巴胺(6-OHDA)帕金森病大鼠模型中,最終實現了對運動行為的改善。
間充質干細胞發揮治療帕金森病的相關作用機制探究
抗炎細胞因子的作用:Kim等人通過研究發現,MSCs的治療效果與分泌組中的抗炎細胞因子密切相關。該研究采用抗炎途徑,證實了人類骨髓間充質干細胞(hBMSCs)對多巴胺能系統具備保護作用。
不同來源間充質干細胞及多種給藥途徑的嘗試
- 人類MSC在6-OHDA動物模型中的紋狀體內注射:Blandini及其同事在6-OHDA動物模型中進行人類MSC的紋狀體內注射,結果顯示移植后MSCs能夠存活下來,并且整合到病變區域,減輕了損傷,最終呈現出明顯的治療效果。
- 大鼠BMSC靜脈注射:Ahmed等人的研究表明,在魚藤酮PD動物模型中,采用靜脈(IV)注射大鼠BMSC的方式,使得巢蛋白基因表達增加,同時腦內酪氨酸羥化酶(TH)和多巴胺(DA)水平也有所升高。
- 鼻腔內注射MSC的探索:Salama等人針對通過鼻腔內(IN)注射魚藤酮建立的大鼠模型,注射了莫里尼克微米氧化鐵(MPIO)標記的MSCs。經過神經行為評估發現治療組有所改善,而且普魯士藍染色呈陽性,意味著MSCs已成功輸送至腦部,減少了多巴胺能神經元的退化。
2010-2022年期間:間充質干細胞治療帕金森病的臨床試驗簡要概述
2010年,Venkataramana在印度開展了一項研究項目,通過將患者自身的骨髓細胞直接移植到大腦的側腦室下區,測試了PD的干細胞療法。在7名患者中,有3名在10至36個月的隨訪期內通過統一PD評分量表 (UPDRS)、Schwab和England (S&E) 量表以及Hoehn和Yahr (H&Y) 量表評估運動能力有所改善。此外,兩名患者顯著減少了左旋多巴的劑量。該治療似乎是安全的,整個過程中沒有出現重大并發癥。
2011年,Qiu等人通過頸動脈注射向8名確診為PD的患者(4名男性和4名女性)注射了人臍帶間充質干細胞 (hUC-MSC)。治療一個月后,患者的UPDRS評分下降,表明震顫和僵硬等癥狀有所改善。這項研究沒有觀察到副作用。
2014年,Wang等人對15名PD患者進行了hUC-MSC移植。研究指出,移植一個月后癥狀緩解,且沒有重大副作用,表明干細胞療法具有潛在益處。
2016年,Canesi等人探索了MSC療法治療進行性核上性麻痹 (PSP) 的療效,PSP是帕金森病的一種變體,目前尚無有效的治療干預措施。五名患者接受了來自骨髓的MSCs,并將其注入腦動脈。除一名死于跌倒的患者外,所有患者都保持穩定或表現出運動和平衡等運動功能有所改善。
同樣在2016年,一項有限的研究通過靜脈注射了同種異體hUC-MSCs給五名PD患者。這導致三名患者的UPDRS評分在三個月內得到臨床改善。
2020年,Boika及其同事在一項有限的研究中招募了12名PD患者,其中自體骨髓衍生的MSCs通過靜脈和鼻腔內注射。治療后一個月和三個月時觀察到運動和非運動癥狀均顯著改善。
2021年,Schiess等人在20名PD參與者中評估了同種異體hBMSCs的安全性和潛在益處。該研究根據細胞治療后一年隨訪期的UPDRS結果證實了同種異體間充質干細胞的益處。
2022年初,Shigematsu等人在三名PD患者中重復靜脈輸注自體脂肪干細胞 (ADSC) 五到六次。在六個月的觀察期內,未報告任何不良副作用,所有參與者的運動能力均有所改善(圖2)。
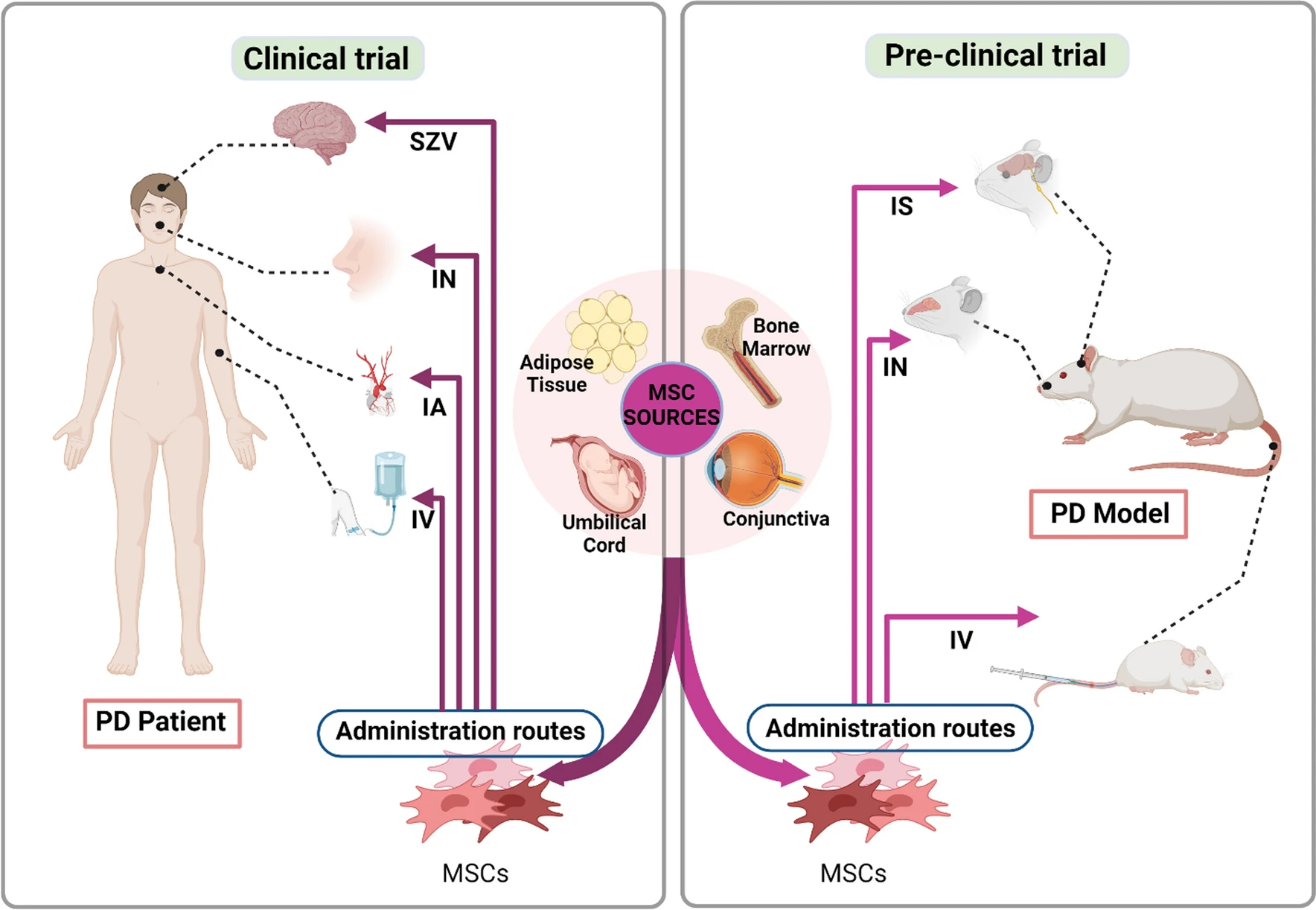
各種臨床前和臨床研究都調查了 MSC治療的安全性和有效性。MSC已從骨髓、臍帶、脂肪組織和結膜等各種來源分離出來,并通過不同的給藥途徑給藥,例如在PD動物模型中通過紋狀體內 (IS)、鼻內 (IN) 和靜脈內 (IV) 給藥,在PD患者中通過側腦室下區 (SVZ)、動脈內 (IA)、靜脈內 (IV) 和鼻內 (IN) 給藥
一、帕金森病相關轉錄因子作為一種有前景的治療策略
了解與PD相關的復雜分子因素可為研究人員提供精確的線索和新見解,以操縱MSCs,特別是在表觀遺傳和遺傳水平,以產生多巴胺能神經元并減緩疾病進展。
首先,一些轉錄因子與多巴胺能神經元產生密切相關。
- 像ASCL1、FOXA2、PITX3、LMX1A,在經Metadichol處理的人類真皮成纖維細胞中表達顯著增加,且參與多巴胺能神經元的產生。NURR1可調節多巴胺合成和儲存關鍵基因表達,與FOXA2協同作用能增強PD小鼠模型中多巴胺能神經元的存活率,FOXA2作為輔助激活因子可放大 NURR1 的作用。Pitx3對中腦多巴胺能神經元發育、終末分化及維持很關鍵,不過PD患者體內其表達明顯降低,且基因變異與相關帕金森病類型有關。
其次,部分轉錄因子在PD發病機制及影響神經元存活方面有重要作用。
- 例如P53在細胞應激源(如線粒體功能障礙、氧化應激)作用下被激活,PD患者大腦中其與凋亡相關蛋白水平升高,針對它治療有望減少神經元丟失。DLX1與NuRD復合物成分相互作用,影響染色質重塑和基因抑制,其表達變化關乎多巴胺能神經元存活,NuRD的表觀遺傳調控作用影響PD神經退行性進展。KLF7對神經元正常發育重要,促進相關轉錄,支持神經元健康和發育,可能影響PD疾病情況。
綜上所述,這些轉錄因子在PD的發生發展過程中有著不同程度的影響,基于它們來優化MSC功能,或許能為PD的治療干預開辟一條全新且有效的途徑,為眾多PD患者帶來新的希望。
二、利用生長因子、生物制劑、缺氧和基因工程對MSCs進行操作
MSCs的操作和預激活是解決干細胞治療中遇到的挑戰的戰略方法,例如移植效果差、存活率低以及在年齡、疾病和免疫反應等各種宿主條件下療效有限。這些預激活策略旨在增強移植后MSCs的功能、活力、療效和疾病特異性,從而降低健康風險和相關成本。
可以使用各種化學、物理和生物制劑或通過特定條件對MSCs進行遺傳和表觀遺傳改造,以提高其療效和安全性。MSC可用于治療不同類型的疾病,包括神經退行性、自身免疫性、炎癥、皮膚、呼吸道、神經肌肉和血液系統疾病。
生長因子對MSCs的操作及影響
多種生長因子作用:用生長因子啟動MSCs能增強損傷和疾病愈合、促進血管生成等,改善其整體生物學功能。
- 例如,FGF-2可調節人牙髓來源MSCs中細胞因子和趨化因子表達,影響再生及治療潛力,在啟動MSC進行軟骨形成方面也有重要作用;
- TGF-α預處理MSC可改善缺血后心肌功能、減少炎性細胞因子產生;FGF-2、BMP-2和IGF-1等預先處理MSCs,能增強心臟轉錄因子表達,促進心肌源性分化,改善心肌損傷治療效果;同時向MSCs注射VEGF可降低細胞應激標志物,促進梗死心臟生長和存活;
- SDF-1預先激活MSCs能增加VEGF分泌,利于血管生成;
- KGF在用相關細胞因子預先激活后,對介導冷凍保存的無異種人類MSCs的保護作用很關鍵,有助于治愈特定損傷。
生物制劑對MSCs的操作及影響
草藥提取物及生物化合物作用:草藥提取物和生物化合物(如維生素E、姜黃素等)可增強MSCs對氧化應激的抵抗力并支持組織修復,提高其治療潛力。
缺氧對MSCs的操作及影響
缺氧預激活的優勢及機制:內源性MSCs天然微環境氧含量低,缺氧預激活可使MSCs保留干細胞特性,促進基因穩定性,增強旁分泌、增殖、存活、遷移和歸巢能力等,減少DNA損傷,還可導致表觀遺傳修飾,影響基因表達和功能特性。
基因工程對MSCs的操作及影響
操作方法分類:MSC的基因工程包括使用病毒(如慢病毒、逆轉錄病毒、腺病毒、腺相關病毒等)和非病毒(如電穿孔、核轉染、脂質聚合物劑、樹枝狀聚合物、無機納米顆粒等)方法修改其遺傳物質。
具體應用及效果:使用安全載體過表達粘附分子基因改造的MSC可加速傷口愈合并增強血管生成;經過基因改造表達生長因子的MSC,其相應因子產生和分泌增加,再生潛力提高,如表達hBMP-2的MSC可促進骨再生和修復;血管生成素修飾的MSCs在缺氧條件下存活率提高,能提高急性心肌梗死大鼠模型的存活率;表達多神經營養因子的 MSCs可實現神經元存活和軸突生長。
總之,通過上述不同方式對MSCs進行操作,能從多方面增強其功能、療效以及安全性等,使其在多種疾病的治療應用中發揮更大作用。
三、表觀遺傳操控間充質干細胞療法在帕金森病治療中的應用
缺氧預處理的人類嗅粘膜間充質干細胞治療帕金森病的應用
在2024年,Zhou等人開展的研究中:針對PD患者的臨床試驗:選取了5名年齡處于50至80歲、確診患有PD超過5年且Hoehn和Yahr分級為3或更高的志愿者,對他們實施鞘內注射來自自身嗅粘膜的自體人類嗅粘膜間充質干細胞(hOM-MSC)。
最終結果顯示,志愿者的運動功能、情緒以及日常活動都得到了改善,所需的左旋多巴口服維持劑量也顯著減少,并且在隨訪期間沒有發現嚴重不良事件。同時,腦脊液和血清分析表明,多巴胺、TGF-β1、IL-4以及IL-10的水平有所升高,而TNF-α 和IL-1β的水平則出現降低。
α-突觸核蛋白刺激MSC的應用
2022年Shin等人的研究發現:對MSC干性能力及相關調節的影響:利用α-突觸核蛋白刺激MSC,能夠上調如NANOG、八聚體結合轉錄因子4(OCT4)、Kruppellike因子4(KLF4)和神經源性位點Notch同源蛋白(Notch)等轉錄因子,以此增加其干性能力。而且這種刺激還增強了自噬調節微小RNA(miRNA),這些miRNA對于細胞健康和功能十分關鍵,特別是在PD這類神經退行性疾病中。
在細胞模型及小鼠模型中的作用體現:與未處理的幼稚MSC相比,在α-突觸核蛋白過表達的帕金森病細胞模型(SH-SY5Y細胞)中,經α-突觸核蛋白處理的MSC展現出更高的神經元活力,自噬標志物(如BECN1調節的自噬蛋白1(AMBRA1))也有所升高。將α-突觸核蛋白引發的MSC注射到α-突觸核蛋白過表達的PD小鼠模型中,能夠對多巴胺能神經元起到顯著的保護作用(表1)。
四、基因改造間充質干細胞在帕金森病治療中的應用
在2022年,Jiang等人開展的研究中:
基因改造及分化確認:對人臍帶間充質干細胞(hUC-MSC)進行基因改造,使其能夠表達腦源性神經營養因子(BDNF),以此增強治療潛力。隨后誘導這些經過基因改造的hUC-MSC分化為多巴胺樣神經元,并且確認了核受體相關因子1(Nurr1)以及酪氨酸羥化酶(TH)等神經元標志物的表達情況。
在大鼠PD模型中的效果:將改造后的干細胞移植到6-羥基多巴胺(6-OHDA)大鼠PD模型體內,結果顯示,大鼠紋狀體和黑質中的多巴胺(DA)濃度有所增加,同時這些改造的干細胞還發揮了神經保護作用,使得大鼠的運動功能得到了改善。
同樣在2022年,Li等人的研究情況如下:
基因改造內容:利用慢病毒載體對hUC-MSC進行改造,使其能夠合成參與多巴胺(DA)產生的三個關鍵基因,即酪氨酸羥化酶(TH)、GTP環水解酶1(GCH1)以及芳香族氨基酸脫羧酶(AADC)。其中,TH負責催化從氨基酸酪氨酸轉化生成左旋多巴(L-DOPA),AADC可將L-DOPA轉化為DA,而GCH1能夠產生四氫生物蝶呤,它是TH酶的輔因子。
在動物模型中的成效:當把這些經過改造的、能夠合成相關關鍵基因的干細胞(被稱為DOPA-MSC)移植到Sprague–Dawley大鼠以及恒河猴的PD模型體內時,觀察到紋狀體中的DA水平出現升高,并且動物的運動技能和相關癥狀也得到了長期的改善(圖3)(表2)。
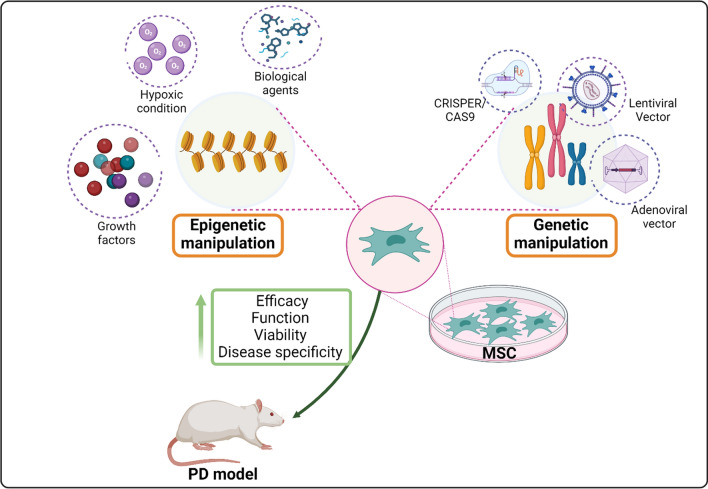
人們已經研究了各種方法,尤其是MSC的遺傳和表觀遺傳操作,用于治療PD。通過轉導各種基因進行遺傳操作,以及通過與生物制劑(如姜黃素和各種生長因子或缺氧條件)共培養進行表觀遺傳操作,可以改善其功能、移植的功效和安全性以及其在PD治療中的治療特性。
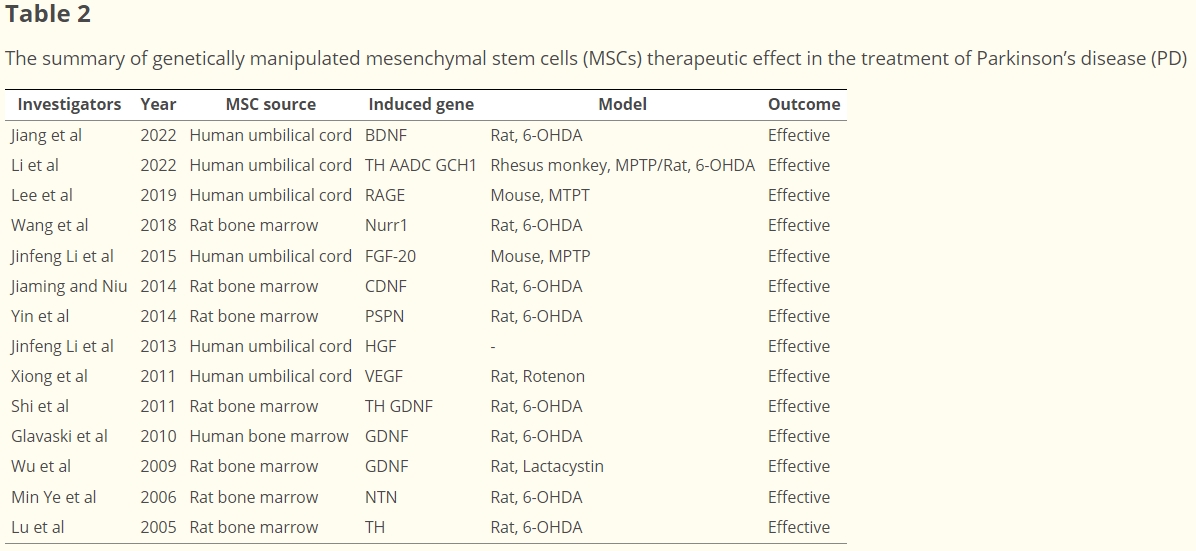
總體而言,通過對MSC進行不同方式的基因改造,并將其應用于PD動物模型中,都在一定程度上提高了模型體內多巴胺水平、改善了運動功能等,這為后續利用基因改造MSC治療PD的臨床研究提供了有價值的參考依據。
五、間充質干細胞聯合移植治療帕金森病
Pereira等人通過鼻腔內注射神經毒素MPTP誘導出實驗性PD模型。一周后進行細胞移植操作:
- 操作及目的:將人臍帶間充質干細胞(hUC-MSC)以及50%人臍帶間充質干細胞(UC-MSC)與50%成纖維細胞的混合物分別注入大鼠右紋狀體,旨在評估細胞純度在治療過程中的重要性。
- 結果呈現:在未混入成纖維細胞時,能觀察到UC-MSC移植產生的治療效果。
Xiong及其團隊圍繞堿性成纖維細胞生長因子(b-FGF)對人骨髓間充質干細胞(hBMSC)的影響展開研究,分體外和體內兩部分:
- 體外部分:將不同劑量(10、20、50和100ng/ml)的b-FGF與hBMSC共培養48小時,經MTT測定發現細胞的增殖和活力有顯著增加。
- 體內部分:進一步探究hBMSC與b-FGF共移植對魚藤酮誘發的PD大鼠模型的治療效果,結果顯示 hBMSC促進了神經分化,并且在行為評估中大鼠的旋轉次數有所減少。
總體來看,間充質干細胞聯合移植治療帕金森病的效果因聯合的細胞類型、具體操作方式等因素而有所不同,部分聯合方式能取得積極效果,如提高細胞存活率、促進神經分化、改善運動功能等,但也存在像引發炎癥反應、無法改善細胞存活與分化等情況,還需要進一步深入研究探索更有效的聯合移植策略。
結論
間充質干細胞具有獨特的特性,包括分泌營養因子、調節免疫系統、增強受損組織以及不存在倫理問題,因此作為一種再生醫學形式具有重大前景。然而,仍然存在一些挑戰,例如移植后存活率低、植入不良和生長動力學有限。
因此,以各種方式操縱MSCs對于克服這些障礙至關重要,使間充質干細胞的臨床應用更接近現實,特別是在治療帕金森病方面。
基于MSCs的治療方法有望為PD患者提供長期有效的癥狀緩解,甚至有可能從根本上修復受損的神經組織,改善患者的病情。這將極大地改善PD患者的生活質量,減輕社會的醫療負擔,為神經退行性疾病的治療開辟新的道路。
參考資料:Ekrani ST, Mahmoudi M, Haghmorad D, et al. Manipulated mesenchymal stem cell therapy in the treatment of Parkinson’s disease. Stem Cell Research & Therapy. 2024 Dec;15(1):476. DOI: 10.1186/s13287-024-04073-9. PMID: 39696636; PMCID: PMC11657756.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信