在當今醫學領域,慢性阻塞性肺疾病(COPD,簡稱慢阻肺)一直是全球范圍內的重大健康挑戰之一。傳統治療方法雖能在一定程度上緩解癥狀,但難以從根本上逆轉肺功能的持續下降。然而,隨著干細胞治療技術的不斷突破,這一局面有望被改寫。
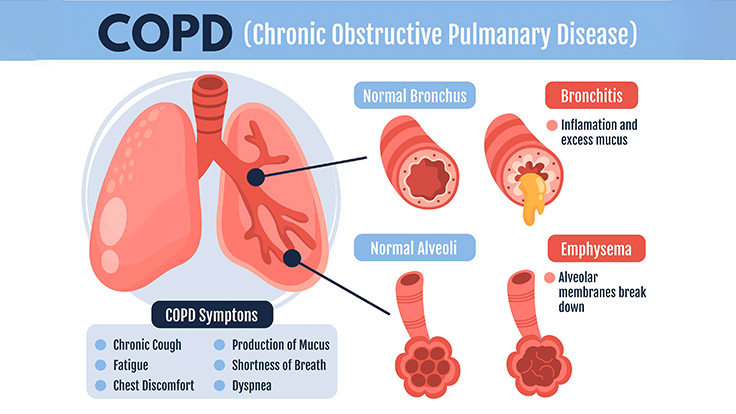
近年來,隨著再生醫學的發展,干細胞治療慢阻肺具有顯著的潛力和希望。這一顛覆性技術的背后仍存在關鍵問題:
那么,干細胞治療慢阻肺的肺功能改善能否轉化為長期運動能力提升?是什么機制和原理讓干細胞治療慢阻肺短期成效轉化為長期穩固?如何評估干細胞治療慢阻肺患者的短期療效和長期療效?免疫排斥與個體化差異如何影響療效持續性?本文基于臨床試驗數據,深度解析干細胞治療慢阻肺從短期的肺功能改善到長期的運動能力提升,為患者與醫療從業者提供科學決策依據。
干細胞治療慢阻肺的五大機制
一、抗炎與免疫調節作用
抑制過度炎癥反應
慢阻肺患者的肺部存在持續的炎癥反應,其中中性粒細胞、巨噬細胞和 T 淋巴細胞等免疫細胞會過度活化,并釋放大量促炎因子(如 TNF – α、IL – 6、IL – 8)。間充質干細胞(MSCs)等干細胞可通過分泌抗炎細胞因子(如 IL – 10、TGF – β),來抑制這些促炎因子的產生,同時還能調節免疫細胞的功能,進而減輕肺部的炎癥損傷。
調節免疫細胞功能
- T 細胞調節:干細胞能抑制 CD4? T 細胞的活化和增殖,促進調節性 T 細胞(Treg 細胞)的生成,從而糾正慢阻肺患者體內的 Th1/Th2 免疫失衡狀態。
- 巨噬細胞極化:促使促炎型巨噬細胞(M1 型)向抗炎型巨噬細胞(M2 型)轉化,以此降低肺部的炎癥水平并促進組織修復。
二、促進肺組織修復與再生
細胞分化與替代
干細胞具有多向分化潛能,在特定微環境下,間充質干細胞、肺干細胞等有可能分化為肺泡上皮細胞(如 Ⅰ 型和 Ⅱ 型肺泡細胞)或氣道上皮細胞,進而替代受損或凋亡的肺細胞,修復慢阻肺造成的氣道和肺泡結構破壞。
旁分泌效應介導修復
干細胞可分泌多種生長因子和細胞因子,通過旁分泌途徑發揮作用:
- 表皮生長因子(EGF)和成纖維細胞生長因子(FGF):能夠促進氣道上皮細胞的增殖和遷移,加速氣道黏膜的修復。
- 血管內皮生長因子(VEGF):可促進肺血管新生,改善慢阻肺患者肺部的微循環障礙。
- 肝細胞生長因子(HGF):具有抗凋亡和促進肺泡上皮修復的作用,有助于恢復肺泡的正常功能。
三、抗肺纖維化作用
慢阻肺患者的肺部會出現異常的纖維化反應,成纖維細胞過度活化,細胞外基質(如膠原蛋白)過度沉積。干細胞可通過以下途徑發揮抗纖維化作用:
- 抑制成纖維細胞的增殖和活化,減少膠原蛋白的合成。
- 促進纖維化相關細胞(如肌成纖維細胞)的凋亡,從而減輕肺組織的纖維化程度。
- 調節基質金屬蛋白酶(MMPs)及其抑制劑(TIMPs)的平衡,降解過度沉積的細胞外基質。
四、抗氧化應激作用
氧化應激在慢阻肺的發生和發展過程中起著重要作用,會導致肺組織損傷。干細胞能夠分泌抗氧化酶(如超氧化物歧化酶 SOD),清除體內的活性氧(ROS),減輕氧化應激對肺細胞的損傷,保護肺組織免受氧化損傷。
五、改善肺功能的潛在機制
通過上述多種機制的綜合作用,干細胞治療可能會帶來以下肺功能改善:
- 減輕氣道炎癥和重塑,緩解氣道阻塞,使 FEV1(第一秒用力呼氣容積)等肺功能指標得到改善。
- 修復肺泡結構,增加肺泡表面積,提高氣體交換效率,從而改善患者的缺氧狀態。
- 抑制肺纖維化,延緩肺功能的進行性下降,提高患者的生活質量。
干細胞治療慢阻肺的機制具有多靶點、多途徑的特點,主要通過抗炎、免疫調節、組織修復、抗纖維化和抗氧化應激等作用來改善肺組織損傷和功能。盡管目前該領域仍面臨諸多挑戰,但干細胞治療為慢阻肺的治療提供了新的思路和希望。
評估干細胞治療慢阻肺患者的短期療效和長期療效的標準是什么?
一、短期療效評估標準(治療后 1~12個月)
短期療效主要關注治療后短期內癥狀改善、炎癥控制、肺功能急性變化及安全性。
1. 臨床癥狀改善
- 呼吸困難程度:采用 ** 改良版英國醫學研究委員會呼吸困難量表(mMRC)** 評估,觀察患者活動后氣短癥狀是否減輕(如從量表 3 級降至 2 級)。
- 咳嗽、咳痰頻率及痰量:通過患者日記或問卷記錄癥狀頻率和嚴重程度的變化。
- 急性加重頻率:治療后短期內(如 3 個月)急性加重次數是否減少(需與治療前基線對比)。
2. 肺功能指標
- 第一秒用力呼氣容積(FEV?)和用力肺活量(FVC):通過肺功能儀檢測 FEV?、FVC 及其占預計值百分比(FEV?% pred),短期療效可能表現為 FEV?絕對值或占預計值比例的輕度提升(需排除測量誤差)。
- FEV?/FVC 比值:反映氣流受限程度,短期可能無顯著變化,但炎癥減輕可能延緩比值下降趨勢。
- 氣道阻力或肺順應性:通過脈沖振蕩肺功能檢測,評估氣道阻塞或肺彈性的短期改善。
3. 炎癥與免疫指標
- 血液 / 痰液炎癥因子:檢測促炎因子(如 TNF-α、IL-6、IL-8)和抗炎因子(如 IL-10、TGF-β)水平,評估干細胞的抗炎效應。
- 免疫細胞表型:如調節性 T 細胞(Treg)比例、M2 型巨噬細胞極化程度,反映干細胞的免疫調節作用。
- C 反應蛋白(CRP)和降鈣素原(PCT):非特異性炎癥標志物,短期下降提示全身炎癥減輕。
4. 影像學評估
- 胸部 CT 定量分析:
- 肺氣腫程度:通過低衰減區(LAA)百分比評估肺泡破壞改善情況。
- 氣道壁厚度:評估氣道重塑是否減輕(如支氣管壁面積與管腔面積比下降)。
- 肺灌注顯像:利用核醫學技術評估肺部血流分布,短期可能顯示局部灌注改善。
5. 運動耐力與生活質量
- 6 分鐘步行試驗(6MWT):步行距離增加≥30 米通常被視為運動耐力改善的臨床顯著標準。
- 生活質量問卷:采用圣喬治呼吸問卷(SGRQ)或COPD 評估測試(CAT),評分降低≥2 分提示生活質量短期改善。
二、長期療效評估標準(治療后 1 年以上)
長期療效聚焦于疾病進展延緩、急性加重頻率降低、肺功能衰退速率變化及生存獲益。
1. 肺功能長期變化
- FEV?年下降率:對比治療前后 FEV?的年度下降速率,理想療效為下降速率減緩(如從 – 50 mL / 年降至 – 30 mL / 年),提示疾病進展延緩。
- 肺氣腫或肺纖維化進展:通過每年胸部 CT 隨訪,觀察肺組織破壞(如肺氣腫范圍)或纖維化程度是否穩定或減輕。
2. 急性加重與臨床結局
- 急性加重頻率及嚴重程度:治療后每年急性加重次數減少≥50%,或中重度急性加重(需住院治療)次數顯著降低。
- 住院率與死亡率:長期隨訪中,全因住院率下降或生存期延長(如 5 年生存率提高)是關鍵療效終點。
3. 結構修復與再生證據
- 肺泡 / 氣道上皮再生標志物:檢測克拉拉細胞蛋白(CC16)、表面活性蛋白(SP-A/SP-D)等,提示氣道或肺泡上皮修復。
- 肺組織活檢(如有):通過病理染色觀察干細胞分化為肺細胞(如Ⅰ型 /Ⅱ型肺泡細胞)的證據,或纖維化組織減少、新生血管形成。
4. 生活質量與功能狀態
- 長期生活質量評分:SGRQ 或 CAT 評分持續改善并維持≥1 年,反映癥狀負擔和日常活動能力的持久提升。
- 呼吸困難慢性評估:mMRC 量表評分維持改善,或患者自述活動耐力(如爬樓梯層數)長期提高。
5. 安全性與遠期風險
- 致瘤性監測:定期影像學檢查(如全身 PET-CT)排除干細胞異常增殖或腫瘤形成(尤其是未分化干細胞的長期風險)。
- 免疫原性與慢性排斥反應:對于異基因干細胞治療,監測抗供體抗體或慢性炎癥反應(如間充質干細胞免疫原性低,長期排斥風險較小)。
干細胞治療慢阻肺:如何實現從短期的肺功能改善到長期的運動能力提升?
短期療效:肺功能和影像學檢查改善(1-12個月)
臨床案例一、
2015年9月5日,福建醫科大學在國內期刊《海峽藥學》上發布了一篇《干細胞移植治療慢性阻塞性肺病的臨床研究》的研究結果。【1】
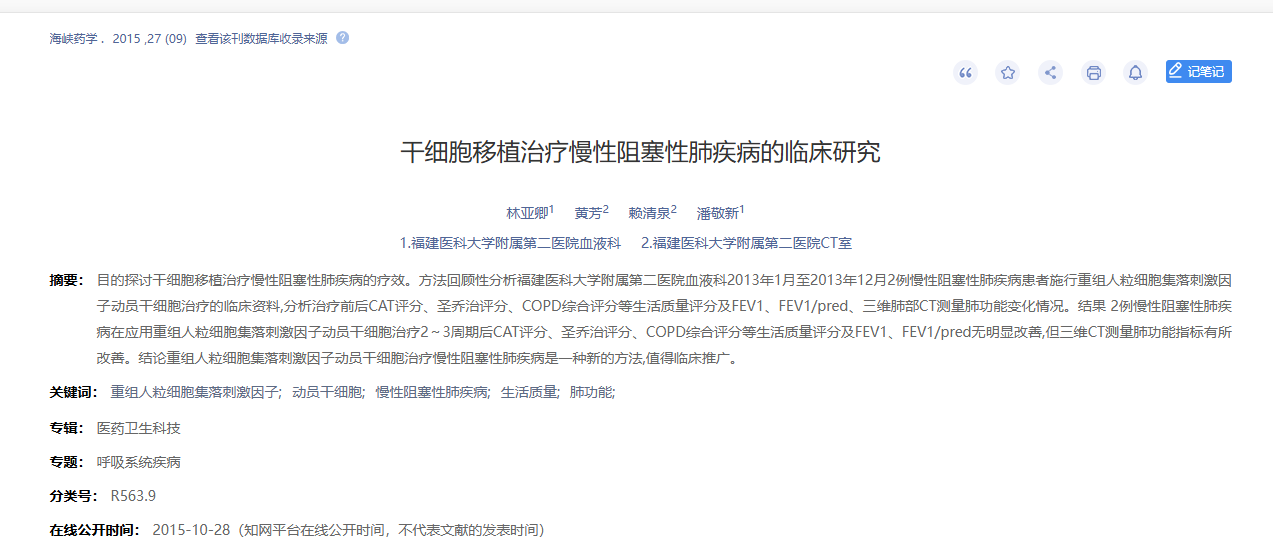
肺功能指標改善:2 例慢性阻塞性肺疾病在應用重組人粒細胞集落刺激因子動員干細胞治療 2 ~ 3 周期后 CAT 評分、圣喬治評分、COPD 綜合評分等生活質量評分及 FEV 1 、FEV 1 / pred改善程度較小。
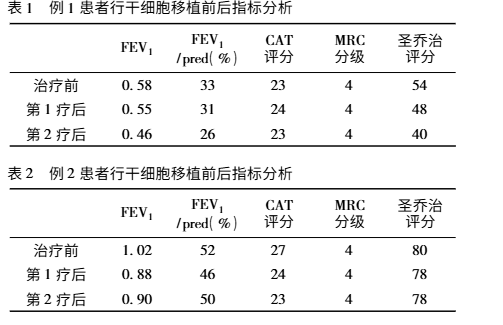
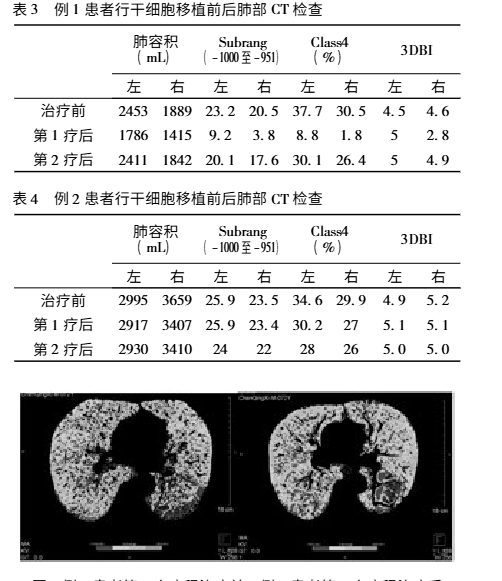
影像學檢查改善:CT 值在 - 1000 至 - 951 比例有所下降,Class4( % ) 亦明顯下降,故肺氣腫較治療前好轉。附圖為雙源 CT 肺實質分析軟件,深藍色表示 CT 值在 -1000 至 - 951,治療后較治療前深藍色面積明顯縮小。
安全性評估:未出現嚴重不良事件。
結論:干細胞治療前與治療后多次評估對比生活質量評分及傳統肺功能檢查指標,隨訪6個月左右,結果提示短期內生活質量評分及傳統肺功能檢查改善程度小,而應用肺部雙源 CT 定性及 CT 值定量分析肺功能提示治療后肺氣腫明顯好轉,未出現嚴重不良事件。可以達到干細胞治療慢阻肺短期療效的目標。
臨床案例二、
2024年2月14日,同濟大學醫學院附屬東方醫院在國際期刊《Translational Medical Sciences》上發布了一篇《P63 +肺祖細胞自體移植治療慢性阻塞性肺病》的研究結果。【2】

肺功能指標:細胞移植后 12 周,治療患者的中位 DLCO 從 2.73 mmol min 增加?1千帕斯卡?1[四分位距 (IQR),2.01 至 3.10] 基線至 3.34 mmol min?1千帕斯卡?1(IQR,2.40 至 3.75)。24 周時,中位 DLCO 維持在 3.20 mmol min?1千帕斯卡?1(IQR,2.15 至 3.79)。Cohen 的 d 值為 0.562(95% 置信區間,-0.123 至 1.248;P = 0.002) 在基線和 12 周 。
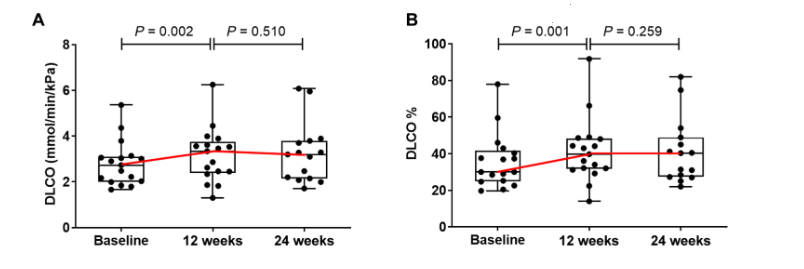
(A 和 B) 箱形圖描述了干預組中患者 DLCO 絕對值 (A) 和 DLCO% 預測值 (B) 隨時間的變化。
圣喬治呼吸問卷 (SGRQ):細胞移植后 12 周,患者的中位 SGRQ 評分為 53.3 (IQR, 28.0 至 64.0),與基線評分 51.3 (IQR, 37.5 至 66.2) 相似。在 24 周時,SGRQ 降至 44.2(IQR,22.3 至 65.5),基線和 24 周之間的 Cohen’s d 值為 -0.359(95% 置信區間,-1.048 至 0.329),表明 24 周時的生活質量有所改善。
6 分鐘步行距離 (6MWD) 測試:基線時患者的中位 6MWD 為 410 m (IQR,345 至 458),細胞移植后 12 周為 399 m (IQR,255 至 540)。在 24 周時,中位 6MWD 增加到 447 m(IQR,309 至 526),Cohen 的 d = 0.271(95% 置信區間,-0.460 至 1.003)
影像學檢查:對于患者 #2902,定量分析顯示基線時總體肺氣腫面積比為 12.75%,移植后 24 周降至 10.02%。在患者 #8009 中,肺氣腫面積比值從基線的 10.85% 下降到移植后 12 周的 9.08%。CT 圖像的三維可視化顯示,肺氣腫的減輕在下葉比在上葉更明顯。
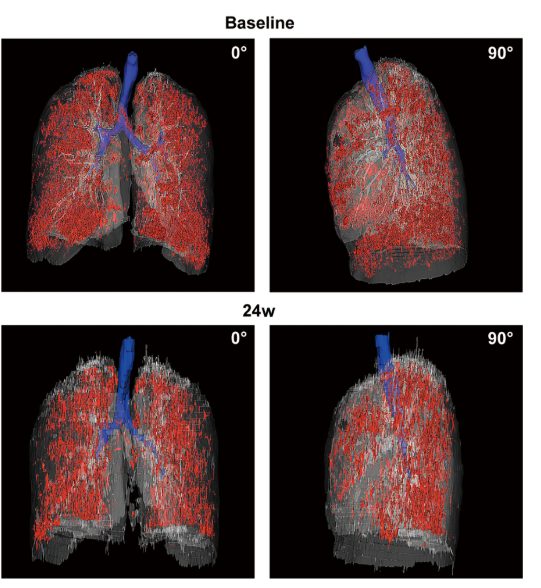
安全性評估:胸部連續 CT 掃描在 4 、 12 和 24 周后未發現任何患者出現惡性腫瘤、新病理或腫瘤形成的跡象。在隨訪期間,任何組均未發生 3 至 5 級不良事件 (AEs)。
結論:干細胞治療24周后,慢阻肺患者的肺功能指標、影像學檢查、生活質量和運動功能均得到改善,且未發生腫瘤或其他嚴重不良事件。可以達到干細胞治療慢阻肺短期療效的結果。
長期療效:運動能力和生活質量改善(12個月以上)
臨床案例三、
2020年1月,土耳其科蓋布澤醫療園區醫院在國際期刊《Bratislava Medical Journal》上發布了一篇《間充質干細胞對慢性阻塞性肺病癥狀的改善作用》的研究結果。【3】
患者在接受 UCTD MSC 治療前,進行了呼吸功能測試、SGRQ 癥狀、活動和影響評分以及 6 分鐘步行測試 (6MWT)。所有患者均通過靜脈輸注共 4 劑 UCTD MSC,間隔兩周。所有測試均在治療三個月后重復進行,以評估 MSCs 治療的效果。

肺功能和臨床癥狀改善:5例患者接受MSCs治療前,平均FEV1/FVC值為66.9%,治療后平均FEV1/FVC值升?69.58%。
生活質量和運動能力改善:治療后SGRQ癥狀、活動和影響評分平均值分別為39.8、60.98和45.18。根據六分鐘步?測試結果,患者在MSCs治療前的平均步?距離為307?,?治療后,患者的平均步?距離提?到362?。
安全性評估:未見嚴重不良事件。
結論:這項1/2期臨床研究表明,共4劑臍帶組織來源(UCTD)MSC治療可能有助于緩解COPD患者的癥狀嚴重程度。此外,呼吸功能測試、SGRQ癥狀、活動度及影響評分以及6分鐘步?測試(6 MWT)是COPD患者治療前癥狀嚴重程度評估的有效?具,試驗過程中未見嚴重不良事件。可以達到干細胞治療慢阻肺長期療效的目標。
臨床案例四、
2021年4月28日,越南河內醫科大學在國際期刊《Respirology Case Reports》上發布了一篇《自體脂肪干細胞療法治療慢性阻塞性肺病:一例病例報告》的研究結果。【4】

運動能力和生活質量的變化:值得注意的是,接受ADSCs治療后6個月和12個月,患者的呼吸困難和生活質量均有所改善。6MWT在6個月和12個月的隨訪中有所增加。同時,CRP幾乎沒有變化。肺功能在12個月的隨訪中略有改善。該患者在一年的隨訪中沒有出現任何急性加重。

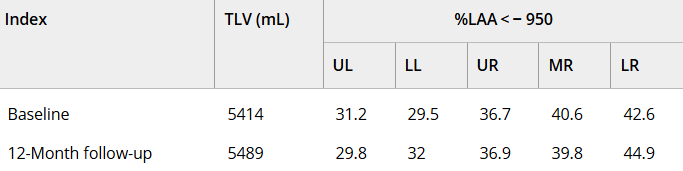
影像學檢查:隨訪12個月時,定量胸部CT掃描示患者吸入總肺容積略有增加,肺氣腫指數無明顯變化。支氣管壁厚度(WT)的變化以WT、壁面積(WA)及WA百分比(%WA)的減少,以及支氣管內徑(ID)和管腔面積(LA)的增大來評估。
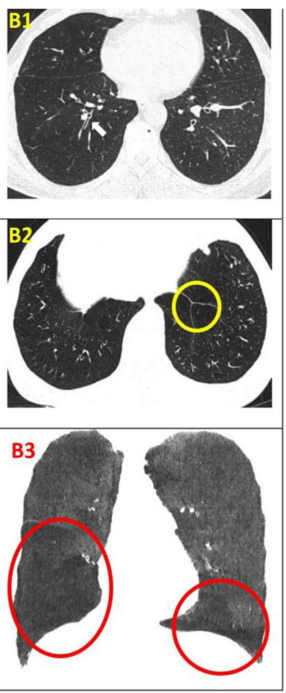
干細胞治療一年后,雙肺RB1和RB10的WT均減少,LA增加(粗體指數)。
安全性評估:未出現嚴重不良事件。
結論:自體脂肪組織干細胞移植在改善COPD患者的呼吸困難和生活質量方面是安全有效的。可以達到干細胞治療慢阻肺長期療效的目標。
有哪些因素會影響干細胞治療慢阻肺的療效?
干細胞治療慢性阻塞性肺疾病(COPD)的療效受多種因素影響,涉及干細胞特性、患者個體差異、治療方案設計及體內微環境等多個層面。
一、干細胞自身特性
1. 干細胞來源與類型
- 間充質干細胞(MSCs):
- 來源差異:骨髓、脂肪、臍帶、胎盤等來源的 MSCs 功能存在異質性。例如,臍帶 MSCs免疫原性更低、增殖能力更強,且分泌的抗炎因子(如 IL-10、HGF)水平高于骨髓來源 MSCs。
- 分化潛能:肺部微環境可誘導 MSCs 向肺泡上皮細胞(如 Ⅱ 型肺泡細胞)或氣道上皮細胞分化,但不同來源 MSCs 的分化效率不同(如胎盤 MSCs 向肺細胞分化的標志物表達更高)。
- 誘導多能干細胞(iPSCs):理論上可分化為肺泡祖細胞,但存在致瘤性風險,且免疫排斥反應需通過基因編輯解決(如 HLA 匹配)。
- 胚胎干細胞(ESCs):因倫理限制和免疫原性問題,臨床應用受限。
2. 細胞代數與活性
- 傳代次數:低代數(如 P3-P5)MSCs 分泌的旁分泌因子(如血管內皮生長因子 VEGF、表皮生長因子 EGF)更豐富,免疫調節能力更強;高代數細胞可能出現衰老,療效下降。
- 預處理優化:通過低氧培養、細胞因子刺激(如 IFN-γ、TNF-α)或基因修飾(過表達 HIF-1α 增強耐缺氧能力)可提升 MSCs 在肺內的存活率和修復功能。
3. 細胞劑量與給藥次數
- 劑量依賴性:動物實驗顯示,低劑量 MSCs(如 1×10? cells/kg)可能不足以抑制炎癥,而高劑量(如 5×10? cells/kg)可顯著減少肺泡破壞,但需警惕過度免疫抑制風險。
- 重復給藥:分次給藥(如間隔 4 周注射 2 次)可能比單次給藥更有效,因 MSCs 在體內存活時間有限(通常 7-14 天),重復輸注可維持持續的旁分泌效應。
二、患者個體差異
1. COPD 病情階段與嚴重程度
- 急性加重期 vs 穩定期:
- 急性加重期肺部炎癥微環境(高濃度 ROS、促炎因子)可能加速 MSCs 凋亡,而穩定期炎癥負荷較低,MSCs 更易定植并發揮修復作用。
- 研究表明,穩定期患者接受 MSCs 治療后 FEV?改善率(約 15%)顯著高于急性加重期(約 5%)。
- 肺氣腫表型 vs 慢性支氣管炎表型:肺氣腫患者肺泡破壞更嚴重,需依賴 MSCs 的分化潛能修復肺泡;而慢性支氣管炎患者更需 MSCs 抑制氣道炎癥,兩者療效可能存在差異。
2. 年齡與基礎健康狀態
- 衰老相關影響:老年患者體內氧化應激水平高、干細胞歸巢能力下降,且肺組織中 SASP(衰老相關分泌表型)因子(如 IL-6、MCP-1)可能抑制 MSCs 功能。
- 合并癥:糖尿病患者高血糖環境可降低 MSCs 活性;吸煙史長的患者肺部微環境更惡劣,影響 MSCs 存活。
3. 免疫狀態與遺傳背景
- 免疫功能紊亂:T 細胞功能缺陷患者(如長期使用糖皮質激素)可能削弱 MSCs 的免疫調節作用;HLA 配型不匹配可能導致異基因 MSCs 被排斥(盡管 MSCs 免疫原性低,但仍有部分患者產生抗供體抗體)。
- 基因多態性:患者自身基因(如 CXCR4 基因變異影響 MSCs 歸巢,IL-10 基因啟動子多態性影響抗炎反應)可能導致療效差異。
三、治療方案設計
1. 給藥途徑
- 靜脈注射:操作簡便,但 MSCs 易被肺毛細血管截留(約 80% 細胞滯留肺部),適用于全身炎癥調控,但局部濃度可能不足。
- 霧化吸入:直接作用于氣道,提升肺部定植效率(如豬模型中霧化給藥的肺部細胞回收率比靜脈高 3 倍),但需解決細胞在霧化過程中的損傷問題。
- 支氣管鏡局部注射:精準定位至病變肺段,適用于局限性肺氣腫,但屬于有創操作,可能引發氣道損傷。
2. 聯合治療策略
- 與藥物聯用:
- 抗纖維化藥物(如吡非尼酮)可改善肺纖維化微環境,增強 MSCs 定植;
- 吸入性糖皮質激素可能抑制 MSCs 的免疫調節功能,需謹慎聯用。
- 物理干預輔助:高壓氧治療可提升肺部氧分壓,減少 MSCs 凋亡;肺康復訓練可增強治療后肺功能改善的持續性。
四、體內微環境因素
1. 肺部炎癥與氧化應激
- 促炎因子干擾:COPD 患者肺泡灌洗液中 TNF-α、IL-8 濃度高,可誘導 MSCs 向促炎表型(M1 型巨噬細胞樣)極化,抵消其修復作用。
- 氧化損傷:高濃度 ROS(如香煙煙霧誘導)可破壞 MSCs 膜結構,降低其分泌 VEGF、HGF 等修復因子的能力。
2. 組織損傷程度與修復能力
- 肺泡隔破壞程度:重度肺氣腫患者肺泡數量減少>50%,MSCs 難以通過分化完全重建肺泡結構,療效受限;輕度患者可能通過旁分泌促進現存肺泡修復。
- 內源性干細胞功能:COPD 患者肺內 resident 干細胞(如肺上皮祖細胞)數量減少或功能異常,可能影響 MSCs 的 “旁觀者效應”(如通過分泌 Wnt 信號激活內源性修復)。
總結
隨著干細胞治療技術在慢阻肺領域的不斷探索與突破,我們看到了從短期肺功能改善邁向長期運動能力提升的曙光。多項臨床研究表明,干細胞治療不僅能顯著提升患者的肺功能指標,如一氧化碳彌散量(DLCO)和用力呼氣量(FEV1),還能有效延長患者的6分鐘步行距離,顯著改善其生活質量。
未來,隨著技術的進一步成熟和臨床應用的拓展,干細胞治療有望為慢阻肺患者帶來更加持久和全面的康復效果,幫助他們重獲自由呼吸與活力生活的權利。
參考資料:
1、林亞卿,黃芳,賴清泉,等.干細胞移植治療慢性阻塞性肺疾病的臨床研究[J].海峽藥學,2015,27(09):131-133.
2、Yujia Wang et al. ,Autologous transplantation of P63+ lung progenitor cells for chronic obstructive pulmonary disease therapy.Sci. Transl. Med.16,eadi3360(2024).DOI:10.1126/scitranslmed.adi3360
3、Karaoz E, Kalemci S, Ece F. Improving effects of mesenchymal stem cells on symptoms of chronic obstructive pulmonary disease. Bratisl Lek Listy. 2020;121(3):188-191. doi: 10.4149/BLL_2020_028. PMID: 32115975.
4、Nguyen TT, Phan PT, Nguyen BH, Vu TTT, Pham PC, Van Vu G, Nguyen KB, Vu TT, Vu LD, Ngo CQ. Autologous adipose-derived stem cells therapy in COPD treatment: a case report. Respirol Case Rep. 2021 Apr 28;9(5):e00748. doi: 10.1002/rcr2.748. PMID: 33959296; PMCID: PMC8080283.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。
版權說明:本文來自杭吉干細胞科技內容團隊,歡迎個人轉發至朋友圈,謝絕媒體或機構未經授權以任何形式轉載至其他平臺,轉載授權請在網站后臺下方留言獲取。




 掃碼添加微信
掃碼添加微信