干細胞定義與分類:干細胞是生物系統中的基礎祖細胞,能夠分化成各種具有特定功能的分化細胞。這些未分化細胞具有獨特的自我更新和多向分化能力,在生理適宜條件或受控的實驗環境下,它們可以增殖并分化成組織生成、修復和細胞穩態所需的各種特化細胞類型。
在體內或實驗室的受控條件下,干細胞分裂形成更多被稱為“子”細胞的細胞。這些子細胞要么成為新的干細胞,要么在分化階段之后,成為具有更特定功能的特化細胞。

根據來源,干細胞可分為以下兩大類。
- (1) 胚胎干細胞:這些是全能干細胞,這意味著它們可以分裂成更多干細胞或成為體內任何類型的細胞。
- (2) 成體干細胞:這些干細胞少量存在于大多數成體組織中,例如骨髓或脂肪。與胚胎干細胞相比,成體干細胞產生各種體細胞的能力更為有限。
修復受損器官的兩種醫療策略:目前,醫療實踐中修復受損器官或組織主要有兩種方法。
- 器官移植:第一種方法是通過移植完全替換受損器官。器官移植通常依賴于捐贈者的可用性和兼容性,因此受到捐贈者短缺、免疫排斥風險以及需要終生接受免疫抑制治療以防止排斥和確保成功整合等限制。
- 細胞療法:第二種方法是將細胞植入受損器官或組織,這種技術稱為細胞療法。這些細胞旨在部分或完全恢復受損器官的功能。細胞療法可以使用干細胞、祖細胞或分化細胞,具體取決于受損組織的具體需求和特性。干細胞尤其具有顯著的再生潛力,因為它們具有增殖和分化成各種細胞類型的能力。
治療策略選擇依據與脂肪干細胞的醫學價值
這兩種治療策略之間的選擇取決于多種因素。這些因素包括器官的類型和解剖復雜程度、其通過駐留干細胞進行自我修復的內在能力,以及損傷的嚴重程度、性質和范圍。肝臟等再生潛力較高的器官可能需要侵入性較小的方法,更有效地依靠細胞治療技術。
相反,心臟或腎臟等再生能力有限或沒有再生能力的器官可能需要完全移植或旨在刺激再生的先進細胞療法。此外,決策過程必須考慮患者的具體因素,例如年齡、整體健康狀況以及與每種治療方式相關的潛在風險或并發癥。
隨著干細胞技術的發展和應用,干細胞研究日益深入,治療數量每年都在快速增加,但缺乏關于其適應癥的循證數據。干細胞可用于改善醫療保健,無論是通過增加人體的再生潛力還是通過開發新的療法,而且它們在醫學研究中的應用可能會導致發現治療目前無法治愈的疾病的新方法。
在眾多成體干細胞中,脂肪來源的同種異體間充質干細胞(AASC)因其獨特的優勢,成為再生醫學領域備受矚目的焦點。這些源自脂肪組織的細胞為再生醫學領域開辟了新的前景,并為影響消化系統、皮膚、眼睛、腎臟、肌肉甚至骨骼的各種疾病提供了創新的解決方案(圖1)。
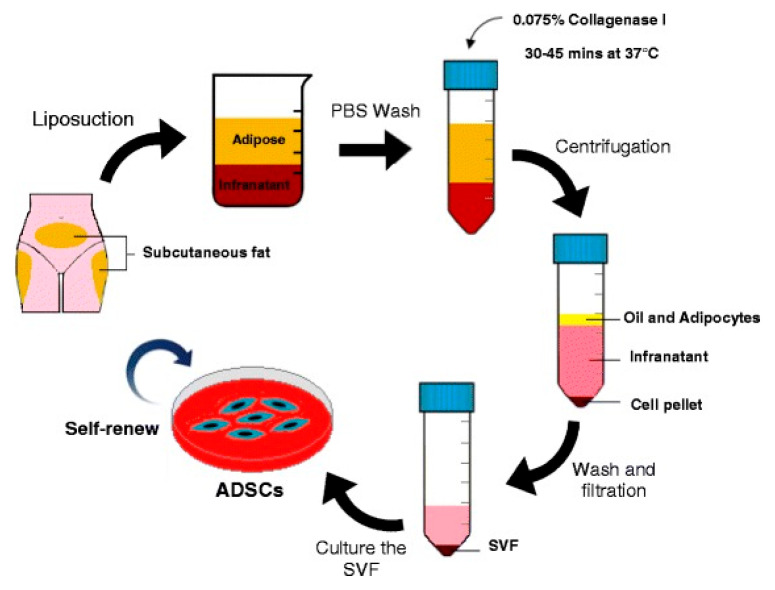
什么是脂肪干細胞?
脂肪干細胞(Adipose-derived Stem Cells, ASCs),又稱脂肪組織來源的間充質干細胞(AASC),是從人體脂肪組織中提取的多能干細胞。其核心特性包括:
- 來源廣泛:可從不同供體的脂肪組織(如抽脂手術廢棄物)中分離;
- 多向分化能力:具有可塑性,可分化為骨細胞、軟骨細胞、脂肪細胞等;
- 同種異體應用優勢:與自體干細胞相比,AASC無需從患者自身采集,避免侵入性操作,且可立即使用,尤其適合急性或時間敏感的治療場景。
此外,AASC來自健康供體并經嚴格篩選,細胞質量與產量穩定,規避了老年或疾病患者自體干細胞活性不足的問題。
脂肪干細胞的作用機制
AASC通過以下生物學特性發揮修復作用:
- 免疫調節特性:低表達HLA II類分子,缺乏共刺激標志物,降低宿主免疫排斥風險;分泌抗炎細胞因子(如TGF-β、IL-10),抑制過度炎癥反應。
- 旁分泌效應:釋放多種生長因子(VEGF、PDGF、IGF、TGF-β等),促進血管新生(VEGF)、招募祖細胞(PDGF)、刺激細胞增殖及細胞外基質重塑;在體內植入后(如動物模型)可持續分泌活性因子達數周(如VEGF維持7天,軟骨修復標志物表達達12周)。
- 與生物材料的協同作用:結合水凝膠、3D支架等載體,可延長細胞存活時間,控制生長因子釋放節奏,并增強對機械應力的抵抗。
脂肪干細胞在再生醫學中的臨床應用
AASC已應用于多種組織修復場景,常與生物材料結合以優化療效:
- 在皮膚修復和燒傷治療中,將AASC植入天然水凝膠(膠原蛋白、纖維蛋白或透明質酸)可加速上皮再生并減輕炎癥;
- 在骨和軟骨缺損中,其成骨和軟骨潛力可在礦化泡沫或3D打印復合支架中得到充分發揮;
- 在軟組織增強或瘺管閉合中,可注射基質或薄膜可提供即時結構支撐,同時保護細胞免受機械應力。
除了簡單地承載細胞之外,這些載體還可以通過工程改造來調節降解動力學、遞送輔助細胞因子或呈現形態學信息,從而延長細胞活力并使生長因子的釋放與宿主組織的需要同步。
因此,同種異體脂肪干細胞在組織重建中的臨床應用不僅取決于其分化潛力,還取決于其在體內活躍的(盡管可能是短暫的)旁分泌信號傳導,這種信號在協調組織修復過程中起著關鍵作用(圖2)。
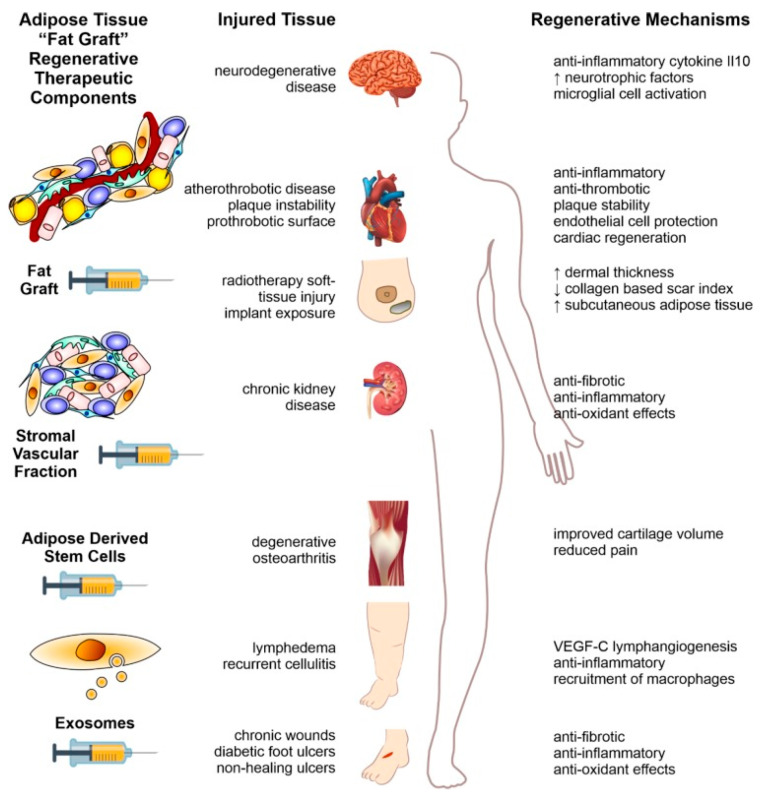
該方法涉及對通過皮下吸脂術采集的基本脂肪移植物進行逐步改進。從初始脂肪移植物開始,該過程包括酶促處理以獲得基質血管組分顆粒,然后進一步處理以分離AASC和細胞外囊泡(如摘要左欄所示)。改進過程中的每一步都顯示出對治療多種影響身體系統的各種疾病具有巨大的潛力,詳見摘要中間欄。右欄描述了實現這些治療效果的過程。
超22項研究、953名患者驗證:脂肪干細胞治療展現良好安全性,惠及9類疾病
近日,發表在國際權威期刊雜志《Int J Mol Sci》上的“異體脂肪干細胞的臨床安全性和有效性: 臨床試驗系統回顧”研究綜述。
旨在簡要概述同種異體脂肪干細胞療法在臨床實踐中的過去、現在和未來。以及探討同種異體脂肪干細胞在治療各種疾病和病癥中的應用,包括皮膚病變、克羅恩病、腺體功能障礙、腎臟疾病、脊髓性肌萎縮癥和骨關節炎。

綜述的研究數據表明:同種異體脂肪干細胞在改善疤痕和潰瘍、治療克羅恩病以及治療腺體功能障礙和腎臟疾病方面具有良好的療效。在脊髓性肌萎縮癥和骨關節炎方面,初步結果也表明了潛在的益處。基于同種異體脂肪干細胞的治療耐受性良好,沒有重大不良反應,從而強調了其良好的安全性。
方法:本綜述根據PRISMA指南進行;使用PubMed、Embase和Web of Science數據庫檢索2011年至2024年期間發表的研究,且不受語言限制。為了確保數據的相關性和質量,我們嚴格限制納入對照臨床試驗。經過篩選,最終保留了22篇文章,共計953例符合既定納入標準的患者(圖3)。
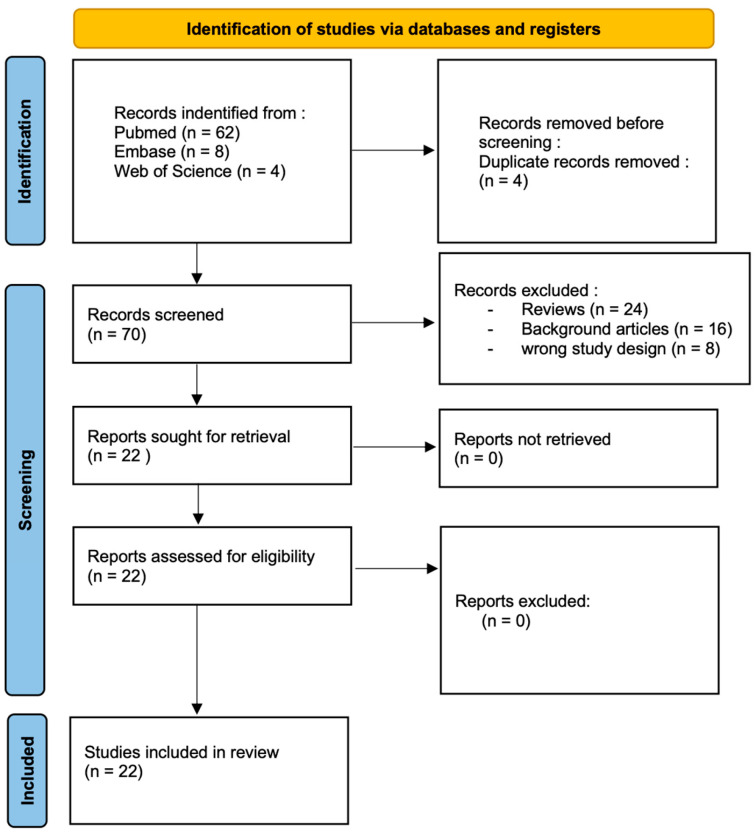
異體脂肪干細胞治療9種疾病的療效概述
01、皮膚病變:在四項涉及190名患者的研究中,103名(54.2%)接受了AASC治療。在接受治療的患者中,93名(90.3%)從治療中受益,而只有10名(占研究總人數的5.3%)患者病情沒有改善。
02、克羅恩病:三項研究納入了271名患者,其中151名(55.72%)接受了AASC治療。其中,88名患者(占接受治療患者的58.28%)從治療中獲益,而63名患者(占總人口的23.25%)病情未見改善。
03、腺體功能障礙:四項研究涉及197名患者,其中102名(50%)接受了AASC治療。接受治療的患者中有一半(51名,占50%)病情有所改善,而其余51名患者(占總人口的25.89%)未見療效。
04、肺部疾病:在三項涉及172名患者的研究中,90名(52.33%)患者接受了AASC治療,其中62名患者(占接受治療患者的68.89%)從治療中受益。相反,28名患者(占總人口的16.28%)的病情沒有任何改善。
05、中風:一項研究納入了13名患者,其中4名(30.77%)接受了AASC治療。值得注意的是,所有4名患者(占接受治療患者的100%)均顯示出顯著的治療獲益。
06、腎功能障礙:一項納入12例患者的研究中,所有患者均接受了AASC治療。其中,6例患者(50%)從治療中受益。
07、神經退行性疾病:一項研究治療了10名患者,其中5名(占總人數的50%)接受了AASC治療。值得注意的是,所有5名患者(占接受治療人數的100%)均從治療中受益。
08、骨關節炎:四項涉及76名患者的研究發現,56名患者(73.68%)接受了AASC治療。在接受治療的患者中,50名患者(89.29%)從治療中獲益,而6名患者(占總人口的7.89%)病情未見改善。
09、急性移植物抗宿主病 (GvHD):一項對12名接受AASC治療的患者的研究報告稱,9名患者 (75%) 從治療中受益。
總體結果:本研究分析了953例患者,其中535例(56.14%)接受了AASC治療。接受治療的患者中,368例(68.79%)獲得顯著改善,而167例(占總人口的17.52%)未見改善(表1)。

脂肪干細胞修復改善疾病的機制是什么?
早期療效信號集中在三個相輔相成的機制上:促進組織再生、調節失調的免疫反應、提供營養和血管生成環境以穩定微血管完整性。
01、再生修復的核心作用:AASC(脂肪干細胞)通過多向分化與旁分泌效應顯著促進組織再生:在皮膚修復中加速創面再上皮化、改善瘢痕與色素沉著;在軟骨、腎臟及腦缺血模型中驅動結構重建。
臨床證據顯示,急性腦卒中患者靜脈輸注AASC后24個月神經功能評分(NIHSS3分)顯著優于安慰劑組(7分),證實其修復窗口期的有效性。此外,AASC還能再生腺體組織(如恢復放射性口干癥患者的唾液分泌、穩定干眼癥淚膜),突顯其跨器官再生潛力。
02、精準免疫調節特性:同種異體脂肪干細胞分泌IL-10、TGF-β等因子,促使T細胞向調節性表型轉化,實現靶向免疫調控而非全面抑制。臨床應用中:
- 使抗TNF治療無效的克羅恩病肛瘺持久閉合;
- 在兒童移植物抗宿主病中抑制細胞因子風暴,同時保留整體免疫功能;
- 改善銀屑病Th17/Treg失衡,降低斑塊嚴重程度;
- 1型糖尿病早期干預可部分保留β細胞功能。
這些案例證明AASC能重構炎癥微環境,在修復組織的同時維持宿主防御能力。
03、血管支持與新型遞送策略:同種異體脂肪干細胞及其外泌體釋放VEGF、HGF與保護性miRNA(如miR-126),通過血管生成與內皮保護發揮治療作用:
- 促進糖尿病足潰瘍血管新生;
- 改善慢性腎病腎灌注;
- 穩定重癥肺炎患者血流動力學(如產品Cx611)。
創新性霧化吸入外泌體技術證實可行且安全,肺炎患者表現為影像學改善、炎癥標志物(CRP/IL-6)下降,表明局部給藥可規避全身給藥不確定性,高效利用同種異體脂肪干細胞的血管-免疫協同效應。
以上三大機制的一致性表明,AASCs是一種統一的再生技術,而不是一系列針對特定適應癥的干預措施。
總結與展望
總之,在I期和II期試驗中,超過950名接受治療的患者表現出驚人一致的安全性:不良反應主要是輕微和自限性的,沒有觀察到惡性轉化,即使使用第三方供體,也沒有臨床相關的異體過敏記錄。這種統一的耐受性使研究人員能夠以極少數一流細胞產品所具有的信心來研究療效信號。
展望未來,有三項優先事項。
- 首先,如果同種異體脂肪干細胞要獲得許可,開展以生物標志物為基礎的患者分層的嚴格多中心III期臨床試驗至關重要。
- 其次,應前瞻性地納入機制性生物標志物——注射細胞的單細胞轉錄組學、縱向外泌體貨物分析和宿主細胞因子指紋圖譜——以檢驗因果假設并優化劑量。
- 第三,值得探索合理的組合方案:維生素D用于自身免疫性疾病的代謝啟動,膠原蛋白或透明質酸支架用于骨科病變,靶向生物制劑用于與炎癥性腸病中的旁分泌信號協同作用。
目前,同種異體脂肪干細胞已跨越安全門檻,并達到療效拐點。它們從實驗階段的希望到常規臨床實踐的轉變,并非由又一個微小的II期信號驅動,而是由該領域共同提供協調一致、基于事件、經得起經濟和倫理審查的 III 期證據的能力所驅動。
如果達到這一標準,同種異體脂肪干細胞或將開啟一個全新的治療時代,屆時細胞產品將不再作為最后的挽救療法,而是作為機制引導的、一線干預措施,應用于再生醫學、免疫學和血管科學領域。
參考資料:
[1]:Asch A, Kalbermatten DF, Madduri S. Clinical Safety and Efficacy of Allogeneic Adipose Stem Cells: A Systematic Review of the Clinical Trials. Int J Mol Sci. 2025 Jul 2;26(13):6376. doi: 10.3390/ijms26136376. PMID: 40650153; PMCID: PMC12249789.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我




 掃碼添加微信
掃碼添加微信