類風濕關節炎作為一種高發的自身免疫性疾病,長期面臨治療效果有限、副作用明顯等挑戰。傳統藥物雖能緩解癥狀,但在長效控制、精準靶向等方面仍有不足。近年來,隨著醫學技術的快速發展,隨著新型靶向藥物、小分子口服制劑到再生醫學等醫學技術不帶進步,類風濕關節炎治療領域涌現出諸多突破性進展。
截至2025年10月,全球有8類前沿治療技術展現出類風濕關節炎的顯著效果,涵蓋:新型靶向藥物、小分子藥物、干細胞療法、CAR-T療法、納米疫苗技術、藥物傳遞技術、基因編輯以及精準醫療技術。本文將系統梳理這些領域的最新突破,解析其科學原理、臨床應用及未來潛力,為類風濕關節炎患者帶來最前沿的臨床突破進展。

2025類風濕關節炎的8種治療方法:從靶向藥物到藥物傳遞技術的最新臨床突破
一、新型靶向藥物:突破傳統治療局限
1.1 BGB-45035藥片
2025年7月30日,藥物臨床試驗登記與信息公示平臺數據顯示,百濟神州(蘇州)生物科技有限公司的一項評價BGB – 45035對比安慰劑在中度至重度活動性類風濕關節炎患者中的有效性和安全性的2期、隨機、雙盲、安慰劑對照研究已啟動,臨床試驗登記號為CTR20252981。[1]
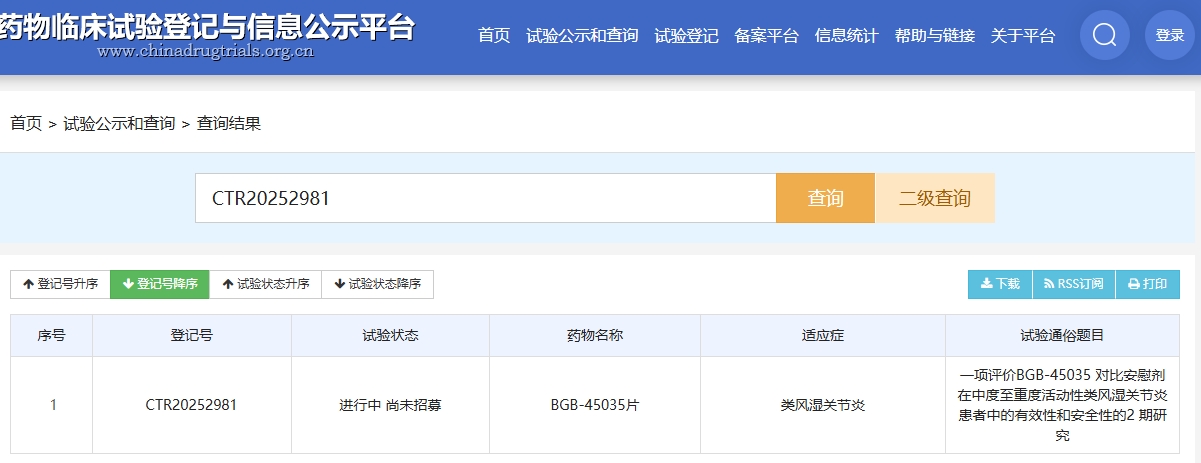
該藥物劑型為片劑,用法用量為20mg QD,用藥時程12周。本次試驗主要目的是評價BGB – 45035在傳統合成改善病情抗風濕藥(csDMARD)或生物類改善病情抗風濕藥(bDMARD)/靶向合成改善病情抗風濕藥(tsDMARD)療效不佳的中度至重度活動性類風濕關節炎成人患者中的有效性。
目前,該實驗狀態為進行中,目標入組人數國內90人。
1.2 巴瑞替尼片
2025年7月30日,藥物臨床試驗登記與信息公示平臺數據顯示,北京康立生醫藥技術開發有限公司的巴瑞替尼片在健康人體隨機、開放、兩制劑、兩周期、交叉、空腹和餐后生物等效性試驗已啟動。[2]
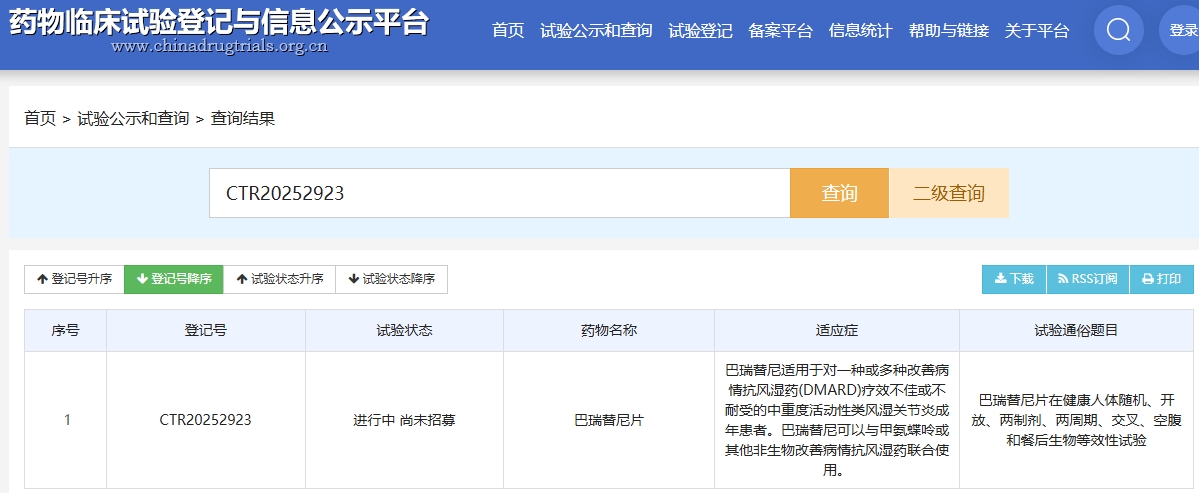
巴瑞替尼片為化學藥物,適應癥為對一種或多種改善病情抗風濕藥療效不佳或不耐受的中重度活動性類風濕關節炎成年患者。
該藥物劑型為片劑,用法為空腹或餐后單次口服1片。本次試驗主要目的為研究健康受試者在空腹/餐后狀態下,單次口服受試制劑和參比制劑的相對生物利用度,評價兩者的生物等效性;次要目的是觀察受試制劑和參比制劑在中國健康受試者中的安全性和耐受性。
目前,該實驗狀態為進行中,目標入組人數68人。
二、小分子藥物:口服治療的新范式
烏帕替尼
2025年6月18日,美國達拉斯德克薩斯大學西南醫學中心牽頭在《風濕病年鑒》期刊上發表了一篇名為《POS0540 Upadacitinib或阿達木單抗對類風濕性關節炎患者的長期安全性和有效性:來自SELECT-COMPARE研究的7年數據
》的研究成果。[3]

研究評估了烏帕替尼與阿達木單抗治療RA的長期療效和安全性。該研究納入1629例對甲氨蝶呤(MTX)應答不佳的RA患者,隨機分為烏帕替尼15mg組、阿達木單抗40mg組和安慰劑組,目前隨訪至第7年,仍有820例患者在研究中。
在療效方面,持續接受烏帕替尼或阿達木單抗治療的患者中,超過88%達到臨床疾病活動指數(CDAI≤10)或28個關節疾病活動度評分(DAS28,≤3.2)定義的低疾病活動度(LDA),且兩者在緩解[CDAI≤2.8和DAS28(CRP)<2.6]的比例上大致相似;
從阿達木單抗轉換至烏帕替尼的患者在7年期間達標的比例數值上高于從烏帕替尼轉換至阿達木單抗的患者。
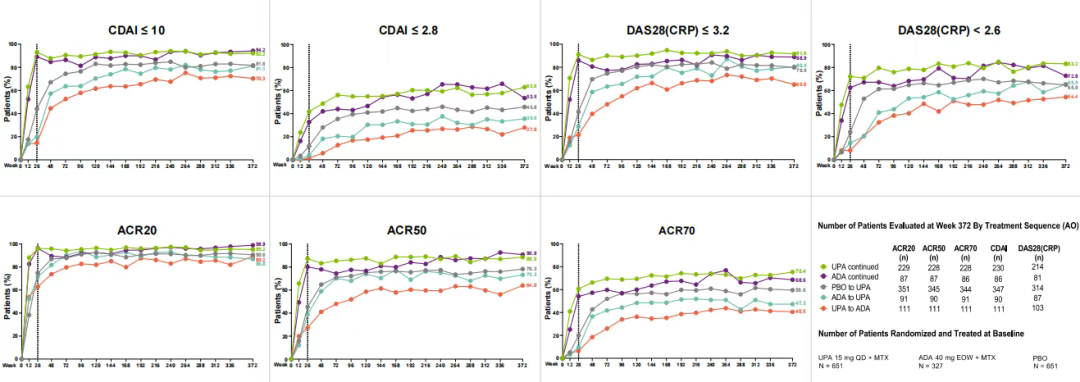
安全性方面,烏帕替尼組總體耐受性良好,臨床關注的特殊不良事件如主要心血管不良事件(MACE)、靜脈血栓栓塞(VTE)、非黑色素瘤皮膚癌(NMSC)以外的惡性腫瘤等,兩組發生風險相近。
該研究結果證實了烏帕替尼在長達7年的RA治療中療效具有持久性,安全性與阿達木單抗相當。
三、再生醫學:干細胞療法的臨床應用
3.1 間充質干細胞治療
2025年1月7日,國際知名期刊《International Immunopharmacology》上發表了一篇關于《細胞治療在類風濕關節炎中的應用:聚焦間充質干細胞的免疫調節策略》的研究成果。[4]
該研究系統評估了間充質干細胞(MSCs)在類風濕性關節炎(RA)治療中的免疫調節作用及臨床療效。

研究顯示:
同種異體間充質干細胞:顯著提升患者血清中抗炎因子IFN-γ和IL-10水平,同時調節Treg/Th17細胞比例,改善免疫失衡。
自體骨髓間充質干細胞(BM-MSCs):在難治性RA患者中,移植后Th17細胞數量、疾病活動評分(DAS28-ESR)及疼痛評分(VAS)均顯著下降,且IL-10和TGF-β水平升高,提示免疫調節效應。
臍帶間充質干細胞(UC-MSCs):靜脈輸注后,患者紅細胞沉降率(ESR)和DAS28評分顯著改善,促炎因子(IL-1β、IL-6、TNF-α)水平降低,炎癥反應得到有效控制。
脂肪來源間充質干細胞(AD-MSCs):單次輸注后52周隨訪未報告嚴重不良事件,驗證其長期安全性。
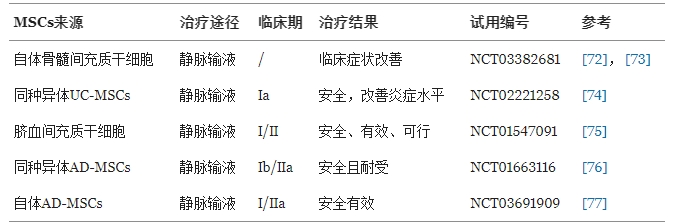
總體來看,MSCs通過多靶點免疫調節機制(如抑制Th17、促進Treg分化、降低促炎因子)緩解RA癥狀,且在多種來源(骨髓、臍帶、脂肪)中均表現出良好療效與安全性。
3.2 臍帶間充質干細胞治療
2024年5月,波蘭波美拉尼亞醫科大學生理學系在國際期刊《細胞》上發表了一篇關于《間充質干細胞在類風濕關節炎治療中的作用》的研究成果。[5]

文章報告了多項使用間充質干細胞治療類風濕關節炎良好的臨床試驗結果。
Wang等人研究了臍帶間充質干細胞(UC-MSCs)在RA患者中的應用。具體來說,參與者接受MTX/來氟米特/羥氯喹以及含有UC-MSCs的溶劑治療。
- 重要的是,與接受未接受UC-MSCs的DMARDs治療的患者相比,經過3個月的治療后,添加干細胞的患者DAS28評分顯著降低,RF和CRP濃度也降低。
- 此外,使用MSCs治療可增加外周血中的Tregs數量。
- 在安全性分析方面,細胞治療不會引起重大毒性。
另一項試驗中,作者分析了接受UC-MSCs靜脈治療的患者的長期安全性和有效性。作者觀察到,與治療前相比:治療后1年和3年的DAS28和HAQ評分顯著降低。此外,還發現這些時間點的CRP和RF水平降低。
此外最近,一些臨床試驗還研究了UC-MSCs在RA患者中的潛力。在一項Ia期臨床試驗中:單次靜脈注射UC-MSCs可在4周后顯著降低DAS28-ESR評分。然而,腫脹和壓痛關節數以及疼痛VAS評分沒有差異。
綜上所述,臍帶間充質干細胞(UC-MSCs)治療類風濕性關節炎(RA)在短期改善疾病活動度、降低炎癥指標及長期維持療效方面表現出顯著潛力,且安全性良好,為RA治療提供了新的細胞療法方向。
相關閱讀:
2025年1-5月:干細胞療法治療類風濕關節炎全球最新臨床進展
四、免疫療法:CAR-T療法的突破性進展
第四代嵌合抗原受體T細胞療法(第四代CAR-T)
2025年1月,《Cell Research》期刊上發表了一項重要研究成果。研究人員報告了一種新的、自體的、第四代 CD19靶向嵌合抗原受體 (CAR) T 細胞,該細胞分泌通過針對IL-6和TNFα (CD19/aIL-6/aTNFα) 的抗體,在治療難治性類風濕關節炎方面顯示初有效和安全性。[6]

本次研究共納入了3例患者,輸注后CAR-T細胞體內迅速擴增,外周血CD19?B細胞短期內消失,患者壓痛關節數均降至 0,腫脹關節數顯著減少,ESR、CRP等炎癥指標及 DAS28、CDAI 等疾病活動指數大幅下降,類風濕因子消失,抗環瓜氨酸肽抗體顯著降低,超聲和MRI證實滑膜炎及骨炎改善。
雖出現輕度中性粒細胞減少和 COVID-19 感染(均恢復),且免疫球蛋白水平下降,但未觀察到細胞因子釋放綜合征(CRS),3例患者長期隨訪(最長9個月)未復發。
該研究首次將第四代CAR技術用于自身免疫病,通過“B細胞耗竭+局部細胞因子抑制”雙重機制實現療效,為難治性類風濕關節炎治療提供了新方向。
五、技術創新
5.1 納米疫苗技術
2025年3月11日,《Current Rheumatology Reviews》上發表了一篇名為《從疫苗到納米疫苗:治療類風濕性關節炎的新技術》的研究成果。探討納米技術在疫苗研發中的應用突破。[7]

研究發現納米疫苗通過將抗原裝載到PLGA等納米顆粒載體,可實現靶向遞送至樹突狀細胞以增強抗原呈遞效率、憑借緩釋特性延長半衰期,還能通過表面修飾(如CD205抗體)提升淋巴組織歸巢能力。
動物實驗顯示,含瓜氨酸化肽的納米疫苗可使膠原誘導性關節炎模型關節腫脹度降低67%。
未來該技術有望擴展至其他自身免疫疾病,但需解決大規模生產標準化問題并開展更多臨床前安全性評估,隨著mRNA 納米疫苗技術成熟,該領域或迎來革命性進展。
5.2 SetPoint系統
2025年7月31日,SetPoint Medical公司宣布其SetPoint神經免疫調節系統獲美國FDA批準,用于治療中重度類風濕性關節炎(RA)。
這是一種通過電刺激迷走神經激活人體自我抗炎機制的可植入裝置,為無法耐受或療效欠佳的RA患者提供了全新選擇。

臨床試驗顯示,治療3個月后患者癥狀顯著改善,12個月時75%的患者無需再使用生物制劑,且不良反應率低,僅1.7%。
該療法安全、持久、無免疫抑制風險,被認為是自身免疫疾病治療領域的重大突破,也為多發性硬化、克羅恩病等疾病的未來研究提供了新方向。
六、藥物傳遞技術:皮膚給藥系統的創新
納米技術皮膚給藥
2025年,比爾拉技術與科學研究所在《Nanoscale》上發表了一篇名為《利用新興皮膚給藥系統徹底改變類風濕性關節炎的治療:克服挑戰,鋪平前進的道路》的研究成果。[8]

研究指出,當前RA治療中,止痛藥和非甾體抗炎藥效果有限,改善病情的抗風濕藥雖有效,但傳統給藥途徑問題較多。局部和透皮給藥因能減少全身副作用受關注,卻存在皮膚滲透性和滯留性差的難題。
近年來,納米技術等帶來新突破,新型納米載體系統、表面修飾納米載體系統、微針等,以及電穿孔、皮膚基因治療等物理方法和新興療法,均致力于提升療效。
臨床顯示,納米技術皮膚給藥療效顯著:
- 表面修飾納米載體增強靶向性,使發炎關節藥物濃度更高;
- 100-200nm納米顆粒提升滲透與滯留效率,提高局部藥物濃度;
- 納米載體實現控釋與長效作用,減少給藥頻率;
- 多功能納米載體可聯合治療,增效明顯;同時安全性提高,減少全身副作用。
目前,多項相關專利和臨床試驗正在推進,為RA精準高效治療提供新方向。
七:基因編輯:類風濕性關節炎治療新策略
基因遞送系統(APPC)
2025年7月17日,吉林大學生命科學學院在《nature communications》上發表了一項研究成果。研究團隊開發了一種基因遞送系統(APPC),用于減輕類風濕性關節炎的癥狀。[9]

該系統以涂覆硫酸軟骨素修飾聚乙烯亞胺(CS-PEI)的金納米棒為載體,可通過CD44受體增強受刺激巨噬細胞和滑膜成纖維細胞(FLS)的內化,在近紅外照射下借助局部等離子體共振效應升高局部溫度,通過HSP70啟動子誘導熱響應性HO-1基因表達。HO-1能抑制糖酵解、降低細胞內葡萄糖和乳酸水平、緩解酸性微環境、恢復線粒體功能,還可減少氧化應激,抑制FLS糖酵解及表型分化,從而減少MMPs分泌和破骨細胞骨吸收,恢復滑膜穩態。
體內實驗顯示,APPC在近紅外照射下可精準激活基因表達,通過ELVIS效應在發炎關節蓄積并靶向滑膜細胞,有效減少炎癥細胞浸潤、滑膜增生及骨和軟骨損傷,且近紅外輻射能精準靶向患處不影響健康組織。
總而言之,該系統通過精準控制治療基因的時空表達來達到理想療效至關重要,從而為類風濕性關節炎基因治療提供了一種潛在的策略。
八、精準醫療與個體化策略
生物標志物指導分層治療
2025年7月25日,中國醫學科學院系統醫學研究院曹雪濤院士團隊在《Nature Communications》上發表了題為:The RNA-binding protein RRP1 brakes macrophage one-carbon metabolism to suppress autoinflammation的研究論文。[10]
該研究首次發現,RNA結合蛋白RRP1通過結合胸苷合酶(Tyms)的mRNA并調控其核質轉運和翻譯效率、抑制一碳代謝循環,進而抑制巨噬細胞炎癥反應,該研究為類風濕性關節炎等疾病的治療提供了新靶點。

實驗顯示,髓系特異性RRP1缺陷型小鼠會患嚴重實驗性關節炎,促炎細胞因子增多且有免疫損傷;類風濕關節炎患者外周血單核細胞中RRP1表達與TYMS表達、血清IL-1β水平呈負相關。
總的來說,研究結果表明,RRP1通過在轉錄后抑制一碳代謝發揮抗炎作用,從而為控制自身炎癥提供了潛在策略。
結語
從新型靶向藥物的臨床試驗到干細胞療法的長期療效驗證,從CAR-T技術的雙重機制突破到納米疫苗、基因遞送系統的精準干預,類風濕關節炎治療正邁向多維度、精準化的新時代。這些進展不僅提升了療效與安全性,更通過生物標志物指導的個體化策略,為疾病的精準控制提供了可能。
未來,隨著技術的持續成熟和臨床研究的深入,類風濕關節炎患者將迎來更高效、安全的治療選擇。
參考資料:
[1]http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
[2]http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
[3]R. Fleischmann, J. Swierkot, P. Durez, L. Bessette, X. Bu, I.K. Fish, A. Gara, D. Caballero, C. Peterfy, Y. Tanaka, E. Mysler,POS0540?Long-Term Safety and Efficacy of Upadacitinib or Adalimumab in Patients With Rheumatoid Arthritis: 7-Year Data From the SELECT-COMPARE Study,Annals of the Rheumatic Diseases,Volume 84, Supplement 1,2025,Pages 747-748,ISSN 0003-4967,https://doi.org/10.1016/j.ard.2025.05.922.
[4]Zhi Feng, Ying Yang, Xiang-zhuo Liu, Hui-jiao Sun, Bo-ya Wen, Zhi Chen, Bo Wei,Application of cell therapy in rheumatoid Arthritis: Focusing on the immunomodulatory strategies of Mesenchymal stem cells,International Immunopharmacology,Volume 147,2025,114017,ISSN 1567-5769,https://doi.org/10.1016/j.intimp.2025.114017.
[5]Bakinowska, E.; Bratborska, A.W.; Kie?bowski, K.; ?mil, M.; Biniek, W.J.; Pawlik, A. The Role of Mesenchymal Stromal Cells in the Treatment of Rheumatoid Arthritis. Cells 2024, 13, 915. https://doi.org/10.3390/cells13110915
[6]Li, Y., Li, S., Zhao, X. et al. Fourth-generation chimeric antigen receptor T-cell therapy is tolerable and efficacious in treatment-resistant rheumatoid arthritis. Cell Res 35, 220–223 (2025). https://doi.org/10.1038/s41422-024-01068-2
[7]https://www.eurekaselect.com/article/147127
[8]https://pubs.rsc.org/en/content/articlehtml/2024/nr/d4nr03611e
[9]Zhang, H., Jia, J., Liu, H. et al. Near-infrared light-driven metabolic reprogramming of synoviocytes for the treatment of rheumatoid arthritis. Nat Commun 16, 6590 (2025). https://doi.org/10.1038/s41467-025-61923-7
[10]Zhou, Y., Li, M., Jin, K. et al. The RNA-binding protein RRP1 brakes macrophage one-carbon metabolism to suppress autoinflammation. Nat Commun 16, 6880 (2025). https://doi.org/10.1038/s41467-025-62173-3
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信