類風(fēng)濕關(guān)節(jié)炎(Rheumatoid Arthritis, RA)是一種以慢性炎癥性滑膜炎為特征的自身免疫性疾病,常導(dǎo)致關(guān)節(jié)破壞和功能障礙。盡管傳統(tǒng)治療(如DMARDs、生物制劑)在緩解癥狀方面取得一定成效,但部分患者仍面臨耐藥性、副作用及疾病進(jìn)展等問題。
近年來,干細(xì)胞技術(shù)因其免疫調(diào)節(jié)、抗炎及組織修復(fù)能力,成為RA治療的新方向。2025年1月至10月,干細(xì)胞治療RA領(lǐng)域取得多項(xiàng)突破性進(jìn)展,本文將梳理這一時(shí)間段干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎的關(guān)鍵研究與臨床實(shí)踐,為醫(yī)學(xué)界和類風(fēng)濕關(guān)節(jié)炎患者提供最新的新聞資訊。

2025年最新進(jìn)展:干細(xì)胞療法治療類風(fēng)濕關(guān)節(jié)炎全球臨床指南(1-10月)
2025年1-10月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎臨床進(jìn)展匯總
2025年1月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
1月7日,國(guó)際知名期刊《International Immunopharmacology》上發(fā)表了一篇關(guān)于《細(xì)胞治療在類風(fēng)濕關(guān)節(jié)炎中的應(yīng)用:聚焦間充質(zhì)干細(xì)胞的免疫調(diào)節(jié)策略》的研究成果。[1]
該研究系統(tǒng)評(píng)估了間充質(zhì)干細(xì)胞(MSCs)在類風(fēng)濕性關(guān)節(jié)炎(RA)治療中的免疫調(diào)節(jié)作用及臨床療效。

研究顯示:
同種異體MSCs:顯著提升患者血清中抗炎因子IFN-γ和IL-10水平,同時(shí)調(diào)節(jié)Treg/Th17細(xì)胞比例,改善免疫失衡。
自體骨髓MSCs(BM-MSCs):在難治性RA患者中,移植后Th17細(xì)胞數(shù)量、疾病活動(dòng)評(píng)分(DAS28-ESR)及疼痛評(píng)分(VAS)均顯著下降,且IL-10和TGF-β水平升高,提示免疫調(diào)節(jié)效應(yīng)。
臍帶MSCs(UC-MSCs):靜脈輸注后,患者紅細(xì)胞沉降率(ESR)和DAS28評(píng)分顯著改善,促炎因子(IL-1β、IL-6、TNF-α)水平降低,炎癥反應(yīng)得到有效控制。
脂肪來源MSCs(AD-MSCs):?jiǎn)未屋斪⒑?2周隨訪未報(bào)告嚴(yán)重不良事件,驗(yàn)證其長(zhǎng)期安全性。
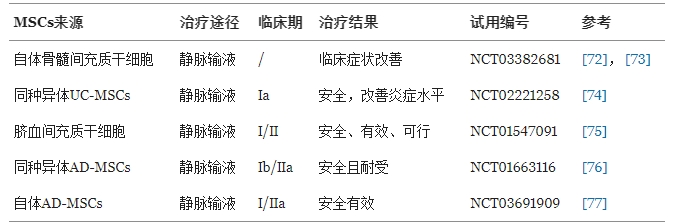
總體來看,MSCs通過多靶點(diǎn)免疫調(diào)節(jié)機(jī)制(如抑制Th17、促進(jìn)Treg分化、降低促炎因子)緩解RA癥狀,且在多種來源(骨髓、臍帶、脂肪)中均表現(xiàn)出良好療效與安全性。
1月15日,意大利科研人員在《Heliyon》上發(fā)表了一篇關(guān)于《探索圍產(chǎn)期間充質(zhì)基質(zhì)細(xì)胞作為類風(fēng)濕性關(guān)節(jié)炎的潛在治療策略》的研究成果。[2]

多項(xiàng)體外實(shí)驗(yàn)表明,圍產(chǎn)期MSC可調(diào)控先天性和適應(yīng)性免疫細(xì)胞的增殖、分化及細(xì)胞因子分泌,有效抑制炎癥反應(yīng)。動(dòng)物模型進(jìn)一步驗(yàn)證,MSC治療顯著改善RA相關(guān)關(guān)節(jié)炎癥和軟骨損傷,提示其通過免疫調(diào)節(jié)和抗炎作用緩解疾病進(jìn)展。
2025年2月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
2月13日,伊朗德黑蘭醫(yī)科大學(xué)在國(guó)際期刊《Molecular Biology Reports》上發(fā)表了一篇關(guān)于《間充質(zhì)干細(xì)胞來源的外泌體及其在治療類風(fēng)濕性關(guān)節(jié)炎中的潛在治療作用的綜述》的研究成果。[3]

近年來,干細(xì)胞衍生外泌體(MSC-EVs)因其獨(dú)特的藥物遞送能力、免疫調(diào)節(jié)功能及安全性,成為RA治療研究的熱點(diǎn)。
研究表明,MSC-EVs可靶向遞送抗炎藥物(如抗TNF-α)、miRNA(如miR-320a、miR-150-5p)及代謝調(diào)控因子,通過抑制Th17細(xì)胞分化、促進(jìn)Treg細(xì)胞增殖、阻斷NF-κB信號(hào)通路等機(jī)制,顯著減輕滑膜炎癥、抑制軟骨破壞,并延緩疾病進(jìn)展。
相比直接注射MSC細(xì)胞,外泌體避免了腫瘤形成、免疫排斥等風(fēng)險(xiǎn),且可通過工程化改造(如負(fù)載特定miRNA)增強(qiáng)治療精準(zhǔn)性。多項(xiàng)臨床試驗(yàn)(如關(guān)節(jié)內(nèi)注射)證實(shí)其有效性,為RA提供了低風(fēng)險(xiǎn)、高效率的新型治療策略,未來有望成為替代傳統(tǒng)療法的重要選擇。
2025年3月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
3月5日,行業(yè)期刊《干細(xì)胞研究與治療》上發(fā)表了一篇關(guān)于《脂肪干細(xì)胞通過恢復(fù) CX3CR1+滑膜內(nèi)層巨噬細(xì)胞屏障減輕類風(fēng)濕性關(guān)節(jié)炎》的研究成果。[4]
究發(fā)現(xiàn),RA進(jìn)展過程中存在氧化磷酸化功能受損的Atf3?Ccl3?CX?CR??巨噬細(xì)胞亞群,其數(shù)量增加與疾病惡化相關(guān)。通過血清轉(zhuǎn)移性關(guān)節(jié)炎小鼠模型結(jié)合單細(xì)胞/批量RNA測(cè)序分析,團(tuán)隊(duì)證實(shí)ADSC可通過以下機(jī)制發(fā)揮治療作用:
線粒體轉(zhuǎn)移:ADSC向巨噬細(xì)胞轉(zhuǎn)移線粒體,修復(fù)其能量代謝障礙,分離的ADSC線粒體單獨(dú)移植即可顯著改善RA癥狀。
屏障修復(fù):ADSC粘附并激活CX?CR??巨噬細(xì)胞,通過Cd74/Mif軸和GAS6/MERTK軸促進(jìn)屏障重建,缺失該屏障則顯著削弱治療效果。
多靶點(diǎn)調(diào)控:ADSC同時(shí)激活組織修復(fù)通路并抑制炎癥反應(yīng),批量RNA-seq顯示其增強(qiáng)免疫調(diào)節(jié)能力。
該成果首次闡明ADSC通過靶向巨噬細(xì)胞代謝異常及屏障修復(fù)機(jī)制緩解RA,為開發(fā)基于線粒體轉(zhuǎn)移或靶向CX?CR??巨噬細(xì)胞的精準(zhǔn)療法提供了理論依據(jù),有望突破傳統(tǒng)RA治療的局限性。
2025年4月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
4月28日,我國(guó)臺(tái)灣科研人員在期刊《分子生物學(xué)報(bào)告》上發(fā)表了一篇關(guān)于《反式茴香腦增強(qiáng)間充質(zhì)干細(xì)胞來源的外泌體功能,抑制H2O2誘導(dǎo)的HIG -82滑膜細(xì)胞類風(fēng)濕性關(guān)節(jié)炎樣炎癥》的研究成果。[5]
本研究探討了反式茴香腦(源自茴香)預(yù)處理的人類沃頓膠間充質(zhì)干細(xì)胞(hWJMSCs)外泌體對(duì)類風(fēng)濕性關(guān)節(jié)炎(RA)樣炎癥的治療作用。

結(jié)果顯示:
細(xì)胞功能增強(qiáng):茴香腦處理顯著提升hWJMSCs的細(xì)胞活力及干性標(biāo)志物(如CD90)表達(dá),并促進(jìn)增殖相關(guān)蛋白(細(xì)胞周期蛋白D、PCNA、MCM2)表達(dá),同時(shí)抑制p53/p21凋亡通路。
抗炎與抗凋亡效應(yīng):經(jīng)茴香腦預(yù)處理的外泌體在H?O?誘導(dǎo)的滑膜細(xì)胞模型(HIG-82)中,顯著降低ECM降解酶(MMP-13、ADAMTS系列)和AQP-3的表達(dá),且比未處理外泌體更有效減少凋亡標(biāo)志物(Bax、Cyto c、c-caspase 3),同時(shí)上調(diào)抗凋亡蛋白Bcl-2。
總之,研究表明,來自茴香腦預(yù)處理的hWJMSC的外泌體具有更大的潛力來抑制H?O?處理的HIG-82細(xì)胞中的RA樣炎癥和細(xì)胞凋亡。
2025年5月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
5月初,沙特阿拉伯塔布克大學(xué)牽頭在國(guó)際期刊《Immun Inflamm Dis》上發(fā)表了一篇關(guān)于《間充質(zhì)干細(xì)胞治療的臨床進(jìn)展:以風(fēng)濕病為重點(diǎn)》的研究成果。[6]

本研究全面回顧了間充質(zhì)干細(xì)胞(MSC)治療風(fēng)濕性疾病(包括系統(tǒng)性紅斑狼瘡、類風(fēng)濕性關(guān)節(jié)炎、強(qiáng)直性脊柱炎、骨關(guān)節(jié)炎、骨質(zhì)疏松癥、干燥綜合征、克羅恩病、纖維肌痛、系統(tǒng)性硬化癥、皮肌炎和多發(fā)性肌炎)的臨床前及臨床研究。
其中關(guān)于間充質(zhì)干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎, 臨床前和臨床研究表明,MSC療法可以減輕炎癥、調(diào)節(jié)免疫反應(yīng)并促進(jìn)類風(fēng)濕關(guān)節(jié)炎的組織修復(fù),并延緩關(guān)節(jié)畸形進(jìn)展,長(zhǎng)期安全性良好(大規(guī)模研究未見嚴(yán)重不良事件)。
研究同時(shí)指出,MSC標(biāo)準(zhǔn)化制備、長(zhǎng)期安全性驗(yàn)證及聯(lián)合療法開發(fā)是未來突破方向,預(yù)示其有望成為風(fēng)濕病治療的重要?jiǎng)?chuàng)新手段。
2025年6月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
6月16日,莫斯科謝切諾夫第一國(guó)立醫(yī)科大學(xué)再生醫(yī)學(xué)研究所牽頭在《國(guó)際分子科學(xué)雜志》上發(fā)表了一篇名為《炎癥性關(guān)節(jié)炎再生療法的進(jìn)展:探索間充質(zhì)干細(xì)胞和細(xì)胞外囊泡的潛力》的研究文章。[7]

炎性關(guān)節(jié)炎,包括類風(fēng)濕性關(guān)節(jié)炎 (RA) 和骨關(guān)節(jié)炎 (OA),是一組退行性關(guān)節(jié)疾病,會(huì)導(dǎo)致活動(dòng)受限,并成為致殘的常見原因。
研究結(jié)果表示,干細(xì)胞及其分泌的外泌體在類風(fēng)濕關(guān)節(jié)炎治療中展現(xiàn)出很大潛力。現(xiàn)有臨床試驗(yàn)顯示,關(guān)節(jié)內(nèi)或靜脈注射MSC能減輕炎癥、緩解疼痛、改善關(guān)節(jié)功能,甚至在部分患者中促進(jìn)軟骨修復(fù)。整體安全性較好,常見副作用多為輕中度,并可自行緩解。
不過,療效因人而異,受到MSC來源、供體年齡和培養(yǎng)方法等因素影響。現(xiàn)階段試驗(yàn)規(guī)模還不大,也缺乏統(tǒng)一的標(biāo)準(zhǔn)化方案。未來,如果結(jié)合基因工程、生物材料或iPSC衍生的MSC,提升療效和生產(chǎn)可控性,MSC和EV療法有望在RA治療中發(fā)揮更大作用。
2025年7月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
7月9日,行業(yè)期刊《Stem Cell Research & Therapy》上發(fā)表了一篇名為《綜述:多種來源的間充質(zhì)基質(zhì)細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎的進(jìn)展和異質(zhì)性》的研究成果。[8]

研究表明,間充質(zhì)干細(xì)胞(MSC)有望成為有效治療類風(fēng)濕性關(guān)節(jié)炎(RA)的良藥。就長(zhǎng)期療效而言,一些細(xì)胞療法已顯示出實(shí)現(xiàn)持久疾病緩解的潛力,甚至可能減少患者對(duì)傳統(tǒng)藥物的依賴。
MSC可通過分泌抗炎因子抑制炎癥反應(yīng),并促進(jìn)Treg細(xì)胞恢復(fù)免疫平衡,從而減少關(guān)節(jié)損傷。相比傳統(tǒng)的DMARD或JAK抑制劑,MSC更傾向于局部調(diào)控,感染風(fēng)險(xiǎn)更低。同時(shí),MSC分泌的細(xì)胞外囊泡(EVs)也能在炎癥環(huán)境中發(fā)揮免疫調(diào)節(jié)作用。
此外研究人員在技術(shù)層面進(jìn)行了優(yōu)化,從基因編輯到廣泛應(yīng)用的靶向納米技術(shù)來解決MSC的歸巢效應(yīng),以及隨后出現(xiàn)的3D打印技術(shù),進(jìn)一步促進(jìn)了軟骨組織的再生和修復(fù)。
但是,MSC異質(zhì)性的挑戰(zhàn)需要更多的臨床應(yīng)用研究,因?yàn)椴煌瑏碓础⑴囵B(yǎng)條件和功能亞群的MSC在治療中表現(xiàn)出顯著差異,導(dǎo)致療效波動(dòng),通常會(huì)在三個(gè)月后會(huì)觀察到療效降低。
總體來看,MSC療法在類風(fēng)濕性關(guān)節(jié)炎(RA)治療中展現(xiàn)出巨大的潛力,但其臨床轉(zhuǎn)化仍面臨諸多挑戰(zhàn)。現(xiàn)有研究雖然證實(shí)了MSC的免疫調(diào)節(jié)和組織修復(fù)能力,但其療效和長(zhǎng)期安全性的異質(zhì)性仍需通過更嚴(yán)格的臨床試驗(yàn)予以解決,并需制定標(biāo)準(zhǔn)化的治療方案。
2025年8月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
8月1日,我國(guó)科研人員在《Medicine》期刊雜志上發(fā)表了一篇名為《細(xì)胞外囊泡在類風(fēng)濕關(guān)節(jié)炎中的作用:文獻(xiàn)計(jì)量分析》的研究文章。[9]

本次研究從Web of Science核心合集數(shù)據(jù)庫(kù)中檢索近20年來的相關(guān)文獻(xiàn),共分析了來自59個(gè)國(guó)家/地區(qū)922家機(jī)構(gòu)的512篇出版物(311篇文章和201篇綜述)。
近十年來,在類風(fēng)濕性關(guān)節(jié)炎(RA)和胞外囊泡(EVs)的研究中,EVs已被證實(shí)在調(diào)節(jié)炎癥、破壞免疫平衡和驅(qū)動(dòng)RA關(guān)節(jié)破壞方面發(fā)揮著重要作用。
另一方面,來源于間充質(zhì)干細(xì)胞(MSC)的EVs(MSC-EVs)在RA治療中也展現(xiàn)出很大潛力。它們能調(diào)控T細(xì)胞、巨噬細(xì)胞和滑膜成纖維細(xì)胞的活性,減輕炎癥、緩解滑膜增生、促進(jìn)軟骨修復(fù),還能改善骨代謝。
相比直接用干細(xì)胞,MSC-EVs更安全、免疫反應(yīng)低,而且可以靶向炎癥部位發(fā)揮作用,正成為一種比較有前景治療方案。
2025年9月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
9月28日,國(guó)家藥監(jiān)局的一則公示,為類風(fēng)濕關(guān)節(jié)炎的細(xì)胞治療賽道再添一把火。新藥品CXSL2500562臍帶間充質(zhì)干細(xì)胞注射液正式獲準(zhǔn)進(jìn)入臨床,劍指RA。[10]
值得注意的是,這已是國(guó)內(nèi)第二款獲批臨床的同類療法,預(yù)示著這一創(chuàng)新賽道正迅速升溫,競(jìng)爭(zhēng)格局悄然成形。
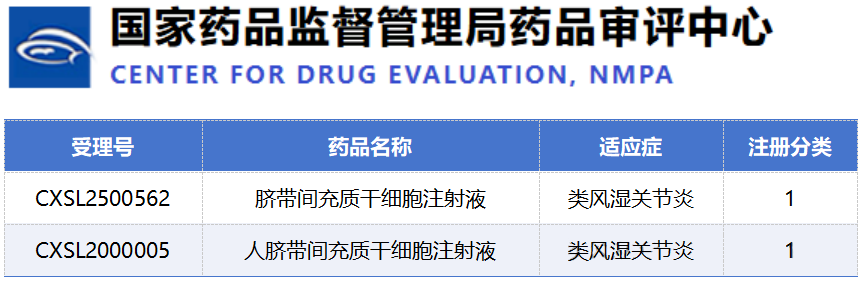
隨著 CXSL2500562 以及其他干細(xì)胞類藥物項(xiàng)目進(jìn)入臨床或推進(jìn)至關(guān)鍵節(jié)點(diǎn),未來將有更多高質(zhì)量試驗(yàn)數(shù)據(jù)陸續(xù)披露。這些數(shù)據(jù)將為RA患者提供潛在的新型治療選擇,也將推動(dòng)行業(yè)在以下幾個(gè)重點(diǎn)方向上加速突破:
- 細(xì)胞來源與制劑工藝的優(yōu)選:如何提升治療一致性與可控性;
- 給藥方式與劑量?jī)?yōu)化:探索靜脈注射、關(guān)節(jié)腔注射等不同路徑的差異化療效;
- 長(zhǎng)期安全性與成本效益評(píng)估:為臨床應(yīng)用與支付機(jī)制打下基礎(chǔ);
- 臨床分型精準(zhǔn)治療:基于患者分型/反應(yīng)特點(diǎn)開發(fā)靶向性干細(xì)胞治療策略。
可以預(yù)見,隨著這些前沿項(xiàng)目在臨床試驗(yàn)中逐步釋放數(shù)據(jù),干細(xì)胞療法在類風(fēng)濕關(guān)節(jié)炎領(lǐng)域的科學(xué)證據(jù)和應(yīng)用潛力將持續(xù)擴(kuò)展,或?yàn)檫@一頑固性慢性炎癥性疾病帶來全新的治療路徑。
2025年10月干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展
10月,浙江大學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室牽頭在《ACS應(yīng)用材料與界面》上發(fā)表了一篇名為《用于局部治療類風(fēng)濕性關(guān)節(jié)炎的可注射溫敏水凝膠包裹間充質(zhì)干細(xì)胞膜仿生脂質(zhì)體》的研究成果。[11]

本研究將間充質(zhì)干細(xì)胞膜仿生脂質(zhì)體(MSCsome)負(fù)載到用于RA治療的可注射溫敏水凝膠中。
具體而言,注射到關(guān)節(jié)腔內(nèi)的溫敏水凝膠由于其緩慢的降解速率,能夠?qū)崿F(xiàn)地塞米松(Dex)包裹的MSCsome的持續(xù)局部釋放,隨后,由于其固有的靶向能力,Dex-MSCsome可被活化的巨噬細(xì)胞內(nèi)吞。
實(shí)驗(yàn)結(jié)果顯示,這種“水凝膠+MSC膜仿生脂質(zhì)體”的復(fù)合治療策略,不僅顯著降低關(guān)節(jié)炎癥和疼痛,還有效促進(jìn)受損軟骨的修復(fù),為類風(fēng)濕性關(guān)節(jié)炎的局部精準(zhǔn)治療提供了全新的思路。
綜上,該研究展示了一種基于干細(xì)胞膜仿生載體與溫敏水凝膠結(jié)合的靶向遞藥平臺(tái),在未來有望進(jìn)一步拓展至其他慢性炎癥性疾病或再生醫(yī)學(xué)領(lǐng)域。
2025年干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎最新臨床進(jìn)展總結(jié)
綜上所述,2025年多項(xiàng)研究聚焦干細(xì)胞治療RA的機(jī)制突破與臨床驗(yàn)證:
間充質(zhì)干細(xì)胞(MSCs)通過多靶點(diǎn)免疫調(diào)節(jié)(如抑制Th17細(xì)胞分化、促進(jìn)Treg細(xì)胞增殖、降低促炎因子水平)顯著緩解RA癥狀,并展現(xiàn)長(zhǎng)期安全性。
研究進(jìn)一步拓展至MSC衍生外泌體的新型治療策略,其通過靶向遞送抗炎因子及miRNA,兼具高效性與低風(fēng)險(xiǎn)優(yōu)勢(shì)。此外,脂肪干細(xì)胞(ADSC)通過線粒體轉(zhuǎn)移修復(fù)滑膜巨噬細(xì)胞代謝障礙及屏障功能,為精準(zhǔn)治療提供了新方向。
整體而言,干細(xì)胞治療在免疫調(diào)控、組織修復(fù)及疾病延緩方面展現(xiàn)出綜合優(yōu)勢(shì),推動(dòng)RA治療從傳統(tǒng)抗炎藥物向細(xì)胞/分子靶向干預(yù)的范式轉(zhuǎn)變。
未來展望
干細(xì)胞療法的突破性進(jìn)展為RA治療提供了創(chuàng)新路徑,其多維度作用機(jī)制(如免疫調(diào)節(jié)、代謝修復(fù)、抗炎)突破了傳統(tǒng)藥物單一靶點(diǎn)的局限性,有望解決RA患者長(zhǎng)期面臨的疾病緩解率低、副作用大等問題。
未來需聚焦標(biāo)準(zhǔn)化制備工藝、長(zhǎng)期療效驗(yàn)證及個(gè)體化治療策略的優(yōu)化,推動(dòng)干細(xì)胞療法從實(shí)驗(yàn)室研究向臨床廣泛應(yīng)用轉(zhuǎn)化,最終惠及全球數(shù)百萬RA患者,重塑風(fēng)濕病治療格局。
結(jié)語
2025年,干細(xì)胞治療類風(fēng)濕關(guān)節(jié)炎領(lǐng)域迎來多項(xiàng)突破:間充質(zhì)干細(xì)胞通過多靶點(diǎn)免疫調(diào)節(jié)顯著緩解炎癥與疼痛,外泌體等新型載體技術(shù)提升治療精準(zhǔn)性,脂肪干細(xì)胞修復(fù)滑膜屏障機(jī)制開辟新方向。研究不僅驗(yàn)證了干細(xì)胞在安全性、長(zhǎng)期療效上的潛力,更推動(dòng)RA治療從“癥狀控制”向“免疫重塑與組織修復(fù)”轉(zhuǎn)型。
未來,隨著標(biāo)準(zhǔn)化制備工藝的完善和聯(lián)合療法的探索,干細(xì)胞有望成為顛覆傳統(tǒng)治療范式的核心力量,為全球RA患者帶來更高效、低風(fēng)險(xiǎn)的解決方案。
參考資料:
[1]Zhi Feng, Ying Yang, Xiang-zhuo Liu, Hui-jiao Sun, Bo-ya Wen, Zhi Chen, Bo Wei,Application of cell therapy in rheumatoid Arthritis: Focusing on the immunomodulatory strategies of Mesenchymal stem cells,International Immunopharmacology,Volume 147,2025,114017,ISSN 1567-5769,https://doi.org/10.1016/j.intimp.2025.114017.
[2]Exploring perinatal mesenchymal stromal cells as a potential therapeutic strategy for rheumatoid arthritisAlivernini, Stefano et al.Heliyon, Volume 11, Issue 1, e41438
[3]Aghajani, S., Maboudi, S.A., Seyhoun, I. et al. Review of mesenchymal stem cell-derived exosomes and their potential therapeutic roles in treating rheumatoid arthritis. Mol Biol Rep 52, 229 (2025). https://doi.org/10.1007/s11033-025-10290-z
[4]Wang, L., Hao, M., Xu, Y. et al. Adipose-derived stem cells attenuate rheumatoid arthritis by restoring CX3CR1+ synovial lining macrophage barrier. Stem Cell Res Ther 16, 111 (2025). https://doi.org/10.1186/s13287-025-04144-5
[5]Huang, TL., Chang, YC., Kuo, WW. et al. Trans-anethole enhances mesenchymal stem cell derived exosomes function to inhibit H2O2-induced rheumatoid arthritis-like inflammation in HIG-82 synovial cells. Mol Biol Rep 52, 431 (2025). https://doi.org/10.1007/s11033-025-10426-1
[6]Hetta HF, Elsaghir A, Sijercic VC, Ahmed AK, Gad SA, Zeleke MS, Alanazi FE, Ramadan YN. Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. Immun Inflamm Dis. 2025 May;13(5):e70189. doi: 10.1002/iid3.70189. PMID: 40353645; PMCID: PMC12067559.
[7]Klyucherev, T.O.; Peshkova, M.A.; Yurkanova, M.D.; Kosheleva, N.V.; Svistunov, A.A.; Liang, X.-J.; Timashev, P.S. Advances in Regenerative Therapies for Inflammatory Arthritis: Exploring the Potential of Mesenchymal Stem Cells and Extracellular Vesicles. Int. J. Mol. Sci. 2025, 26, 5766. https://doi.org/10.3390/ijms26125766
[8]Wu, S., Ding, S., Wang, Y. et al. Review: progression and heterogeneity of multiple sources of mesenchymal stromal cells for the treatment of rheumatoid arthritis. Stem Cell Res Ther 16, 358 (2025). https://doi.org/10.1186/s13287-025-04515-y
[9]Wang, Tao MDa; Tang, Xiaoxia MDb; Luo, Wen MDa; Chen, Ze Hua MDc; Xia, Yubo MDa; Zhou, Xiaohan MDa; Shu, Yang MDd; Lu, Chen Yin MDe; Su, Wenjie MDe; Chen, Qigang MDf; Shen, Zhen MDf; Zhou, Biao MDg; Luo, Zhiqiang MDf,*. Roles of extracellular vesicles in rheumatoid arthritis: A bibliometric analysis. Medicine 104(31):p e43623, August 01, 2025. | DOI: 10.1097/MD.0000000000043623
[10]cde
[11]https://pubs.acs.org/doi/abs/10.1021/acsami.4c09080?utm_source=chatgpt.com
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加微信
掃碼添加微信