自身免疫性疾病的特征是免疫失調,導致T細胞和抗體對自身抗原的異常反應,從而導致各種炎癥和器官功能障礙。然而,目前的治療劑表現出廣譜活性,缺乏疾病特異性選擇性,導致持久的不良反應,特別是嚴重感染和惡性腫瘤,患者往往無法達到預期的臨床目標。
間充質干細胞療法:一種在10種自身免疫性疾病中有前景的治療方法
近日,知名《過敏和免疫學臨床評論》期刊雜志刊發了一篇“基于間充質基質細胞的療法:治療自身免疫性疾病的有效方法”的文獻綜述[1]。

綜述表明間充質基質細胞 (MSC) 不僅能通過分泌抗炎因子(如IL-10、TGF-β)抑制過度活躍的T細胞和B細胞,還可直接重塑病理微環境,促進組織穩態重建。因此具有優勢,使其成為自身免疫性疾病細胞治療的絕佳候選者。
自身免疫性疾病的現狀及挑戰
自身免疫性疾病是一組不同的疾病,影響著全球約5-8%的人口,給患者帶來了巨大的痛苦,并帶來了沉重的社會經濟負擔。自身免疫性疾病是指免疫平衡被破壞,導致T細胞和自身抗原抗體的異常反應,從而導致各種炎癥和器官功能障礙。臨床上,自身免疫性疾病可以表現為局部器官受累(例如多發性硬化癥,MS)或廣泛性疾病(例如系統性紅斑狼瘡,SLE)。

在20世紀后期,經常與糖皮質激素聯合使用的改善病情的抗風濕藥物,如甲氨蝶呤 (MTX) 和環磷酰胺,已成為治療自身免疫性疾病必不可少的藥物。然而,這些藥物具有廣譜活性并且缺乏針對特定疾病的選擇性,從而導致持久的不良反應,特別是嚴重感染和惡性腫瘤。因此,迫切需要開發更有效的治療方法,其特點是副作用更少、治療時間更短。
間充質干細胞其獨特優勢在治療自身免疫性疾病方面受到關注
基于其獨特屬性,以間充質干細胞為中心的療法正作為治療自身免疫性疾病的新方法而受到關注。MSC具有多種優勢,包括免疫調節、抗炎、低免疫原性以及高增殖和多能分化能力。這些獨特的特性使MSC成為自身免疫性疾病細胞療法的可靠且合適的選擇。
本綜述基于動物實驗和臨床研究的證據,深入探討了間充質干細胞介導的免疫調節在十種免疫疾病中的最新進展,包括系統性紅斑狼瘡(SLE)、系統性硬化癥 (SSc)、MS、類風濕性關節炎 (RA)、牛皮癬、炎癥性腸病 (IBD)、1型糖尿病 (T1D)、格雷夫斯眼眶病 (GO)、自身免疫性肝病 (ALD) 和干燥綜合征 (SS)。此外,我們指出了當前的障礙并提出了策略,旨在將基于MSC的治療方法應用為自身免疫性疾病的可行治療方法。
間充質干細胞治療自身免疫性疾病的機制
首先,在特定條件和適當環境下,MSC能夠分泌多種因子,協調一系列組織和器官修復過程。這些過程包括免疫調節、調節基質細胞功能、機械強化、神經支配和血管重建。
其次,值得注意的是,MSC具有歸巢能力,通過釋放細胞因子、生長因子和趨化因子等物質,使其能夠從血流遷移到受傷或不健康的組織中,分化為成熟的器官特異性細胞。
第三,MSC表現出極低的免疫原性,這歸因于其HLA-I和MHC-I表達降低,同時缺乏HLA-II和共刺激因子。因此,MSC可以作為同種異體細胞給藥,而無需與宿主人類白細胞抗原匹配,從而降低排斥風險。
最后,MSC能夠通過分泌抗炎細胞因子和生長因子來調節先天性和適應性免疫。這有助于MSC對各種自身免疫性疾病的治療效果。
間充質干細胞治療自身免疫性疾病的主要機制:免疫調節
MSCs的免疫調節和免疫抑制作用的精確通路尚未完全闡明,但可能涉及多種機制(如圖1所示):

(1) 直接細胞間接觸:MSCs通過表面分子和受體與免疫細胞直接相互作用,影響細胞增殖、效應分子生成及細胞存活。例如,MSCs通過調控血管細胞黏附分子-1(VCAM-1)和細胞間黏附分子-1(ICAM-1)的表達,增強對T細胞的黏附能力,并與炎癥性巨噬細胞建立通信,從而強化免疫抑制效應。
(2) 釋放發揮旁分泌作用的可溶性介質:MSCs通過旁分泌效應釋放具有免疫調節、抗凋亡、促血管生成和抗氧化特性。MSC可通過釋放多種生長因子、細胞因子和趨化因子來抑制一系列免疫細胞類型,包括 T細胞、B細胞和NK細胞、中性粒細胞、巨噬細胞和樹突狀細胞 (DC)。
(3) 穿孔素依賴性凋亡:即使MSCs發生凋亡、代謝失活或碎片化,仍可通過“胞葬作用”(efferocytosis)被巨噬細胞吞噬,誘導其表達IDO、IL-10和TGF-β,從而推動巨噬細胞向抗炎表型極化,最終抑制免疫效應細胞。
(4) 細胞外囊泡(EVs):包括外泌體(50-100nm)、微囊泡(0.1-1μm)和凋亡小體(1-5μm)。MSCs來源的EVs富含miRNA、代謝物及細胞因子,可通過細胞間通訊調控免疫穩態。
間充質干細胞治療自身免疫性疾病臨床前研究與臨床研究
由于MSCs具有多種治療特性,尤其是其調節免疫反應和促進組織再生的能力,因此已開展多項臨床前研究和臨床研究,以評估 MSCs 對治療不同自身免疫疾病的可能影響。
自身免疫性疾病的臨床前研究
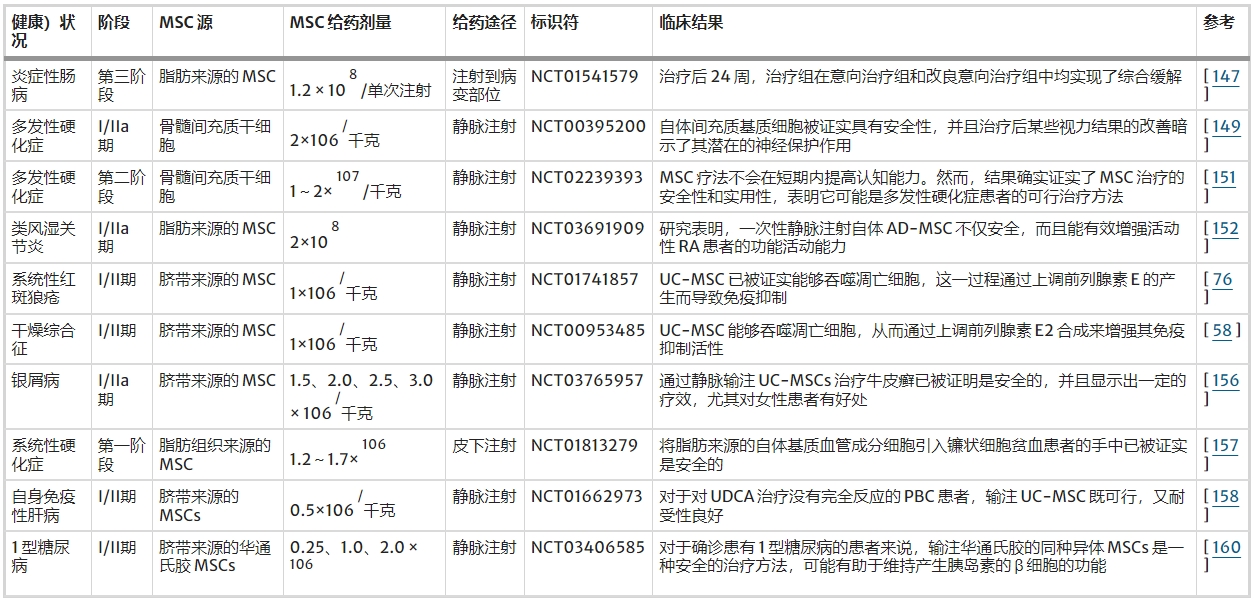
如表1所示 ,許多研究人員已經評估了MSCs在一系列自身免疫性疾病的臨床前模型中可能發揮的治療作用(圖2)。

間充質干細胞治療自身免疫性疾病的臨床研究
截至2024年11月,NIH臨床試驗數據庫 ( https://ClinicalTrials.gov/)中記錄了約200項采用MSC治療自身免疫性疾病的臨床試驗。
其中,IBD的研究最為廣泛 ( n=53)。此外,還有33項針對MS的試驗、31項針對T1D的試驗、20項針對RA的試驗、18項針對SLE的試驗,以及針對銀屑病和SS的各10項試驗。這些研究中的大多數處于其初始1/2期,而只有8項試驗處于3期。4項3期研究專注于IBD領域的CD,2項專注于T1D。此外,還有一項針對SLE和RA的3期研究。
從統計學上講,BM是MSC的主要來源,盡管UC和AD衍生的MSC也常用于臨床研究。表2概述了一些已完成的著名研究項目。
01間充質干細胞治療系統性紅斑狼瘡 (SLE)
系統性紅斑狼瘡(SLE)表現為B細胞和T細胞反應過度,以及免疫系統對自身抗原的耐受性崩潰。這些因素可引起一系列臨床癥狀,從輕微的疲勞和關節不適到危及生命的嚴重器官損害。SLE的腎臟表現稱為狼瘡性腎炎 (LN),影響約20%-60%的患者,并且仍然是SLE疾病嚴重程度和死亡率的重要因素。
2022年,《狼瘡科學醫學》期刊雜志發表了一篇“臍帶間充質基質細胞治療難治性SLE患者的I期臨床試驗的安全性、免疫學效果和臨床反應”臨床研究的結果。

結果表明:這項I期試驗是首次在多種族狼瘡患者中進行同種異體MSC治療。結果表明,輸注同種異體UC-MSC短期內似乎是安全的,因為我們沒有因輸注UC-MSC而導致的嚴重不良事件,所有不良事件均為2級或以下。讓我們感到鼓舞的是,接受治療的六名患者中有五名達到了SRI 4的主要終點,這證明進行目前正在進行的II期雙盲多中心療效研究是合理的。
我們還看到明顯的B細胞變化和血清GARP-TGFβ測量值的增加,這表明MSC具有與臨床效果平行的全身免疫作用,這讓我們感到鼓舞。
02間充質干細胞治療類風濕關節炎 (RA)
類風濕性關節炎 (RA) 是一種持續性系統性自身免疫性疾病,常見癥狀是滑膜持續發炎、軟骨和骨骼退化以及逐漸發生的關節畸形,常伴有血管、代謝、骨骼和心理合并癥。
2024年,《再生醫學》雜志發表了一篇“同種異體骨髓衍生的克隆間充質基質細胞在難治性類風濕性關節炎中的應用:一項初步研究的結果”。

該I期試驗評估了在24周內每月3劑靜脈輸注同種異體骨髓來源的克隆間充質基質細胞 (BM-cMSC) 對難治性類風濕性關節炎 (RA) 患者的安全性和潛在有效性。
結果表明:BM-cMSC輸注耐受性良好,未報告任何嚴重不良事件。三名患者的VAS評分有所改善,其中兩名患者的疼痛得到持續緩解,生活質量得到提高。四名患者在第16周達到ACR20,而SDAI和CDAI評分表明三名患者的疾病活動性降低。抗CCP和RF水平表現出不同的反應,其中一些增加與臨床結果并不一致。血清生物標志物顯示出不同的結果;五名患者的IL-10增加,而同一個體的促炎標志物TNF-α和 IL-17減少。
03間充質干細胞治療系統性硬化癥 (SSc)
系統性硬化癥(SSc)是一種影響結締組織的全身性疾病,以纖維化改變、血管功能障礙和免疫系統異常為特征。
根據皮膚受累程度,SSc分為兩種類型:局限性皮膚系統性硬化癥 (lcSSc) 和彌漫性皮膚系統性硬化癥 (dcSSc)。DcSSc明顯表現出皮膚進展迅速增厚和早期內臟器官受累的傾向增強,嚴重影響患者的生活質量并帶來潛在的危及生命的風險。
2025年3月,知名期刊雜志《干細胞研究與治療》發表了一篇“間充質干細胞移植改善系統性硬化癥患者的長期生存率:傾向評分匹配隊列研究的臨床結果”。

臨床結果表明:MSCT可顯著提高SSc患者的存活率,其結果與診斷年齡有關。MSCT特別適用于患有合并癥(包括PAH、ILD、指潰瘍和關節炎)的患者,以及患有與dcSSc亞型相關的嚴重疾病表現的患者。
04間充質干細胞治療多發性硬化癥 (MS)
多發性硬化癥是一種慢性自身免疫性疾病,其特征是覆蓋大腦和脊髓神經的神經功能惡化,從而引起疲勞、視力模糊、眼痛、記憶力減退或思維和認知障礙等癥狀。
2012年,柳葉刀神經病學發表了一項“自體間充質干細胞治療繼發性進行性多發性硬化癥:一項開放標簽2a期概念驗證研究”。多發性硬化癥 (MS) 的初步臨床試驗結果顯示,MSC具有良好的耐受性和一定的潛在療效。

2020年的一項雙盲隨機對照研究涉及48名活動性和進行性MS患者,研究報告稱,MSC在復發率、功能性磁共振成像 (MRI) 和認知測試方面具有補充優勢。未發現顯著的不良反應。
05間充質干細胞治療銀屑病
銀屑病是一種常見的慢性皮膚病,其特征是角質形成細胞異常增殖和免疫細胞浸潤。這種疾病與多種重大醫學問題有關,包括抑郁癥、銀屑病關節炎和心臟代謝綜合征,給個人和社會帶來沉重的負擔。
日前,中南大學湘雅醫院在Nature子刊《signal transduction and targeted therapy》發表干細胞治療銀屑病最新臨床研究結果。該臨床試驗揭示了人臍帶來源間充質干細胞對銀屑病患者是安全和有效的。

該項臨床試驗經過國家衛健委批準,在clinicaltrials的臨床注冊號為NCT03765957。
這是一項1/2a期單臂臨床試驗,從2019年3月至2020年8月期間,17名銀屑病患者按照臨床方案完成臍帶間充質干細胞輸注。
結果顯示,在治療期間和6個月的隨訪中,沒有觀察到明顯的副作用。總共47.1% (8/17)的銀屑病患者在PASI(皮損面積和嚴重程度)評分中有至少40%的改善,這其中17.6% (3/17)的患者沒有疾病跡象或非常輕微。男性有效率為25% (2/8),女性有效率為66.7% (6/9)。
06間充質干細胞治療炎癥性腸病 (IBD)
IBD包括潰瘍性結腸炎 (UC) 和克羅恩病 (CD),它們是影響胃腸道的慢性自身免疫性疾病。該病受多種因素影響,包括遺傳易感性、腸道微生物群改變、先天和適應性免疫失衡以及暴露于各種環境因素。
2018年,《胃腸病學》雜志發表了一項“干細胞治療(Cx601)治療克羅恩病患者復雜性肛周瘺的長期療效和安全性的臨床案例”。

結果表明:接受瘺管周圍間充質干細胞注射的患者的瘺管得到顯著改善,且報告的副作用極小。此外,對對生物治療無反應的CD患者進行靜脈注射MSC已證明具有治療效果。
此外,在歐洲進行的一項III期多中心臨床試驗中,MSC取得了顯著成就,這表明MSC可能為未從標準治療中受益的CD患者提供可行的治療選擇。在這項研究中,107名患者接受了1.2×108個同種異體AD-MSC的病變內注射,而105名患者接受了安慰治療。結果顯示,治療組在干預后6個月在意向治療 (ITT) 組和改良ITT組中均達到組內緩解。
在患有治療抵抗性復雜性肛周瘺的日本成年人中也觀察到了類似的結果。隨后,同種異體AD-MSC于2018年獲得歐盟歐洲藥品管理局批準,并于2021年獲得日本批準,用于治療患有CD的成人復雜性肛周瘺。

07間充質干細胞治療1型糖尿病 (T1D)
1型糖尿病是一種持續性自身免疫性疾病,其特點是胰島細胞遭到破壞、胰島素缺乏、胰島嚴重炎癥以及血糖水平升高。
2024年,在美國糖尿病協會第84屆科學會議上,一項關于干細胞療法治療1型糖尿病的臨床研究取得積極結果,數據顯示:接受全劑量VX-880單次輸注的12名患者,在第90天時顯示出胰島細胞移植和葡萄糖反應胰島素的產生,HbA1c降至7%以下,并達到TIR>70%目標。隨訪一年后,3名患者的HbA1c<7.0%,且無嚴重低血糖事件。

08間充質干細胞治療甲狀腺相關性眼眶病(GO)
GD是一種與甲狀腺內的促甲狀腺激素受體 (TSHR) 有關的自身免疫性疾病,可導致甲狀腺腫大和甲狀腺功能亢進。GO是GD最常見和最嚴重的癥狀,表現為眼眶炎癥和組織重塑,從而引起水腫。
最近的一項研究展示了人胎盤MSCs (huPMSCs) 在減輕該模型眼眶組織內脂肪生成方面的顯著效果。該團隊進一步證明,通過非病毒基因修飾增強huPMSCs的功能也可以緩解Graves眼眶病模型中的炎癥和脂肪組織形成。
09間充質干細胞治療自身免疫性肝病 (ALD)
ALD是一種因免疫系統功能障礙而引起的嚴重肝臟疾病,包括自身免疫性肝炎 (AIH)、原發性硬化性膽管炎 (PSC) 和原發性膽汁性膽管炎 (PBC)。這些疾病可導致肝功能障礙,包括膽汁淤積、纖維化改變、肝硬化過程和潛在的肝細胞癌等病癥。
2024年,《生物分子》期刊雜志發表了一篇有關“間充質干細胞衍生的外泌體:成為治療自身免疫性肝炎的一種有前途的無細胞治療策略”的文獻綜述。

綜述結果表明:干細胞外泌體經過基因和化學修飾后,MSC-Exos 對受損組織的靶向性得到改善,從而提高了治療效率。此外,MSC-Exos 可以通過調節 HSC 來改善肝纖維化,并通過傳遞生長因子和減少氧化應激來促進肝細胞再生,從而有助于抑制肝細胞凋亡。
010間充質干細胞治療干燥綜合征(SS)
SS是一種常見的自身免疫性疾病,其特征是免疫反應不規則以及淋巴細胞浸潤唾液腺和淚腺,導致干燥、疼痛和疲勞等癥狀。
2024年,《The Ocular Surface》雜志發表了一篇“異體間充質干細胞療法治療斯約格倫綜合征患者的干眼癥:隨機臨床試驗”的結果。

這項雙盲隨機臨床試驗旨在評估將同種異體脂肪間充質干細胞 (ASC) 注射到淚腺(LG) 治療繼發于干燥綜合征(SS) 的干眼癥(DED) 的療效。
結果表明:在治療后4個月內,我們發現以眼表疾病指數 (OSDI) 測量的干眼癥狀減少了40%,熒光素淚液破裂時間 (FTBUT)、淚液滲透壓和Schirmer測試評分顯著改善。我們假設,與注射載體或僅進行觀察相比,向LG注射同種異體ASC可減輕炎癥,從而減少ADDE患者的眼部不適并增加淚膜穩定性。
間充質干細胞治療的挑戰
移植MSCs有望成為治療一系列自身免疫性疾病的希望之選,而現有療法無法取得有效的臨床效果。然而,在將其廣泛用于患者之前,應考慮幾個關鍵問題。
挑戰解析與應對策略
| 挑戰 | 核心問題 | 潛在解決方案 |
|---|---|---|
| 功能異質性 | 不同來源MSCs療效差異大 | 建立組織來源選擇標準;開發基因編輯技術(如CRISPR)增強功能一致性 |
| 擴增限制 | 長期培養導致功能退化 | 優化生物反應器培養條件;使用低氧環境或生長因子預處理提升細胞活性 |
| 給藥途徑 | 靜脈注射靶向性差 | 開發靶向遞送系統(如磁性納米顆粒引導);探索關節內或病灶局部注射 |
| 免疫相容性 | 反復注射可能引發排斥 | 篩選低免疫原性MSCs亞群;聯合免疫抑制劑(如他克莫司)降低排斥風險 |
| 患者選擇 | 療效依賴疾病階段 | 開發炎癥生物標志物(如IL-6、TNF-α)指導給藥時機;開展分期臨床試驗驗證最佳窗口期 |
| 長期安全性 | 潛在惡性轉化與未知慢性風險 | 限制體外擴增代數(<P5);建立長期隨訪數據庫;開發無細胞療法(如外泌體替代) |
提高間充質干細胞治療效果的方法展望
隨著我們對MSC介導的免疫調節機制的認識不斷加深,我們現在可以通過多種方法操縱MSC,以提高治療效果,同時減輕與MSC治療相關的潛在不良事件。這里,我們總結了四種策略,包括MSC啟動方法、基于MSC的治療與其他治療相結合、使用 MSC衍生的EV(MSC-EV)和工程策略(圖3)。

(1)用小分子、缺氧或生物制劑對MSC進行啟動,以改善MSC功能;
(2)利用MSC-EVs作為藥物輸送系統;
(3)對MSC或MSC-EVs施加各種工程策略以增強治療潛力,包括基因改造、表面改性和組織工程;
(4)將MSC療法與其他療法(如TNF-α抑制劑、富血小板血漿等)相結合
結論與展望
間充質基質細胞(MSCs)憑借其免疫調節能力,在治療自身免疫性疾病中展現出顯著潛力,但臨床轉化仍面臨以下關鍵挑戰與方向:
核心挑戰
- 異質性難題:供體差異、組織來源多樣及培養條件波動導致MSCs功能不一,亟需標準化生產流程與優選特定來源。
- 炎癥環境影響:宿主炎癥狀態動態調控MSCs療效,需解析免疫微環境互作機制以優化治療策略。
- 臨床研究局限:現有試驗多納入晚期患者,可能掩蓋療效;需針對疾病早期階段(炎癥活躍期)設計研究,明確最佳給藥時機。
未來方向
- 精準化治療:結合疾病表型與生物標志物篩選患者,制定個體化方案(如MSCs啟動、MSC-EVs或基因工程改造細胞)。探索多中心隨機試驗,驗證給藥途徑(靜脈/局部)、劑量及適應癥。
- 安全性升級:長期隨訪監測致瘤風險,開發無細胞療法(如外泌體)降低潛在副作用。
- 機制深化:聚焦MSCs對炎癥信號的動態響應,解析其與微環境互作的分子網絡。
隨著技術突破與臨床證據積累,MSCs有望突破現有治療瓶頸,為自身免疫性疾病提供更安全、高效的解決方案。
參考資料:[1]:Li, L., He, Y., Zhao, J. et al. Mesenchymal Stromal Cell-Based Therapy: A Promising Approach for Autoimmune Diseases. Clinic Rev Allerg Immunol 68, 21 (2025). https://doi.org/10.1007/s12016-025-09030-9
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信