膝骨關節炎 (OA) 是一種發病率極高且日益增高的退行性肌肉骨骼疾病。OA的發病率為每年203/10,000,全球約有6.5億40歲及以上的人患有此病。此外,OA是導致殘疾的一個重要原因,其特征是晨僵、膝關節疼痛和腫脹、關節畸形和功能障礙。
目前的非手術治療包括藥物治療(非甾體抗炎藥、透明質酸和皮質類固醇)和功能療法(運動、教育和減肥)。目前,尚無藥物可以逆轉OA的自然進展。
間充質干細胞因具有低免疫原性、免疫調節和抗炎作用、歸巢效應、良好的分化能力和較少的倫理問題,在減少炎癥、修復受損的關節軟骨和減緩OA進展方面顯示出巨大的前景。隨著再生醫學的發展,具有多向分化潛能的間充質干細胞 (MSC) 已被一些國家批準用于治療骨關節炎。
- 例如韓國Medipost公司開發的臍帶血間充質干細胞療法,已獲批用于治療膝骨關節炎。該產品通過促進軟骨再生和減輕炎癥發揮作用。
- 日本厚生省批準Jointstem,作為再生醫療產品用于退行性關節炎的治療。其通過關節內注射自體間充質干細胞實現軟骨修復。
近年來,MSCs的分離提取、培養和制備方法逐漸標準化和產業化。另外,隨著大量高質量RCTs(隨機對照試驗)的出現,有必要總結臨床證據來探討間充質干細胞在骨關節炎治療中的有效性和安全性。
2025年臨床新數據:502名患者證明干細胞治療骨關節炎,顯著緩解疼痛、改善關節功能
日前,國際期刊雜志《Stem Cell Res Ther》發表了一篇有關“間充質干細胞治療膝骨關節炎的有效性和安全性:隨機對照試驗的系統回顧和薈萃分析”的綜述[1]。

基于該研究共納入8個RCT,502例骨關節炎患者。與對照組相比,間充質干細胞顯著改善了6個月WOMAC和12個月WOMAC。間充質干細胞還可改善OA患者6和12個月時的VAS和KOOS。亞組分析顯示脂肪來源和高劑量MSCs的療效更顯著。MSCs組與對照組的不良事件無顯著差異。
表明僅關節內注射MSCs即可顯著改善未手術OA患者的膝關節疼痛和功能障礙。MSCs有望成為一種有效的OA治療方法,具有更高的輸送效率。
為了比較術前關節內單獨注射MSCs治療OA的療效和安全性,避免其他治療措施干擾MSCs療效評估。此外,本研究僅納入了證據級別最高的RCT,以明確MSCs的治療效果。
方法:研究團隊通過”間充質干細胞“,”骨關節炎“系統搜索了四個數據庫(截止至2024年8月1日),以納入MSCs治療OA的隨機對照試驗 (RCT)。本研究的人群是未接受過任何手術治療的OA患者。干預措施是關節內注射MSCs,未進行其他輔助治療。
結果:包括西安大略和麥克馬斯特大學骨關節炎指數 (WOMAC)、100毫米視覺模擬評分 (VAS)、膝關節損傷和骨關節炎預后評分 (KOOS) 和不良事件。
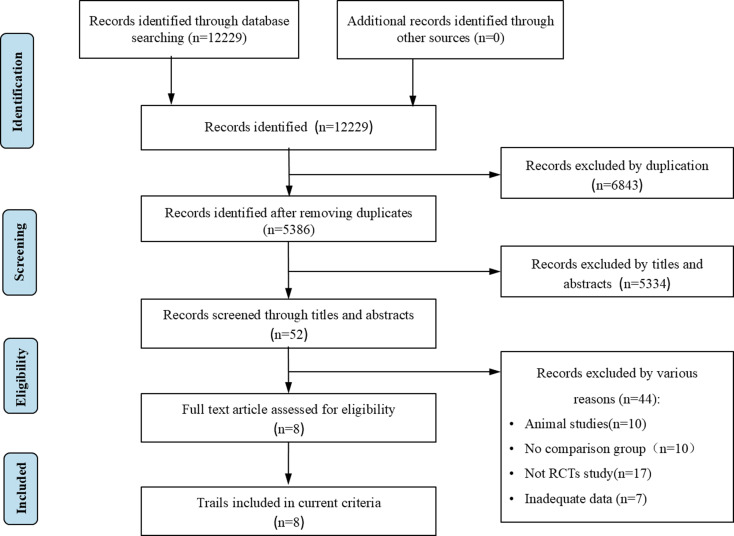
研究選擇:共系統檢索到12,229項相關研究。排除6843條重復記錄。通過標題和摘要進一步篩選后,52項研究被認為可能符合資格標準。最終,共8項RCT中的502名患者被納入薈萃分析。詳細選擇流程如圖1所示。
研究特征:納入的RCT中,2項來自中國,2項來自韓國,2項來自西班牙。發表時間為2015年至2023年。
對于注射次數,僅一項研究有一次注射組和兩次注射組,而其他七項研究均采用單次注射。對于劑量水平,一項研究有兩種不同的劑量水平,一項研究有三種不同的劑量水平,而其他六項研究采用單次劑量。
對于細胞來源,五項研究注射脂肪間充質干細胞 (ADMSC),另外三項研究注射骨髓間充質干細胞 (BM-MSC)。所有研究的樣本量從24到252不等。總計,表1介紹了所納入RCT的詳細特征。

Con:對照組;Exp:實驗組;UK:未知;RCT:隨機對照試驗;ADMSCs:脂肪間充質干細胞;BM-MSCs:骨髓間充質干細胞;VAS:100毫米視覺模擬量表;WOMAC:西安大略和麥克馬斯特大學骨關節炎指數;KOOS:膝關節損傷和骨關節炎結果評分
WOMAC評分揭示間充質干細胞治療骨關節炎的短期(6月)與中期(12月)療效:高劑量與脂肪來源優勢顯著”
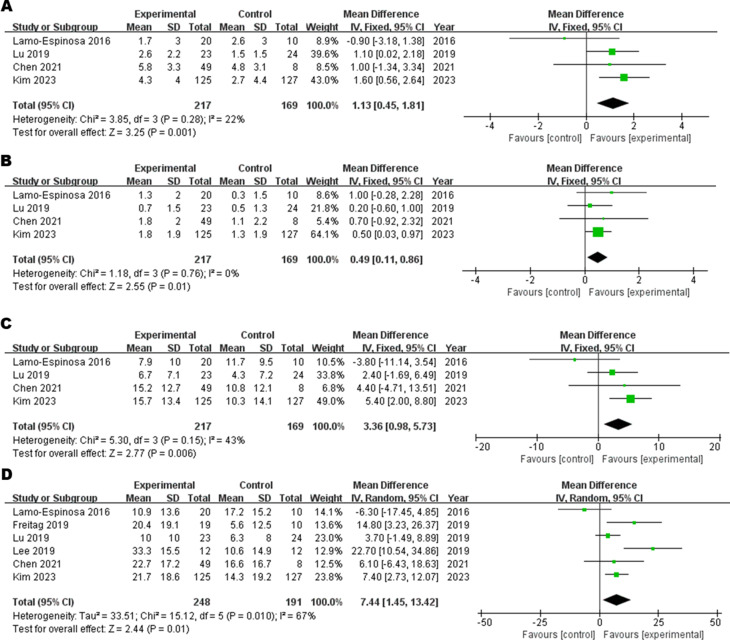
主要結果:6個月WOMAC評分
6項研究評估了注射后6個月的WOMAC評分,其中4項提供了完整的子項數據(疼痛、僵硬、功能)。
- 疼痛子項:異質性低(I2=22%,固定效應模型)。與對照組相比,間充質干細胞(MSCs)治療顯著改善骨關節炎(OA)患者的疼痛評分(圖2A)。
- 僵硬子項:異質性低(I2=0%),MSCs組顯著優于對照組(圖2B)。
- 功能子項:異質性較低(I2=43%),MSCs組功能改善顯著(圖2C)。
- 總WOMAC評分:異質性較高(I2=67%,隨機效應模型),MSCs組總評分顯著改善(圖2D)。
主要結果:12個月WOMAC評分
5項研究隨訪了12個月的WOMAC評分,其中3項提供完整子項數據。
- 疼痛子項:異質性低(I2=0%),MSCs組疼痛改善顯著(圖3A)。
- 僵硬子項:異質性低(I2=0%),MSCs組顯著優于對照組(圖3B)。
- 功能子項:異質性較高(I2=57%),兩組無顯著差異(圖3C)。
- 總WOMAC評分:異質性高(I2=77%),但MSCs組總評分顯著改善(圖3D)。

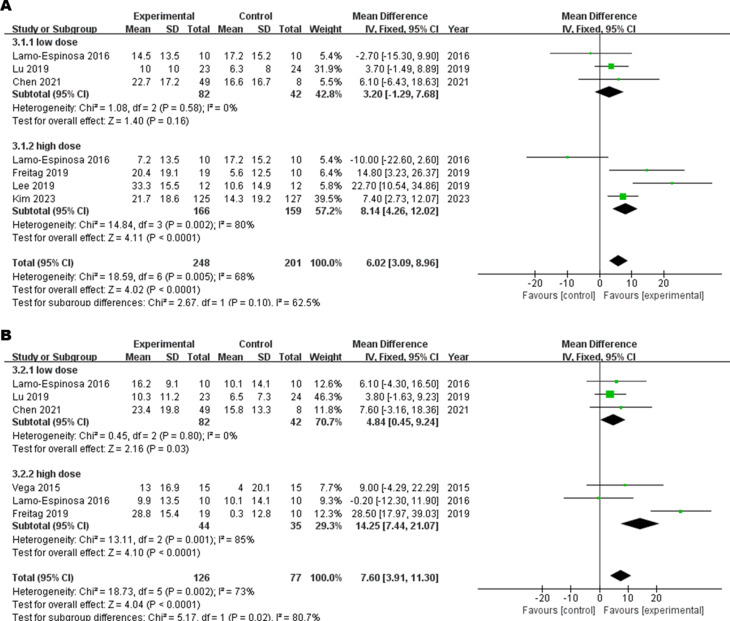
主要結果:劑量分組分析
- 高劑量組(1.0×10?–2.0×10?細胞):6個月和12個月WOMAC評分均顯著優于對照組(P≤0.002)。
- 低劑量組(1.0×10?–6.4×10?細胞):僅在12個月時顯示改善(P=0.03),6個月無顯著差異。
主要結果:細胞來源分組分析
亞組分析顯示,與對照組相比,ADMSCs組的6 M-WOMAC顯著改善,而BM-MSCs組無顯著改善(圖5A)。亞組分析顯示,與對照組相比,ADMSCs組的12 M-WOMAC顯著改善,而BM-MSCs組無顯著改善(圖5B)。
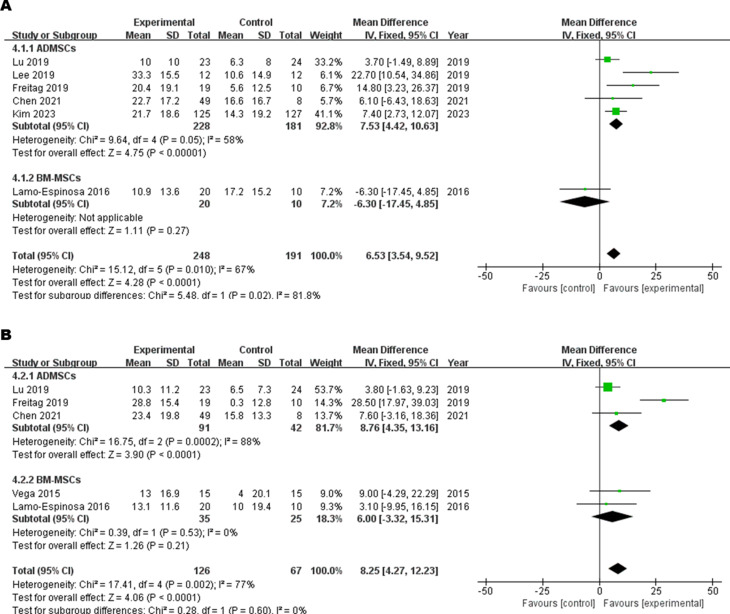
次要結果
疼痛視覺模擬評分(VAS):五項研究進行了6個月的VAS隨訪,而四項研究進行了12個月的VAS隨訪結果。6個月時的VAS異質性較高。與使用傳統藥物治療的OA患者相比,使用MSCs治療的OA患者的VAS顯著改善(圖6A)。12個月時的VAS異質性較低。MSC顯著改善了OA患者的12個月VAS(圖6B)。
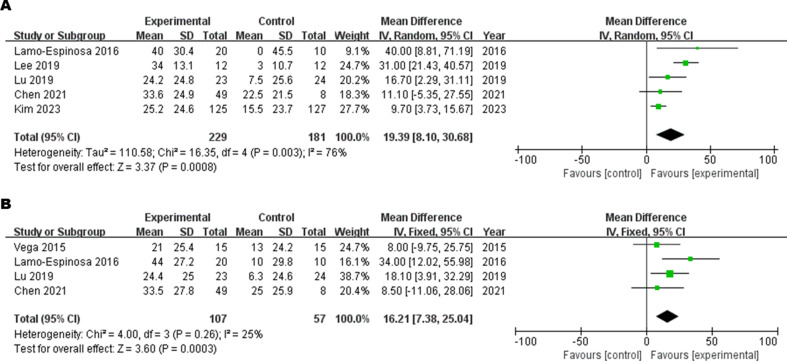
膝關節損傷與骨關節炎評分(KOOS):在第6個月和第12個月的隨訪結果中,與對照組相比,注射MSCs后KOOS的癥狀、疼痛、日常活動、體育娛樂和生活質量均得到改善。
安全性評估:不良事件(AEs)與嚴重不良事件(SAEs):MSCs組與對照組無顯著差異(P≥0.21)。
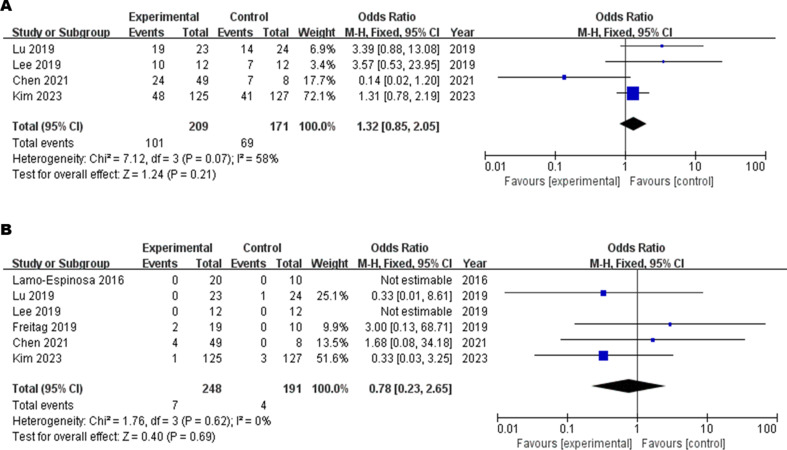
間充質干細胞治療骨關節炎:緩解疼痛與延緩病程的雙重突破
間充質干細胞(MSCs)治療骨關節炎(OA)在臨床研究中展現出顯著優勢:
療效顯著:與傳統治療(非甾體抗炎藥、透明質酸等)相比,MSCs治療可顯著改善OA患者6個月的疼痛、僵硬和功能評分(WOMAC),并在12個月后仍維持疼痛和僵硬的改善效果;疼痛視覺模擬評分(VAS)也明顯降低。
安全性高:MSCs治療未增加嚴重副作用,多數不良反應為短暫性注射部位疼痛或腫脹,且可通過技術優化(如超聲引導)進一步降低風險。
間充質干細胞治療骨關節炎的關鍵機制:在OA進展過程中,抑制炎癥可減少局部微環境的損傷,減輕疼痛,減緩膝關節基質的破壞。MSCs是再生醫學中的重要療法,不僅能刺激細胞增殖和分化,還能調節免疫炎癥反應。MSCs通過分泌抗炎因子(IL-10、TGF-β)調節免疫微環境,促進軟骨修復并潤滑關節,而非僅暫時緩解癥狀。
替代手術潛力:對于骨關節炎而言,MSCs療法目前正成為非甾體抗炎藥、透明質酸和皮質類固醇等其他非手術治療的有前途的替代方案。
- 最近,注射MSCs的臨床試驗的樣本量逐漸增加。Kim等人在2023年進行的RCT納入了252名患者,是先前研究參與者人數的兩倍多。這表明MSCs療法已引起研究人員越來越多的關注。在患者選擇方面,大多數研究集中在平均年齡為60歲的患者。MSCs為早期至中期OA患者提供了延緩病程、避免手術的新選擇。
研究局限與展望:當前證據存在主觀報告偏倚、隨訪期短(<1年)及異質性高等問題;未來需關注長期療效、不同細胞來源(如臍帶MSCs)的優化,以及工程化遞送技術(納米材料、微型機器人)的應用潛力。
間充質干細胞為骨關節炎治療開辟了從‘癥狀控制’轉向‘組織修復’的新路徑
通過系統評價與薈萃分析表明,間充質干細胞(MSCs)治療膝關節骨關節炎(OA)在短期內(6-12個月)可顯著緩解疼痛、改善關節功能,并延緩疾病進展,且安全性可控。與傳統療法(如非甾體抗炎藥、透明質酸)相比,MSCs通過免疫調節與軟骨修復機制提供了“治本”潛力,尤其適用于早期至中期OA患者。
未來需通過大規模、長期隨訪的隨機對照試驗,明確最佳細胞類型、劑量及遞送技術,并探索組織工程、納米材料等創新手段對MSCs功能的增強作用。此外,需建立標準化的療效評估體系,減少主觀報告偏倚。盡管挑戰猶存,MSCs作為再生醫學的代表性療法,有望重塑OA治療格局,為患者提供更優的非手術選擇。
相關閱讀:干細胞治療骨關節炎:2020-2024年臨床研究進展回顧
參考資料:[1]:Cao M, Ou Z, Sheng R, et al. Efficacy and safety of mesenchymal stem cells in knee osteoarthritis: a systematic review and meta-analysis of randomized controlled trials. Stem Cell Research & Therapy. 2025 Mar;16(1):122. DOI: 10.1186/s13287-025-04252-2. PMID: 40055739; PMCID: PMC11887158.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信