前言:克羅恩病 (CD) 和系統性紅斑狼瘡 (SLE) 等自身免疫性疾病,由于免疫失調和慢性炎癥,會導致進行性多器官損害。目前的治療方法缺乏療效和安全性,通常無法維持緩解。干細胞療法已成為一種有前景的免疫調節和組織修復方法。
近期,浙江中醫藥大學第二臨床醫學院聯合浙江中醫藥大學基礎醫學院、浙江中醫藥大學附屬第二醫院(浙江省新華醫院)在國際醫學期刊雜志《Frontiers in Immunology》上,發表了一篇“全球干細胞治療自身免疫性疾病的臨床試驗:趨勢和未來方向”本研究分析了干細胞療法在自身免疫性疾病中的臨床試驗趨勢及其挑戰。

結果表明:在全球1,511項試驗中,經篩選和交叉引用后,共納入244項。大多數試驗(83.6%)處于I-II期。CD(n=85)、SLE(n=36)和硬皮病(n=32)是研究最多的疾病。美國和中國的試驗數量最多。49.2%的試驗由學術機構資助。關鍵治療策略包括免疫調節、通過生長因子修復組織以及抗感染/抗增殖作用。細胞來源和給藥途徑因疾病而異。
全球干細胞治療自身免疫性疾病的臨床試驗:趨勢和未來方向(2025年)
研究價值與方法論:為系統評估干細胞療法的現狀與前景,本研究利用Trialtrove全球臨床試驗數據庫(整合ClinicalTrials.gov及歐盟注冊庫數據),通過分析試驗注冊趨勢、地域分布、細胞類型及給藥策略等維度,揭示研究動態與實施模式。該分析不僅深化了對治療潛力的認知,更為未來臨床轉化提供循證指導。
干細胞治療自身免疫性疾病的臨床試驗結果
試驗特征:截至2025年1月2日,全球共注冊了1,511項“自身免疫/炎癥”領域的干細胞治療臨床試驗。經過篩選,我們排除了1,133項與自身免疫性疾病無關的試驗、28項觀察性研究、108項超出指定時間范圍的試驗以及4項被歸類為“其他”階段的試驗,最終共納入238項試驗進行分析(圖1)。
地理分布、資金來源、治療機制和干細胞來源,并比較評估不同自身免疫適應癥的治療效果、聯合策略和安全性。

我們進一步將結果與ClinicalTrials.gov和歐盟臨床試驗注冊庫(EU Clinical Trials Register)進行交叉核對,發現另有6項試驗未收錄于Trialtrove數據庫,最終總數達到244項。
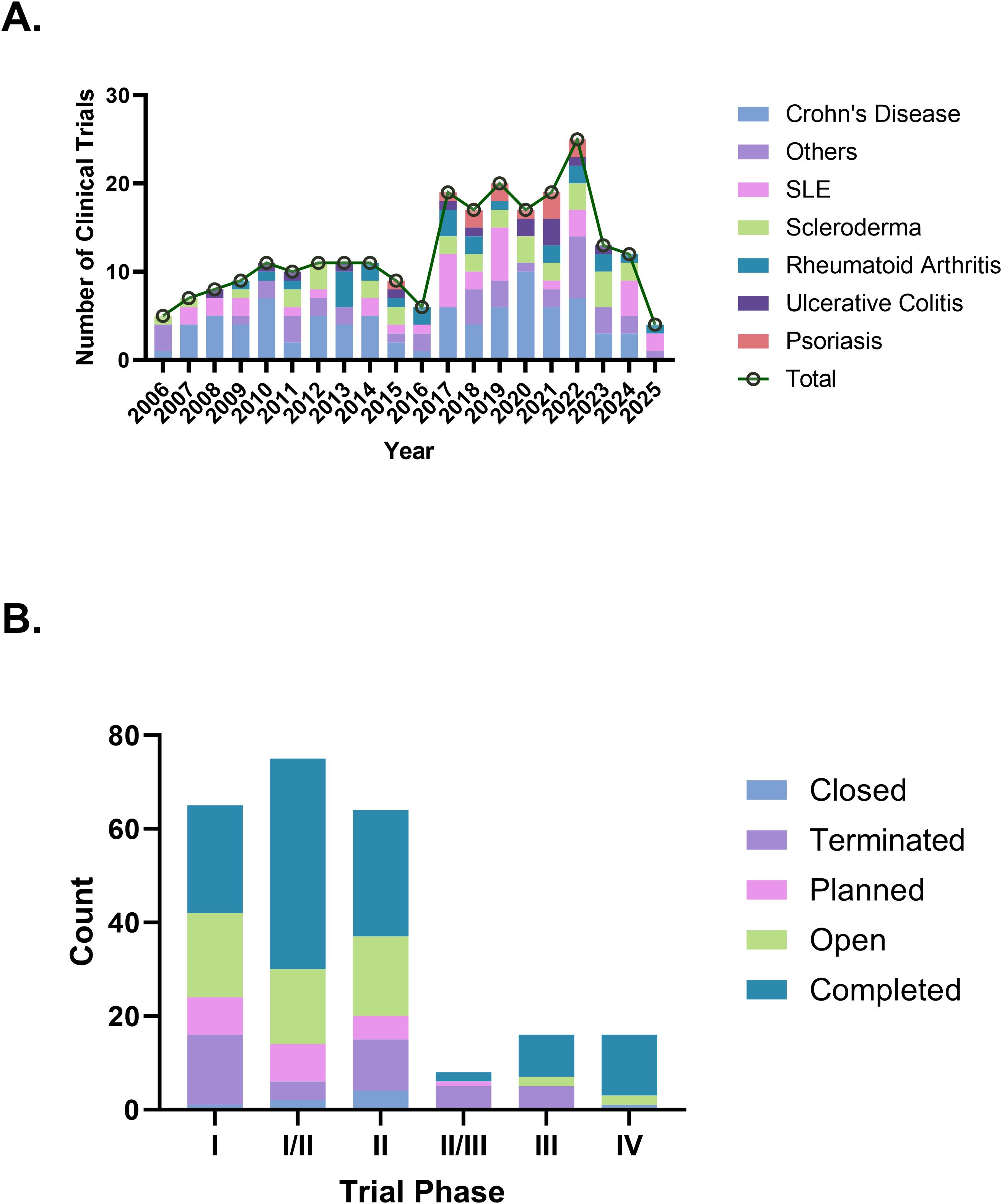
自身免疫性疾病的臨床試驗數量近年來總體呈上升趨勢,2022年達到明顯峰值,達到25項。從疾病分布來看,CD的試驗數量最多(85項,34.8%),其次是SLE(36項,14.8%)和硬皮病(32項,13.1%),銀屑病僅有12項(圖2A)。
從不同臨床試驗階段來看,I~II期試驗最多(204項,83.6%),表明該領域仍處于臨床開發的早期探索階段。II~IV期試驗共計40項,完成率為60.0%(40項試驗中的24項)(圖2B),表明雖然取得了進展,但后期試驗仍然相對有限。
試點國家及資金來源:共有44個國家開展了針對自身免疫性疾病的干細胞治療臨床試驗。美國和中國是最積極的參與國,美國有70項試驗(28.7%),中國有62項試驗(25.4%)。西班牙(19項試驗,7.8%)、韓國(15項試驗,6.1%)、比利時(13項試驗,5.3%)和法國(14項試驗,5.7%)等國家也表現出顯著的參與度。相比之下,15個國家僅有一項注冊試驗,表明這些地區的研究活動有限(圖3A)。
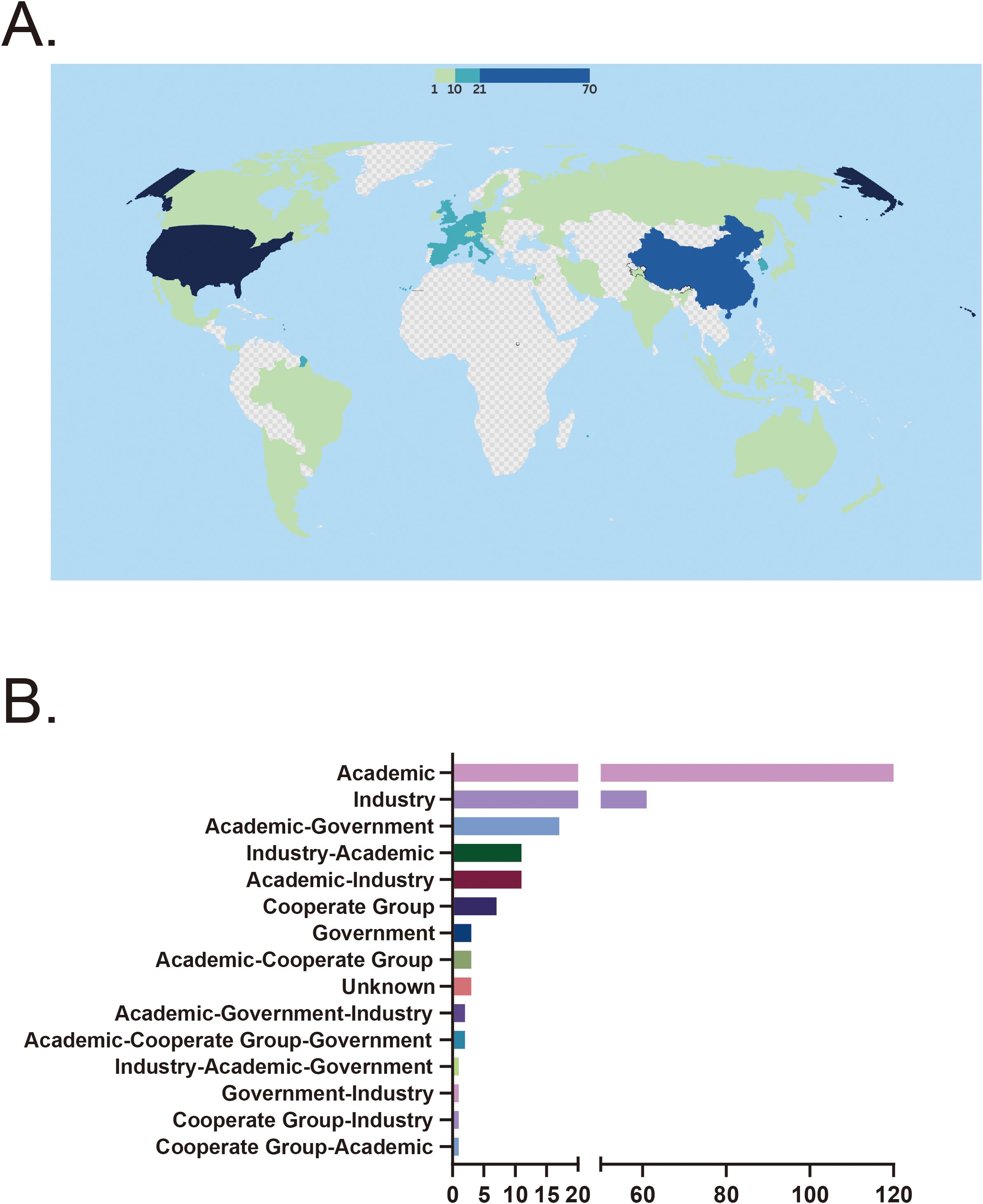
在所有資金來源中,學術機構是主要的資助者,支持了120項試驗(49.2%)。企業贊助的試驗也占了相當大的比例,共計62項試驗(25.0%)。然而,政府資助的試驗相對較少,僅記錄了三項。在合作資助模式中,產學研合作資助了11項試驗(4.5%),而產學研合作資助了17項試驗(7.0%)。少數多部門合作,例如產學研合作和產學研合作小組合作,資助的試驗數量非常有限,且資助的試驗類別均不超過3項(圖3B)。
干細胞治療自身免疫性疾病的作用機制和目標
主要作用機制及其分布:當前臨床試驗中探索的治療作用機制主要集中在三個方面:免疫系統調節(占比最高,達35項試驗,36.1%),其次是生長因子介導的組織修復(22項試驗,22.7%)以及抗感染和抗增殖作用(19項試驗,19.6%)。
值得注意的是,不同疾病類型優先考慮的機制存在明顯差異:克羅恩病(CD)和硬皮病主要關注免疫系統調節,CD也重視組織修復,硬皮病則同時側重抗感染/抗增殖;系統性紅斑狼瘡(SLE)的模式與硬皮病類似;而銀屑病的試驗則主要涉及維生素和激素調節機制(圖4A)。
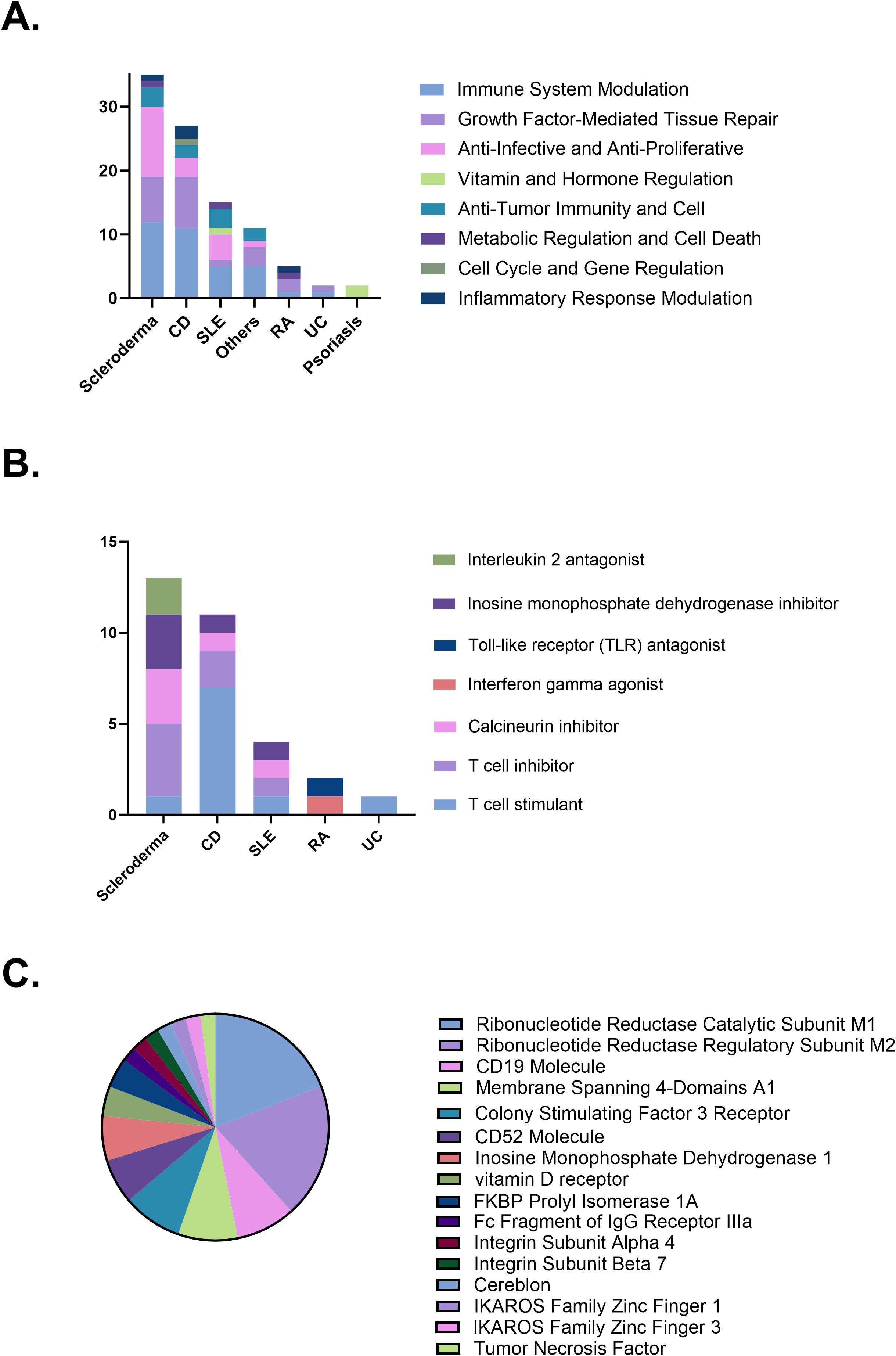
免疫調節策略的疾病特異性:在免疫系統調節這一大類機制下,具體的策略也因疾病而異。
- 硬皮病的研究主要聚焦于抑制T細胞活性、抑制鈣調神經磷酸酶通路以及抑制嘌呤合成。
- 克羅恩病則呈現出獨特的模式,同時涉及T細胞刺激和T細胞抑制策略。
- 相比之下,系統性紅斑狼瘡(SLE)的免疫調節策略更為多樣化,各類策略的應用頻率相對均衡(圖4B)。
治療靶點的分子聚焦:針對不同作用機制的研究鎖定了特定的分子靶點。
- 免疫調節相關的靶點主要涉及抗腫瘤免疫和細胞相關分子,如CD19、跨膜4結構域A1和CD52。
- 組織修復機制則主要靶向促進細胞增殖和再生的分子,例如集落刺激因子3受體(CSF3R)。
- 抗感染和抗增殖機制的核心靶點是核苷酸還原酶的催化亞基M1(RRM1)和調節亞基M2(RRM2)。銀屑病中維生素/激素調節機制的主要研究對象是維生素D受體(VDR)(圖4C)。
干細胞來源、供體類型及給藥策略的分布特征
細胞來源與類型的主導性及疾病偏好:在臨床試驗中,間充質干細胞 (MSC) 是絕對主流,占所有試驗的73%,其來源主要為骨髓、脂肪組織、臍帶等。
具體疾病對細胞類型有顯著偏好:克羅恩病 (CD) 研究最多且最常用骨髓來源MSC (BM-MSC);系統性紅斑狼瘡 (SLE) 則主要使用臍帶來源MSC (UC-MSC);而硬皮病則更多選擇造血干細胞 (HSC)。其他細胞類型如上皮干細胞、單核細胞、iPSC 和毛囊干細胞雖有探索,但應用非常有限(圖5A)。
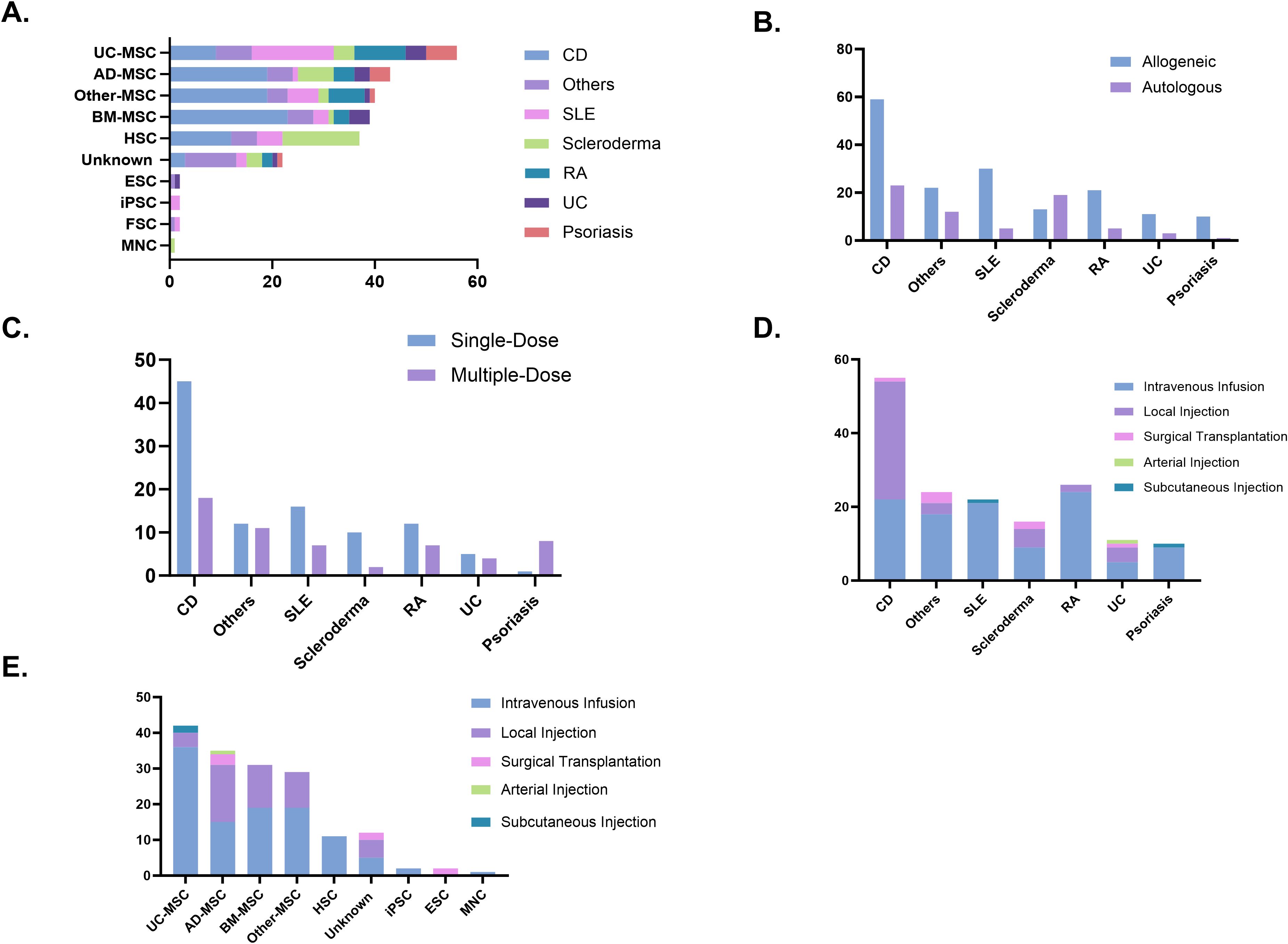
供體來源與給藥策略的疾病差異:?總體而言,異基因干細胞是主要供體來源,占試驗的70.9%。但硬皮病是個例外,其試驗中自體干細胞使用占比更高(59.3%)。
在給藥策略(頻率)上,CD和硬皮病傾向于單次給藥(圖5B);潰瘍性結腸炎的單次和多次給藥方案分布相對均衡;而銀屑病則主要采用重復(多次)給藥(圖5C)。
給藥途徑的選擇及其與疾病、細胞類型的關系:?靜脈輸注是最主要的給藥方式,尤其適用于類風濕關節炎 (RA) 和狼瘡 (SLE) 等系統性自身免疫病。相反,對于CD等胃腸道疾病,局部注射是首選途徑。手術移植應用極少,僅用于特定病例(圖5D)。
在細胞類型層面,UC-MSC和HSC的試驗幾乎完全依賴靜脈輸注。而脂肪、骨髓及其他組織來源的MSC試驗中,雖然靜脈輸注也是主要途徑,但局部注射也占了相當大的比例(圖5E)。
干細胞治療自身免疫性疾病中的效果、聯合策略及安全性的比較評價
治療效果(療效)的疾病及細胞來源差異:?評估顯示干細胞治療的效果因疾病和細胞來源而異。脂肪來源間充質干細胞 (AD-MSC) 和其他來源的 MSC 在治療克羅恩病 (CD) 中表現出相對一致的中等緩解率。
然而,對于類風濕關節炎 (RA),MSC 療法的整體療效相對較低。相比之下,在其他多種自身免疫性疾病中(如硬皮病、SLE 等非CD/RA疾病),干細胞治療顯示出較高的療效潛力(圖6A)。
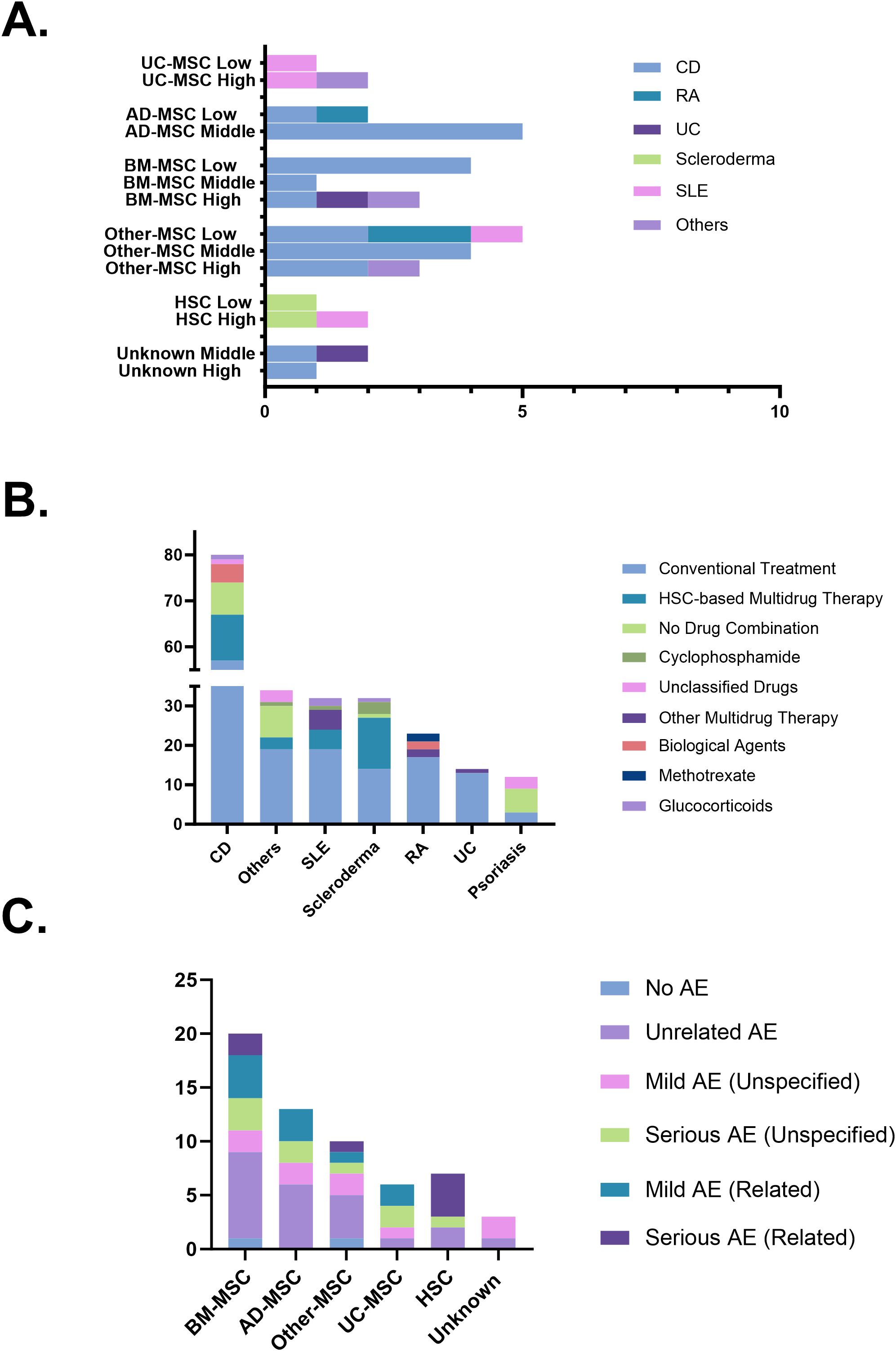
聯合治療策略的分布與疾病偏好:?常規治療(如基礎免疫抑制劑)是干細胞療法最常用的聯合策略(占試驗的62.6%),多藥聯用次之(17.2%)。
具體疾病有其偏好:硬皮病更常采用基于HSC的多藥聯用方案;銀屑病等疾病則更傾向于不使用聯合藥物(單用干細胞)。生物制劑主要與干細胞聯合用于CD 和 RA;糖皮質激素則更常用于聯合治療CD、系統性紅斑狼瘡 (SLE) 和硬皮病(圖6B)。
安全性概況:不良事件 (AE) 發生與類型:?從已完成試驗提取的59條AE記錄顯示,絕大多數 (83.1%) 與間充質干細胞 (MSC) 產品相關,造血干細胞 (HSC) 相關AE占11.9%。“無關AE”是最常見的報告類別(37.3%)。
在MSC相關AE中,輕度事件 (34.7%) 多于嚴重事件 (22.4%),且僅部分被認為與治療相關(輕度20.4%,嚴重6.1%)。HSC療法呈現出不同的風險特征,其報告的AE嚴重程度更高且與治療高度相關,57.1%的HSC相關AE是嚴重的并被判定為治療相關(圖6C)。
背景:自身免疫性疾病現狀與治療瓶頸
自身免疫性疾病(如類風濕性關節炎、硬皮病、炎癥性腸病、系統性紅斑狼瘡、銀屑病)具有高度異質性,全球累及超10億人且發病率攀升。當前階梯式/個體化治療雖包含糖皮質激素、免疫抑制劑、生物制劑及JAK抑制劑等,仍面臨耐藥性、累積毒性(代謝綜合征、感染、心血管風險)以及無法逆轉組織纖維化/促進修復等關鍵挑戰,導致不可逆器官損傷風險。
干細胞療法治療自身免疫性疾病的前景與挑戰
干細胞療法,尤其是MSC(免疫調節、組織歸巢與修復)和HSC(免疫系統重置),以及具有精準治療潛力的iPSC,為克服傳統治療瓶頸提供了新路徑。然而,臨床轉化面臨重大障礙:
- 高成本與個體化復雜性:自體iPSC分化或異體MSC篩選、培養、基因改造及質控流程復雜,成本遠超傳統療法。
- 長期安全性數據缺乏:異體MSC存在免疫排斥理論風險,亟需大規模長期隨訪確立安全基準。
- 技術與轉化生態瓶頸:細胞制備標準化不足(來源、擴增工藝差異影響細胞特性,質控體系不統一);后期試驗門檻高(III期終止率達31.3%,需大規模隊列、長期隨訪);轉化生態薄弱(學術主導占49.2%,產學/政產學合作少,學界與產業需求脫節)。
- 地域失衡與研究偏倚:試驗高度集中于美中(占54.1%),發展中國家參與度極低(如印度/巴西/阿根廷僅1-2項,非洲零參與),導致研究偏向高收入國家疾病譜,罕見病(如干燥綜合征僅4項)資源嚴重不足。
干細胞治療自身免疫性疾病的未來突破方向與協同路徑
為實現干細胞療法在自身免疫性疾病領域的臨床普惠,必須深度融合技術創新與精準化策略:
- ①工程化改造(應用CRISPR-Cas9整合多功能報告基因,增強功能可控性與體內追蹤能力);
- ②細胞資源優化(建立國際圍產期干細胞庫,借鑒日本iPS細胞庫模式,解決自體細胞衰減與來源限制);
- ③精準分層治療(整合單細胞轉錄組、外泌體miRNA液體活檢、腸道菌群及HLA分型等多組學數據,實現疾病亞型定制化干預);
- ④真實世界證據驅動(依托多中心大數據智能分析,動態優化治療方案并識別預后關鍵因素)。這些維度的協同推進將構建安全、高效、可及的下一代治療體系。
最終目標是構建安全、高效、可及的下一代治療體系,使干細胞療法從實驗性探索邁向臨床普惠。
總結
干細胞療法在自身免疫性疾病領域展現出巨大潛力,全球臨床試驗活躍度持續增長,尤其在CD、SLE和硬皮病中。然而,研究高度集中于早期階段(I-II期占83.6%)和美中等少數國家,且面臨個體化成本高昂、長期安全性證據不足、細胞制備標準化缺失以及后期轉化門檻高等多重挑戰。
未來突破的關鍵在于深度融合技術創新(工程化干細胞、精準分層)、推動全球協作、構建高效轉化生態(產學融合、監管協調),并著力降低成本與平衡資源分配,最終實現干細胞療法從實驗探索向安全、高效、可及的臨床治療方案的轉變。
參考資料:Chen Y, Li X, Zhang J, Peng J, Huang F, Bao J, Fan Y and Huang S (2025) Global clinical trials on stem cell therapy for autoimmune diseases: trends and future directions. Front. Immunol. 16:1616231. doi: 10.3389/fimmu.2025.1616231
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信