2025年7月21日,韓國首爾S.BIOMEDICS公司宣布了一項1/2a期臨床試驗的令人鼓舞的移植后一年結果,該試驗評估了人胚胎干細胞分化而來的高純度腹側中腦多巴胺能祖細胞(A9-DPC)細胞療法治療帕金森病的效果。數據顯示,與基線相比,12名受試者在12個月時接受了A9-DPC治療,其安全性和有效性均良好。運動功能恢復方面均表現出顯著積極結果,為全球900萬帕金森患者帶來新希望。

新進展!胚胎干細胞在治療帕金森病1/2a期臨床中取得突破:隨訪一年后安全性與療效呈現雙陽性
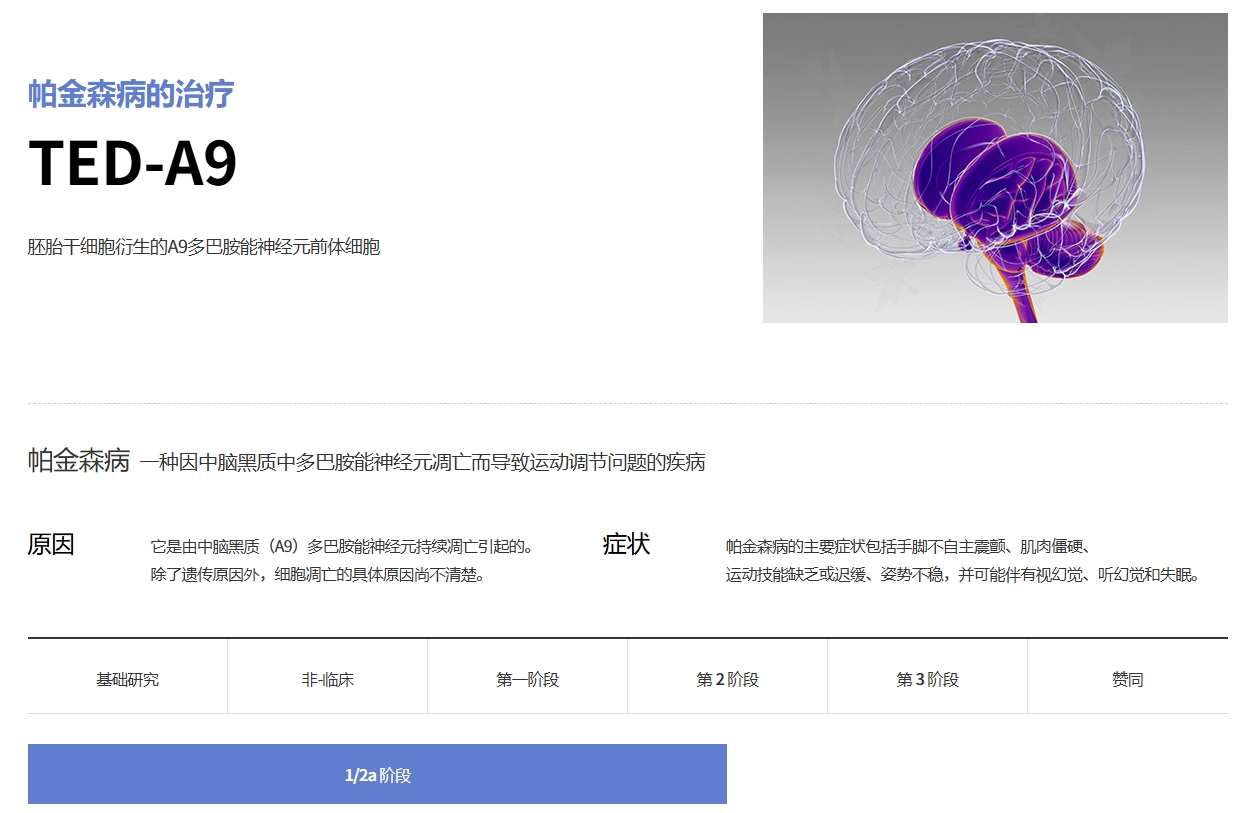
療法與受試者:?A9-DPC (TED-A9) 是一種在嚴格GMP標準下由人胚胎干細胞分化而來的高純度腹側中腦多巴胺能祖細胞療法。在1/2a期臨床試驗中,12名帕金森病患者(最后一人于2024年2月完成治療)被平均分為兩組,分別接受了低劑量(315萬個細胞)或高劑量(630萬個細胞)的A9-DPC雙側殼核移植。
安全性優異:?移植后12個月的隨訪顯示,A9-DPC具有良好的安全性。未發現任何腫瘤形成、移植細胞過度生長、細胞遷移至非目標區域或由免疫反應引起的炎癥等嚴重風險。
核心療效顯著:研究觀察到了明確的臨床改善跡象,并有證據表明移植細胞成功存活并植入患者腦內。關鍵運動功能評估指標MDS-UPDRS第三部分(停藥)評分在12個月時顯著下降(即改善),低劑量組平均改善12.7分,高劑量組改善更明顯,達15.5分。反映疾病整體嚴重程度的Hoehn和Yahr分期也顯著改善,高劑量組平均從3.8級降至2.2級。
多維度改善與劑量效應:療效具有劑量依賴性,高劑量組在多個指標上改善更優。除運動癥狀外,非運動癥狀 (NMSS評分:高劑量組改善35.8分)、生活質量 (PDQ-39)?和日常生活能力 (SEADL)?也均得到提升。MDS-UPDRS總分在高低劑量組分別改善了29.0分和34.7分。
作用機制證據:影像學檢查?[18F]FP-CIT PET?顯示患者殼核的多巴胺轉運體 (DAT) 信號明顯增強,且高劑量組的增強幅度大于低劑量組。特別重要的是,運動功能(MDS-UPDRS III評分)的改善與特定腦區(后背側殼核)DAT信號的增強之間存在統計學顯著的相關性,這強有力地支持了A9-DPC通過植入的細胞實現突觸修復和神經功能重建的作用機制。
安全性方面,安全性依然良好。未報告與移植細胞相關的治療中出現的不良事件 (TEAE)。未觀察到腫瘤形成、細胞過度生長或異位細胞遷移。大多數TEAE為輕度至中度。一名受試者出現了無癥狀的輕度出血,但未觀察到神經系統異常或其他嚴重副作用。
延世大學醫學院兼S.BIOMEDICS首席技術官金東旭教授表示:“我們的數據在整個研究期間呈現出持續的積極趨勢,證明了其良好的安全性和有效性。重要的是,PET成像中DAT信號的增強與觀察到的行為恢復相關,這對于通過神經影像學研究A9-DPC的機制而言非常有前景。” “我們將通過正在進行的研究繼續提供更多數據。”
關于胚胎干細胞衍生的A9多巴胺能神經元前體細胞(A9-DPC)和1/2a期臨床試驗
A9-DPC(也稱為TED-A9)是一種在研細胞療法,旨在替代帕金森病患者丟失的腹側中腦特異性多巴胺能神經元。這些腹側中腦特異性多巴胺能細胞源自人胚胎干細胞(hESC),在嚴格的GMP條件下,僅使用小分子。A9-DPC代表了該領域的重大進展,能夠提供源自hESC的高純度多巴胺能細胞。
通過立體定向手術,這些源自hESC的多巴胺能祖細胞(前體細胞)被移植到殼核的三個部分:前部、中部和后部,每個殼核有三個通道。雙側殼核在一次手術中完成,每個通道的三個點分別注射細胞。移植后,祖細胞有望成熟為多巴胺能神經元,增強神經連接并恢復患者的運動功能。
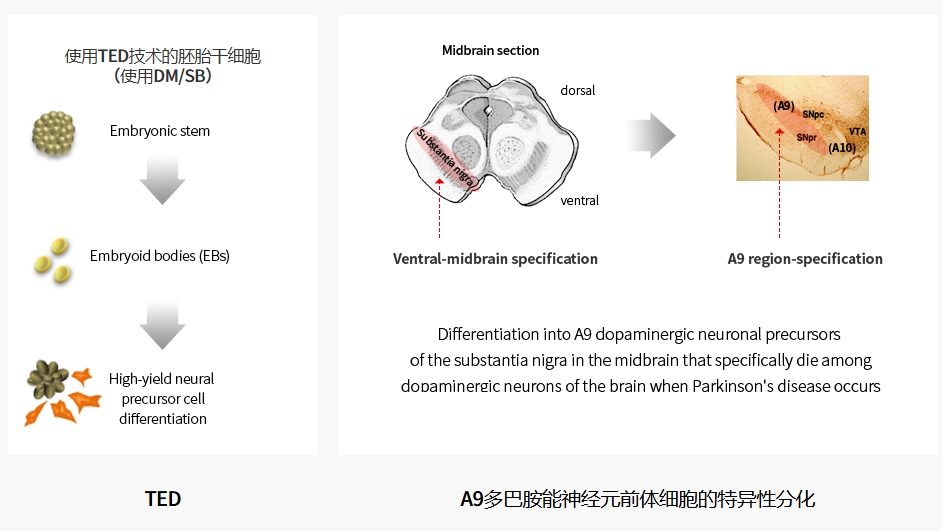
這項1/2a期臨床試驗招募了12名帕金森病患者,這些患者被診斷患有帕金森病超過5年,并表現出運動并發癥,例如療效減退、步態凍結或運動障礙。參與者的年齡在50至75歲之間。首先招募了三名患者組成的初始低劑量組(315萬個細胞),以評估三個月內的初始安全性,包括劑量限制性毒性(DLT)。在確認安全性后,另外三名患者接受了高劑量組(630萬個細胞)進行類似評估。隨著安全性的持續確認,每個劑量組又招募了三名患者,總共12名參與者。最后一位參與者于2024年2月接受了A9-DPC治療。
1/2a 期試驗的主要目標是評估移植后長達兩年的安全性和探索性療效,并持續進行三年的安全性跟蹤。
關于韓國S.BIOMEDICS公司
S.BIOMEDICS有限公司成立于2005年,是干細胞治療領域的領先創新者,專注于數據驅動的再生醫學。S.BIOMEDICS 憑借兩大核心平臺技術,目前正在推進七個針對難治性疾病的細胞治療項目。公司旗下多個主要候選藥物目前正處于臨床開發階段,彰顯了公司在細胞醫學領域的領先地位:
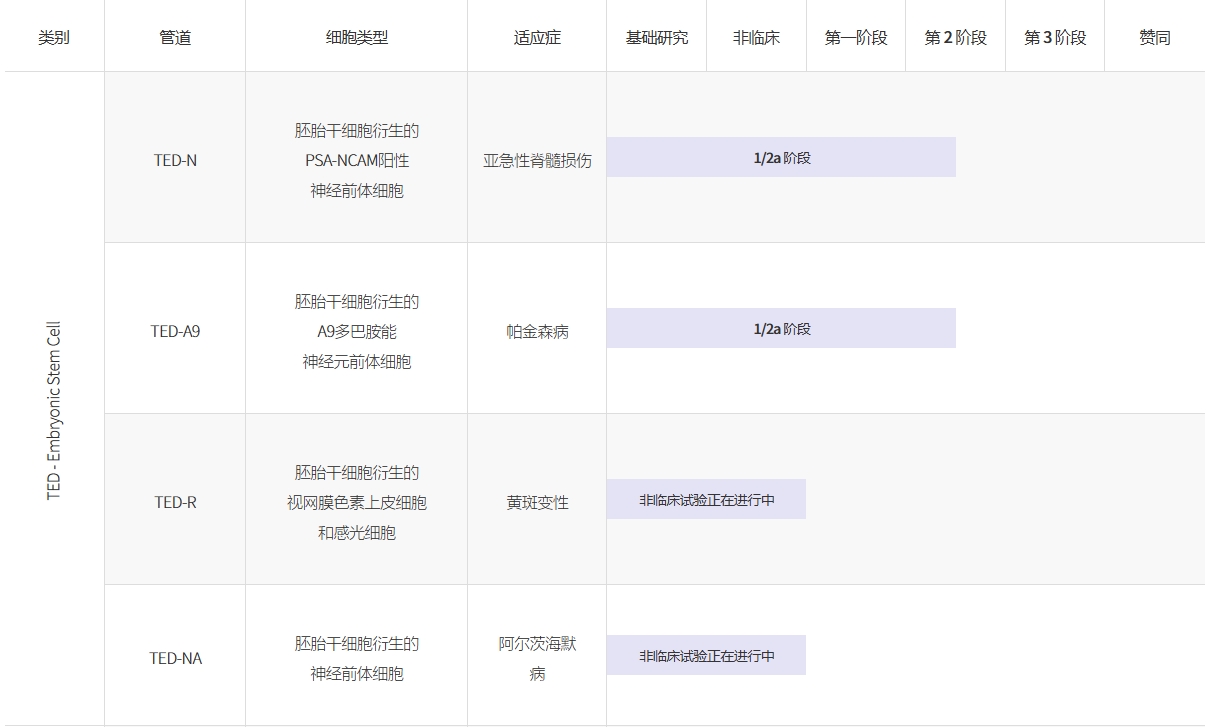
A9-DPC (TED-A9):源自hESC的腹側中腦特異性多巴胺能祖細胞,用于治療帕金森病(1/2a期)
TED-N:源自hESC的PSA-NCAM陽性神經祖細胞用于治療脊髓損傷(1/2a期)
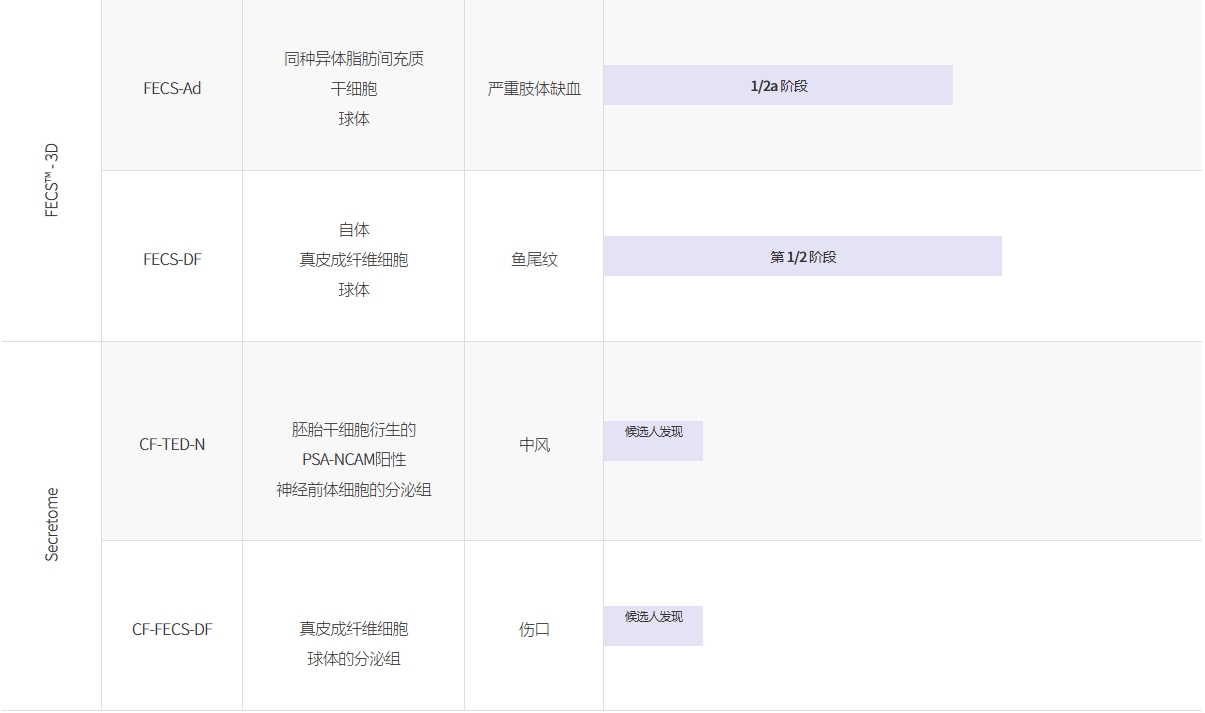
FECS-Ad:用于治療嚴重肢體缺血的3DMSC球體(已完成1/2a期)
作為韓國帕金森病治療領域的權威和開拓者,S.BIOMEDICS 正在為細胞治療創新制定國家標準。
有關帕金森病1/2a期臨床試驗的更多信息,請訪問ClinicalTrials.gov (NCT05887466)。
參考資料:
[1]:https://www.acnnewswire.com/press-release/japanese/101164/s.biomedics-cell-therapy-for-parkinson’s-disease-shows-positive-data-from-its-phase-1/2a-clinical-trial
部分圖源:S.BIOMEDICS官網
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信