中國細胞與基因治療(CGT)領域迎來精準監管里程碑!國家藥監局藥品審評中心(CDE)首次為“先進治療藥品”(ATMP)正名,并劃定清晰跑道,行業加速發展窗口正式開啟。
6月10日,國家藥監局藥品審評中心(CDE)發布《先進治療藥品的范圍、歸類和釋義(征求意見稿)》。這是我國首次在官方層面對細胞治療藥品(CTMPs)、基因治療藥品(GTMPs)等先進治療藥品(ATMP)進行明確定義、科學歸類和系統闡釋。此舉標志著我國對CGT領域的監管正式邁入精準化、規范化的新時代,為產業爆發性增長掃清關鍵障礙。
一、 破局:精準監管呼之欲出
近年來,干細胞療法、基因治療、CAR-T細胞療法等革命性技術突飛猛進,在攻克癌癥、罕見遺傳病等頑疾上展現出巨大潛力,國內相關產品研發與國際日漸“并跑”。然而,監管標準的模糊性長期困擾行業:審批路徑不明、注冊類別不清,企業在安全性、有效性及質量控制方面面臨諸多不確定性,患者翹首以盼的新療法也受阻于上市瓶頸。
為此,CDE牽頭起草該征求意見稿,旨在實現多重突破:
厘清邊界:嚴格定義ATMP范圍,消除監管灰色地帶;
精準施策:實施分級分類監管,提升審評效率與科學性;
國際接軌:對標EMA(歐)、FDA(美)等國際先進體系,便利國際合作;
提速惠民:加速創新藥物上市,滿足患者迫切的臨床需求。
二、 立規:三大類別確立“新身份”
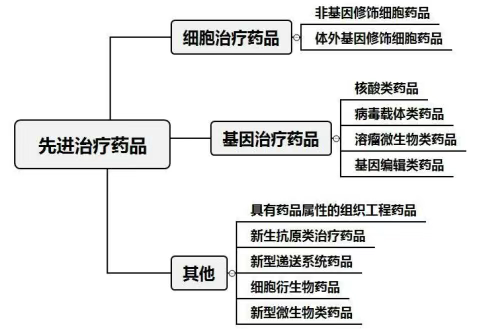
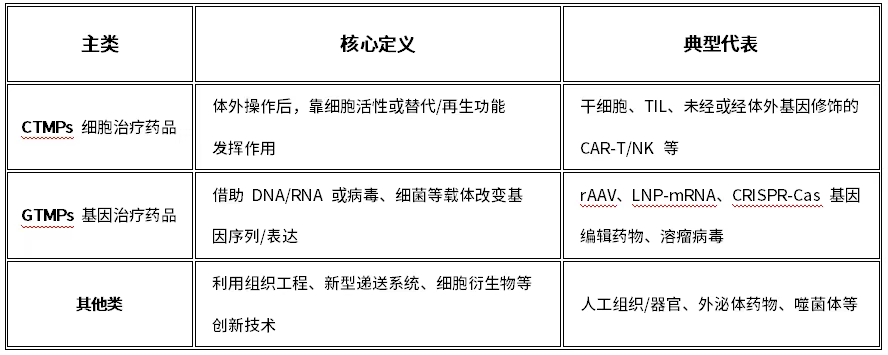
新政首次在官方文件中將先進治療藥品(ATMP)明確劃分為三大核心類別:
細胞治療藥品(CTMPs):涵蓋干細胞、NK細胞、TIL細胞等,無論是否經過體外基因修飾(如CAR-T、CAR-NK)。核心在于利用細胞本身,通過再生修復、替代或免疫調節發揮作用。
基因治療藥品(GTMPs):利用病毒(如rAAV)、非病毒載體或核酸分子(如mRNA、CRISPR基因編輯工具)在體內調節基因序列或表達。
其他先進治療藥品:為未來創新預留空間,包括組織工程產品、人造組織、外泌體藥物等。
值得矚目的科學決策:政策將CAR-T細胞療法明確歸類為“體外基因修飾的細胞治療藥品”,而非部分國際做法中的基因治療藥品類別。這充分體現了我國監管機構基于科學認知的獨立判斷和靈活性。
三、 賦能:多方共享政策紅利
新政落地,將為產業鏈條上的各方帶來實質性利好:
患者福音:審批有望提速,藥品質量與安全更有保障,獲取前沿治療的通路將更順暢。
企業減負:注冊路徑與類別高度清晰化,大幅降低研發的合規成本與不確定性,顯著激發創新活力。
監管提效:分級分類標準明確,助力審評資源優化配置,提升監管效能與科學性。
資本導航:清晰的政策導向為投資決策提供強有力依據,引導資金更精準地流向真正有前景的創新項目。
四、 展望:開啟產業躍升新紀元
該新政的深遠影響,將推動中國CGT產業邁入高質量發展新階段:
加速全球接軌:分類體系與EMA的ATMP、FDA的CGT框架高度協同,極大便利國內產品參與國際多中心臨床試驗,助推中國創新藥走向全球。
打通配套鏈條:為后續出臺更細致的技術指南、倫理規范、生物安全細則,以及關鍵的醫保/商保支付、患者援助計劃等奠定堅實基礎,全面提升藥物可及性。
激發源頭創新:“其他類”的設置明確鼓勵新型遞送技術、外泌體、組織工程等前沿探索,為企業開辟了更廣闊的創新賽道。
結語:精準監管鋪就“快車道”,CGT未來可期
此次《征求意見稿》的發布,絕非一份普通文件。它標志著中國細胞與基因治療領域正式告別“摸著石頭過河”,駛入了由國家頂層設計護航的發展快車道。
清晰的身份認定、科學的分類標準、高效的監管路徑——這不僅是中國CGT監管史上的里程碑事件,更是萬千患者的希望之光、創新企業的強勁引擎、資本市場的明確航標。干細胞、基因編輯、外泌體等尖端療法,將在更規范、更高效、更安全的環境中加速惠及中國患者。
期待業界同仁積極參與意見反饋,共同完善這一劃時代的政策框架,助力中國細胞與基因治療產業駛向更加輝煌壯闊的未來!
信息來源: 國家藥品監督管理局藥品審評中心(CDE)
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信