概述:本綜述總結了目前基于干細胞治療腎臟疾病的治療方法,包括各種細胞來源、動物模型或體外研究。還強調了從實驗室原理驗證到廣泛臨床應用的挑戰(zhàn)以及迄今為止報告的人體臨床試驗結果。
腎臟疾病是全球普遍存在的健康問題。目前腎臟疾病的常規(guī)治療中使用的多藥療法只能延緩疾病進展。這些藥物或治療方法都不能逆轉疾病的終末期進展。因此,探索新的治療方法以改善患者的生活質量并可能治愈、逆轉或緩解腎臟疾病至關重要。
干細胞具有無限復制和體外分化成腎細胞的能力,因此作為腎臟疾病再生醫(yī)學的一種形式具有廣闊的潛力。在實驗性腎臟疾病模型中施用干細胞的越來越多的證據(jù)表明,基于干細胞的療法具有治療或腎臟保護作用,可以減輕腎臟損傷,同時改善腎小球和腎小管區(qū)的功能和結構。細胞療法的成功可能會擴大未來再生醫(yī)學的范圍。

干細胞治療腎臟疾病
近年來,許多研究試圖找出腎臟修復的潛在機制,以探索腎臟的潛在再生能力。
這些研究的主要目的是確定成人腎臟的再生能力是否可以由終末分化細胞支持,腎臟中是否存在多能祖細胞,以及腎外來源的干細胞治療是否有助于腎臟修復、促進或加速再生過程。許多論文報道了不同來源的干細胞在治療多種不同病癥(包括腎臟疾病)方面的潛在用途。
不同來源的干細胞在腎臟疾病模型中的療效已通過實驗得到不同程度的證實。從最初被廣泛駁斥的干細胞整合到宿主腎組織的結果,到干細胞介導修復的旁分泌假說,該領域引起了很大的期望。
當前的研究工作重點是各種干細胞類別,這些干細胞的來源、可用性以及分化、遷移和增殖能力各不相同,從而進一步增強了根據(jù)患者個體需求量身定制治療的能力。了解不同干細胞類型的特性以及獲取和提供細胞療法的可用方法,對于了解它們在腎臟疾病臨床應用的潛力非常重要。
在一些國家,干細胞療法療法已經(jīng)被作為當?shù)乇O(jiān)管機構批準用于特定疾病或健康指征的商業(yè)產品上市。因此,這種干預形式可以為人類疾病的下一代再生醫(yī)學鋪平道路。
干細胞分類和治療應用
干細胞具有自我更新和分化成多種細胞類型的能力;然而,每種干細胞類別的固有特性都提供了獨特的優(yōu)勢和機會(圖1)。
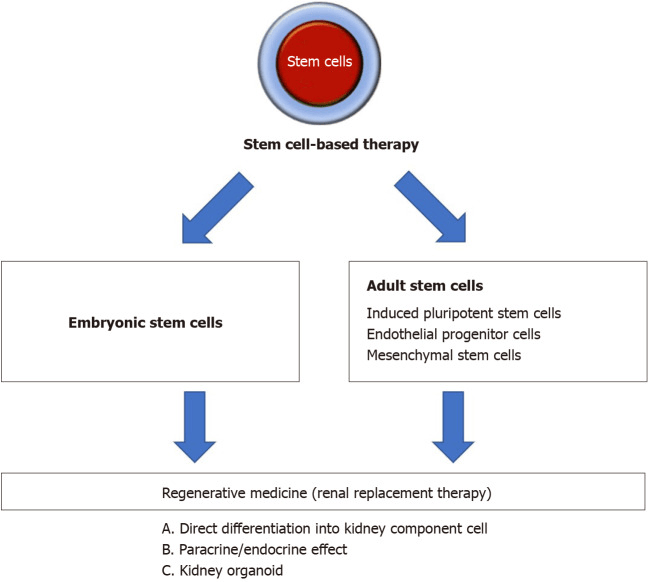
胚胎、誘導多能、內皮祖、間充質干細胞治療腎臟疾病的研究進展
1.胚胎干細胞治療腎臟疾病
胚胎干細胞(embryonic stem cells, ES)來源于胚泡內細胞團,獲取ES的技術、法律程序和倫理道德目前已十分成熟,但處于未成熟、未分化狀態(tài)的胚胎干細胞,植入宿主體內后,可能會出現(xiàn)不受控制的細胞增殖和腫瘤或畸胎瘤形成。
胚胎小體通過維甲酸、活化素-A和骨形成蛋白-7(bone morphogenetic protein-7, BMP-7)處理后,可使 ES細胞直接分化為腎前體組織【1】,并導致中胚層和腎發(fā)育過程中大量標志物的表達。此外,將處理后的 EBs注射入培養(yǎng)的后腎移植物中,可與發(fā)育中的腎小管100%融合。
2013年6月5日,南開大學藥物化學生物學國家重點實驗室牽頭在《中國科學通報 》上發(fā)表了一篇關于人類胚胎干細胞衍生的內皮細胞療法通過刺激急性腎損傷中腎臟駐留干細胞增殖促進腎臟再生的文章。【2】

研究人員將培養(yǎng)的人胚胎干細胞衍生內皮細胞(hESC-EC (1×106 ) )注入缺血性腎臟。
研究報告稱,在注射hESC-EC后24小時檢測到大量生物發(fā)光活動,隨后從1天到14天逐漸下降。人類ESC-EC 顯著加速了腎臟細胞增殖,以應對缺血引起的損傷,這由BrdU+細胞數(shù)量增加表明。
腎臟干細胞增殖標志物Sca-1和BrdU的共表達進一步表明,觀察到的腎細胞再生刺激至少部分是由于腎臟駐留干細胞增殖增加,尤其是在髓索和小動脈內。在腎臟恢復的早期階段還觀察到hESC-EC向平滑肌細胞的分化。
總之,我們的結果表明內皮細胞療法通過促進急性腎損傷中的血管化、轉分化和內源性腎干細胞增殖來促進腎臟恢復。
2019年,Vazquez-Zapien等人在期刊Rom J Morphol Embryol上進一步報道了在順鉑誘發(fā)的腎衰竭小鼠注射小鼠胚胎干細胞后,其死亡率顯著下降,并防止了疾病相關的組織學進一步惡化。【3】

結論:在患有腎衰竭的小鼠中植入胚胎干細胞可顯著降低死亡率,避免與疾病相關的更嚴重的組織學惡化。
盡管胚胎干細胞(ESC)具有臨床潛力,但致瘤風險以及法律和倫理問題仍阻礙著ESC療法的發(fā)展。此外,ESC衍生的分化細胞本質上是同種異體,因此可以表達特定的表面蛋白來觸發(fā)受體的免疫系統(tǒng)。因此,如果同種異體移植物無法與受體實現(xiàn)免疫相容性,則可能會發(fā)生急性和慢性排斥反應,即移植物抗宿主病。
2.誘導性多能干細胞治療腎臟疾病
誘導性多能干細胞 (iPSC) 具有許多與胚胎干細胞(ESC)相同的再生特性。
早在2006年,Takahashi和Yamanaka證明,通過引入四種轉錄因子 (OCT4、SOX2、KLF4 和 c-MYC),小鼠成纖維細胞可以重新編程為iPSC。這一突破性發(fā)現(xiàn)成為干細胞研究的里程碑。【4】。
基于誘導性多能干細胞的療法的開發(fā)可以克服與使用胚胎干細胞相關的特定問題,例如由于細胞來源而產生的倫理問題以及接受者患者可能產生的細胞排斥。
迄今為止,iPSC已從成纖維細胞、臍帶血、外周血和角質形成細胞中生成。研究人員還成功地從系膜細胞、腎小管細胞和腎上皮細胞中生成了iPSC 。人們認為,來自腎細胞的重新編程iPSC可能有助于遺傳性腎臟疾病的研究,從而可能促進新療法的開發(fā)。
2020年3月16日,解放軍總醫(yī)院在國際期刊泌尿外科雜志上發(fā)表了一篇關于誘導性多能干細胞 (iPSC) 衍生的間充質干細胞 (MSC) 在修復急性腎損傷方面表現(xiàn)出與成人MSC相當?shù)男Ч难芯砍晒?sup>【5】