間充質干細胞 (MSC) 在1960年代后期首次被定義為源自骨髓 (BM)的成纖維細胞樣細胞,具有高度分化和自我更新的多能性。后來,卡普蘭等人等發現骨髓來源的成纖維細胞樣細胞也具有成骨和軟骨形成能力,并于1991年將這些細胞命名為“MSCs”。
然后,已發現MSC可以分化為其他幾種間充質組織,例如肌細胞和脂肪細胞. 進一步的研究表明, MSC可以在體外分化成不同的譜系,包括上皮細胞、神經元細胞、星形膠質細胞形態、內皮細胞和平滑肌細胞,這取決于共培養細胞類型的特定條件。
同時,Dazzi等人和Taechangam等人表明多能能力、支持BM中的造血功能及其免疫調節作用積極賦予 MSCs治療作為一種有前途的治療策略。
許多研究報道,可以從脂肪組織中分離出MSCs。已經表明,具有多能性的脂肪MSCs (AMSCs) 會產生脂肪細胞、神經細胞、軟骨細胞、肌細胞和成骨細胞譜系。其他報道發現,源自AMSCs的外泌體可以減輕炎癥反應,促進傷口愈合,抑制骨關節炎軟骨退化。MSCs恢復粘膜免疫力并恢復老年人的粘膜免疫衰老。此外,將AMSCs重編程為低免疫原性的胰島β細胞在治療犬糖尿病方面取得了理想的治療效果。
間充質干細胞來源
間充質干細胞來源也可以從新生兒組織中分離出來,包括人臍帶血(HUCB-MSCs)、臍帶MSCs(HUC-MSCs)、羊水(HAF-MSCs)、胎盤MSCs(HP-MSCs)和羊膜(HAM -MSCs)?,已用于治療動物模型和腦出血(ICH)患者的神經功能缺損。最近,一項臨床試驗的報告發現,對于中度和重度冠狀病毒病2019(COVID-19)患者,靜脈輸注HUC-MSCs是安全且耐受性良好的,這可能被認為是針對潛在異常的有前途的治療方法。間充質干細胞具有免疫調節和抗炎特性的HUC-MSC移植出現在免疫和炎癥性疾病中,被認為是未來治療利用的前景。
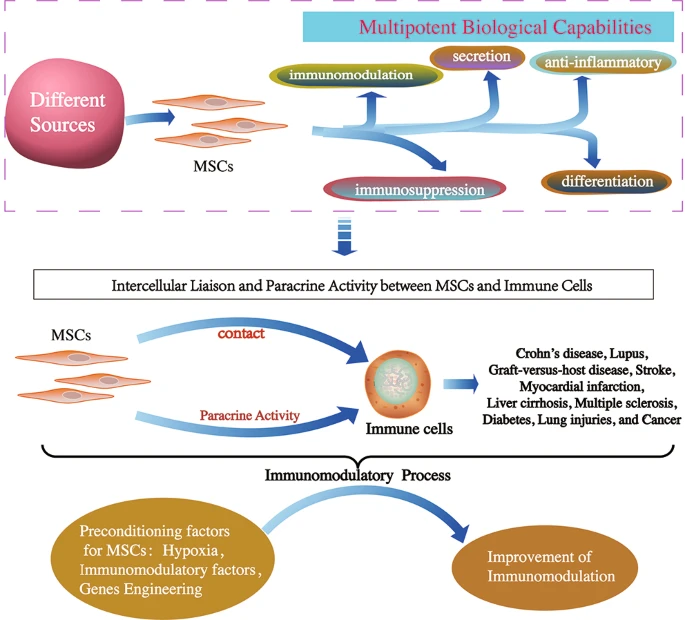
MSCs通過免疫抑制、抗細胞凋亡、抗炎、抗纖維化、促血管生成、抗腫瘤生成、神經保護、抗菌和化學吸引作用等機制在修復受損組織中發揮關鍵作用。這些獨特的特性賦予MSCs作為再生醫學中有前途的候選者,并在炎癥性疾病和癌癥中具有吸收治療潛力??。
最初,MSCs主要用作再生醫學組織修復的有前途的細胞療法。已經表明,它們已被批準用于自身免疫性疾病的臨床研究,包括克羅恩病、狼瘡和移植物抗宿主病 (GVHD) 。同樣,在臨床前和人類轉化研究中,MSC已被研究用于治療不同疾病的潛力,包括中風、心肌梗塞、肝硬化、多發性硬化癥、糖尿病、肺損傷和癌癥。
此外,作為潛在治療方法的MSCs除了具有多效性外還具有免疫調節功能,已針對各種免疫疾病進行了研究。MSCs通過直接的細胞間接觸及其與先天性和適應性免疫系統中免疫細胞的分泌能力,強有力地發揮其免疫調節作用。到目前為止,跨組織來源和物種的MSCs的免疫調節功能已經得到很好的復制和臨床相關。在這篇綜述中,我們總結了最近MSCs在不同疾病中的免疫調節特性,并討論了各種疾病的潛在治療靶點。
間充質干細胞的免疫調節
最近的研究結果表明,MSCs通過特殊的細胞因子非依賴性機制進行與單核細胞和調節性T細胞 (Treg) 相關的免疫調節活性。AMSCs顯示出比BMSCs更多的潛在免疫調節作用,表明AMSCs可以作為免疫調節療法的更好替代品。相比之下,HUC-MSCs對體內同種異體免疫風險的反應最小,將HUC-MSCs視為合適的治療候選者。
一些報道還發現,異種人MSCs有可能在小鼠腫瘤疾病、綿羊脛骨缺損、豬骨軟骨重建和犬科動物軟骨再生中表現出積極的能力。具有較低弱免疫原性的異種人MSCs在臨床前和臨床研究中具有治療潛力。因此,我們總結了原始和修飾的MSCs的免疫調節作用,并回顧了目前對其免疫調節方面的理解。
通過細胞間聯絡的免疫調節
許多臨床前研究報告稱,MSCs的給藥通過與由T細胞、B細胞、中性粒細胞、單核細胞、巨噬細胞、自然殺傷 (NK) 細胞和樹突狀細胞 (DC) 組成的免疫細胞進行交流,參與先天性和適應性免疫反應),通過細胞間聯絡和旁分泌作用發揮免疫調節作用(圖1)。
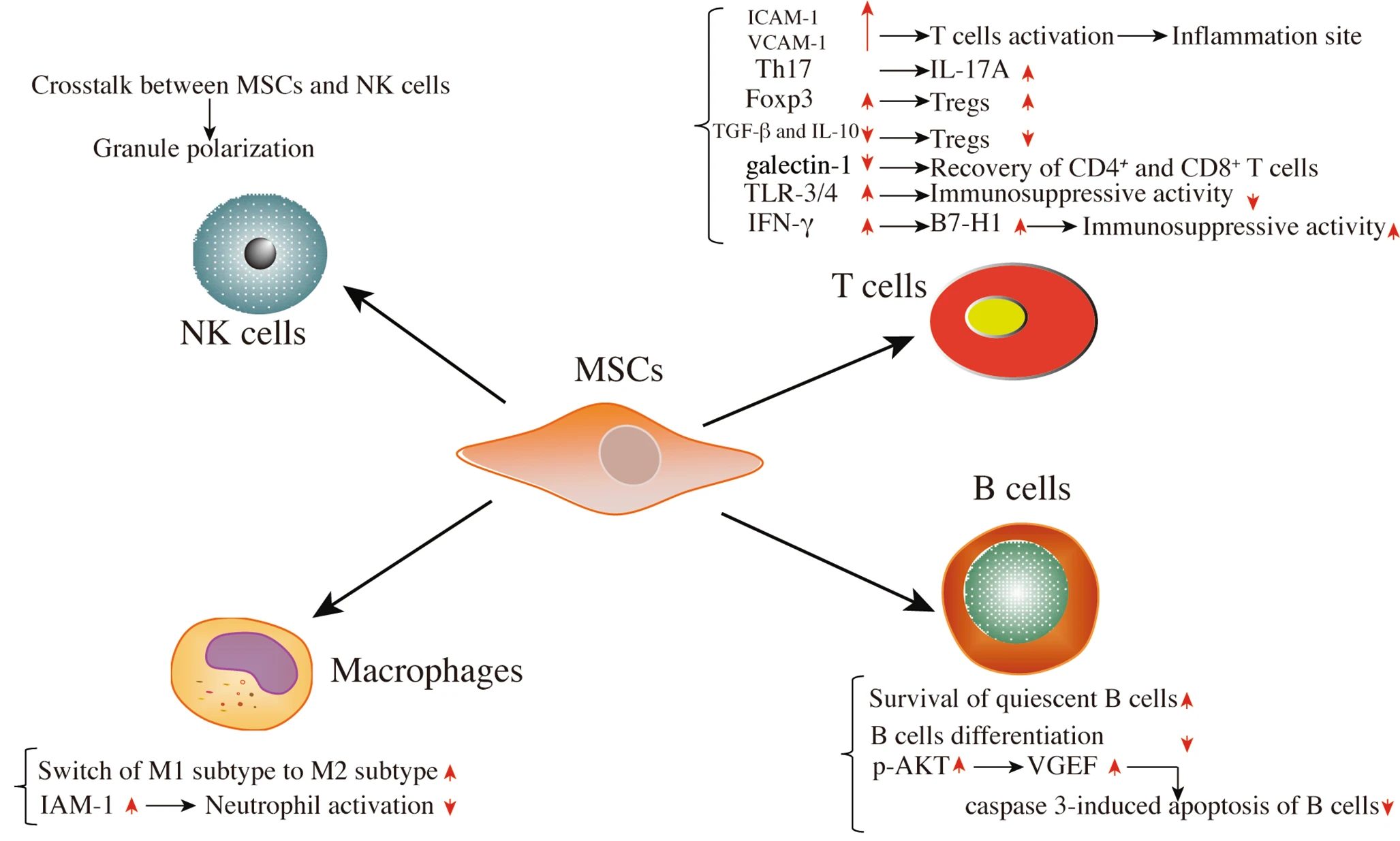
MSCs主要通過與T細胞、B細胞、自然殺傷(NK)細胞、巨噬細胞等免疫細胞的相互作用發揮免疫調節作用,細胞間接觸與蛋白表達的調節有關。
適應性免疫中的細胞間聯絡
如體外實驗所示,BMSCs在物理上阻礙了幼稚和記憶T細胞反應以非同源方式與抗原呈遞細胞 (APC) 結合。該功能通過血管細胞粘附分子-1 (VCAM-1) 和細胞間粘附分子-1 (ICAM-1) 的分泌增強表現出來,有利于T細胞活化和白細胞向炎癥部位募集,發揮關鍵作用在免疫抑制能力中的作用。
先天免疫中的細胞間聯絡
除了適應性免疫系統外,MSCs還基于細胞間聯絡機制作用于先天免疫系統。
MSC發揮免疫調節活性的各種已知機制如圖1所示 。然而,它需要大量的臨床前研究才能轉化為臨床研究。
通過旁分泌活動進行免疫調節
MSC的分泌蛋白組
MSC 還通過釋放分泌蛋白組來發揮或傳遞顯示其免疫調節功能的調節信息。這種源自具有免疫調節功能的 MSC 的分泌蛋白組由一系列細胞因子、生長因子、趨化因子和細胞外囊泡 (MSCs-EV) 組成,它們與先天和適應性系統的免疫細胞相互作用,調節免疫和癌細胞功能。
根據它們的大小和來源,MSCs-EVs中封裝的旁分泌分子通常分為來自多泡內體的外泌體(30-120nm)、來自質膜的微泡(MV)(100-1000 nm)和凋亡小體。MSC-EV與免疫細胞之間的相互作用可被視為炎癥、感染和自身免疫性疾病的理想治療前景。盡管MSC-EV在免疫調節功能方面與母體MSC相似,但MSC的旁分泌功能取決于適當的培養條件。因此,了解MSC的旁分泌功能以提高其免疫調節作用至關重要(表1)。
表1:MSCs的分泌蛋白組
| cytokines | chemokines | Growth factors | Other factors |
|---|---|---|---|
| IFN-γ, TGF-β, TNF-α, LIF, MIF, OSM, G-CSF, M-CSF, GM-CSF FLT3LG, SCF, Thrombopoietin, TSG-6, IL-1α, IL-1β, IL-2, IL-3, IL-6~8, IL-10-13, IL-16, | CCL1, CCL2, CCL5, CCL8, CCL11, CCL15, CCL16, CCL18, CCL22~24, CCL26, CXCL1-3, CXCL5, CXCL6, CXCL8, CXCL11~13, CX3CL1, XCL1 | BDGF, NGF, GDNF, PIGF, PDGF, VEGF, HGF, EGF, IGF-1, FGF-2, FGF-4, FGF-7, FGF-9, BMP-7 | phospholipids, Adrenomedullin, Adiponectin, Osteoprotegerin, miRNAs, mRNAs, long non-coding RNAs, CXCR3, PGE2, PAI-1, MMP1, MMP3, MMP9, MMP10, MMP13, TIMP-1~4, Leptin, IGFBP-1~4 |
間充質干細胞在適應性免疫系統中的旁分泌功能
MSCs根據其旁分泌分泌對適應性免疫系統發揮免疫調節特性。
間充質干細胞在先天免疫系統中的旁分泌功能
MSCs通過急性抑制IL-2介導的靜息NK細胞增殖與NK細胞交流,并改善先天免疫系統的NK功能。
由細胞因子、生長因子和趨化因子組成的源自MSC的不同分泌蛋白組參與了適應性和先天性免疫系統以發揮免疫調節作用(圖2)。
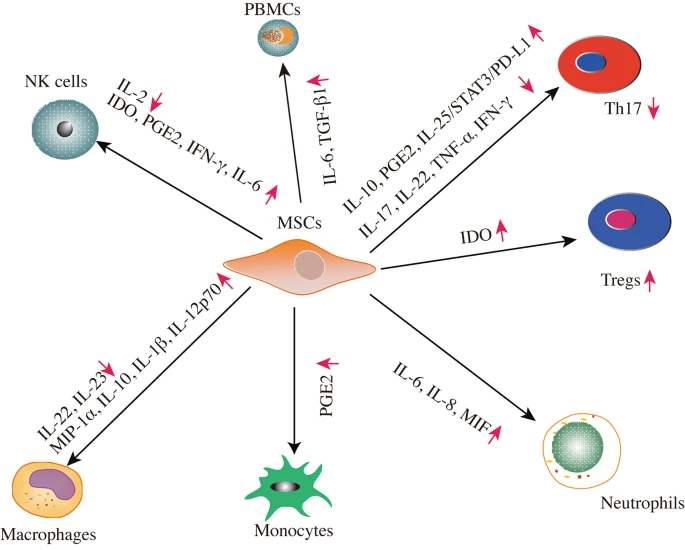
MSC通過旁分泌活動與免疫細胞(如T細胞、自然殺傷 (NK) 細胞、巨噬細胞、單核細胞、PBMC和中性粒細胞)相互作用,發揮免疫調節作用。MSCs的分泌蛋白組分泌一系列細胞因子、生長因子和趨化因子來發揮其免疫調節功能。
通過修飾的間充質干細胞提高免疫調節能力和治療效果
越來越多的證據表明,預處理的MSCs可以提高它們的旁分泌效力和治療能力。已經表明,用缺氧、生長因子、熱休克蛋白 (Hsp)、LPS、藥物制劑、化學制劑、血清剝奪或炎癥刺激預處理的MSCs具有通過增加細胞保護基因和修復因子的分泌。因此,預處理條件可以在體外培養中調節MSCs的分泌蛋白。分析分泌蛋白組對各種生物過程的影響至關重要,包括免疫調節、血管生成、抗纖維化、神經發生、傷口愈合、組織修復以及組織修復和再生的抗腫瘤。
間充質干細胞的免疫調節機制治療疾病的臨床試驗
已經進行了39項研究來調查臨床試驗中MSC的免疫調節作用。他們關注的疾病是感染、糖尿病、膝骨關節炎、復發緩解型多發性硬化癥(RRMS)、克羅恩病等,代表了臨床上最常見的免疫系統疾病(表2)。
最近的I/IIa期試驗(標識符:https ://clinicaltrials.gov/ct2/show/NCT02351011) 對12名晚期Kellgren-Lawrence膝骨關節炎患者每人使用了5000萬劑量的BMSC。結果表明,施用源自髂后上棘BM的自體 BMSCs可提高生活質量,關節內注射安全,無嚴重不良事件,并有助于改善滑膜炎癥和疼痛。
同樣,進行的II/III期研究(臨床試驗編號:(UMIN-CTR編號iii:UMIN000006719)表明BMSC移植提高了 25名急性GVHD(類固醇難治性III級或IV級)患者的總體存活率,沒有觀察到的不良事件。
在一項開放標簽IIa期研究(臨床試驗編號:NCT00395200)中,將劑量為1.6×106個細胞/kg體重的自體 BMSC安全地給予繼發性進行性多發性硬化癥 (SPMS) 患者,并改善結構、功能和生理學證明了神經保護作用。
在針對34名患有中度至重度 (AD) 特應性皮炎成年患者的I/IIa期研究中,皮下輸注高劑量HUC-MSC(5.0 ×107個細胞)在治療上改善了疾病特征,表明嚴重程度評分顯著降低,并且濕疹面積、特應性皮炎嚴重程度指數、瘙癢評分、血清IgE水平和血嗜酸性粒細胞數。
一項與連續12名難治性瘺管克羅恩病門診患者進行自體BMSCs連續瘺管內給藥相關的初步研究表明,局部BMSCs治療是可行的、安全的,并且通過調節粘膜T細胞凋亡率和7例持續完全閉合的患者對這種疾病有益在12名患者中觀察到瘺道。成功的隨機雙盲對照III期臨床試驗(ClinicalTrials.gov,注冊號NCT01541579)利用擴增的同種異體AMSC(單次病灶內注射1.2×109細胞)治療212名患有難治性復雜肛周瘺管的克羅恩病患者表明,解凍后培養至少24小時的恢復期可提高MSC的質量。
| 疾病 | MSCs的起源 | 治療途徑 | 確定的免疫調節作用 | 參考 | ||
|---|---|---|---|---|---|---|
| 臨床前研究 | ||||||
| 卵巢癌小鼠模型 | 小鼠致密骨間充質干細胞 | 腹腔注射 | 激活CD4+和CD8+T細胞并抑制Tregs | [88 , 89] | ||
| 腎同種異體移植 | 小鼠骨髓間充質干細胞 | 靜脈注射 | 抑制T細胞和改善Tregs生成 | [114] | ||
| 敗血癥小鼠 | HUC-間充質干細胞 | 靜脈注射 | 提高抗炎作用,增加Treg細胞,促進巨噬細胞吞噬,增強修復性巨噬細胞,分泌更多VEGF | [171] | ||
| 哮喘小鼠 | 小鼠骨髓間充質干細胞 | 腹腔注射 | 更好的免疫調節作用 | [172] | ||
| 患有急性肝功能衰竭的小鼠 | 小鼠AMSC | 靜脈注射 | 去除碎片并改善IL-6肝再生 | [173] | ||
| 小鼠炎癥性腸病 (IBD) | 腸道淋巴集結 MSCs | 靜脈注射 | 改善小鼠IBD模型癥狀 | [174] | ||
| GVHD小鼠 | 人類間充質干細胞 | 靜脈注射 | PD-1 配體的參與、臨床評分的降低和小鼠存活時間的延長 | [175] | ||
| 急性呼吸窘迫綜合征 (ARDS) 小鼠 | HUC-間充質干細胞 | 靜脈注射 | 改善 ARDS 的肺損傷并使 YAP 失活以促進 II 型肺泡上皮細胞 (AECII) 分化。 | [176] | ||
| 小鼠堿燒傷模型 | 小鼠骨髓間充質干細胞 | 局部注入 | 增強它們的免疫調節和促血管生成能力,減少促炎性 IL-1β | [177 , 178] | ||
| 宿主的免疫系統 | HUC-間充質干細胞 | 靜脈注射 | 中性粒細胞百分比和中性粒細胞化學引誘物濃度的升高 | [179] | ||
| 臨床試驗 | ||||||
| 疾病 | MSCs的起源 | 治療途徑 | 臨床試驗編號 | 階段 | 確定的免疫調節作用 | 參考 |
| 骨關節炎 | 自體骨髓間充質干細胞 | 關節內輸液 | NCT02351011 | I/II臨床試驗 | 減少滑膜炎癥和疼痛 | [161] |
| 類固醇難治性 III 級或 IV 級急性 GVHD | 自體骨髓間充質干細胞 | 靜脈注射 | UMIN000006719 | II/III期臨床試驗 | 提高整體存活率 | [162] |
| 多發性硬化癥 | 自體骨髓間充質干細胞 | 靜脈注射 | NCT00395200 | IIa臨床試驗 | 改善結構、功能和生理 | [163] |
| 中度至重度特應性皮炎 | HUC-間充質干細胞 | 皮下注射 | NCT01927705 | I/II臨床試驗 | 嚴重程度評分和濕疹面積、特應性皮炎嚴重程度指數、瘙癢評分、血清 IgE 水平和血液嗜酸性粒細胞數量的減少 | [164] |
| 克羅恩病 | 自體骨髓間充質干細胞 | 瘺管內注射 | / | / | 一種可行、安全和有益的療法 | [165] |
| 克羅恩病 | 同種異體AMSC | 瘺管內注射 | NCT01541579 | 三期臨床試驗 | 長期療效和安全性 | [166 , 167 , 168 , 169] |
| 胃腸道腺癌 | 自體骨髓間充質干細胞 | 靜脈注射 | 歐盟臨床試驗注冊2012-003741-15 | I/II臨床試驗 | 良好的安全性和耐受性 | [180] |
然而,很明顯,一些副作用的誘導可能是由MSCs相關治療介導的。例如,最近的臨床前研究表明,大腦微環境的急性低溫調節了鼻內MSCs的功能,增強了持久的運動認知缺陷和內皮激活,導致促炎環境,增加了外周免疫細胞浸潤,這加劇了缺氧缺血性大腦的腦損傷。
有希望的策略有可能提高未來試驗的間充質干細胞的功效
臨床前報告表明,MSCs的不同給藥方式和修飾因子具有治療不同疾病的潛力。最近的研究表明通過靜脈內遞送MSC或取決于內源性MSC的遷移和動員來歸巢至損傷部位的MSC。MSCs (FGF21-MSC) 中成纖維細胞生長因子21 (FGF21) 的過表達表明,在創傷性腦損傷 (TBI) 小鼠模型中,MSCs對損傷部位的歸巢能力得到改善。
提高MSCs有效性的另一個策略是促進其低溫保存的方法。更具體地說,冷凍保存后新鮮解凍的 MSC 會阻礙功能特征,包括代謝活性和細胞凋亡的上調以及細胞增殖、免疫抑制能力、克隆形成能力和關鍵再生基因的下調。值得注意的是,24小時的適應期重新激活了解凍的細胞,減少了細胞凋亡并增強了高遷移率族箱 (HMOX-1) 和腫瘤壞死因子刺激基因6 (TSG-6) 基因的表達,具有抗炎作用和具有血管生成作用的VEGF基因表達。因此,MSCs應該標準化以實現穩健的質量和可靠性,特別是在大規模冷凍MSCs產品中。
結論和未來展望
由于MSCs對其他細胞類型的趨向性和免疫調節特性,MSCs的管理已成為臨床前和臨床研究中的一種新型治療策略。由于MSCs通過與其他免疫細胞的相互作用和各種炎癥細胞因子的相互作用而修飾的免疫調節能力,MSCs可以介導各種炎癥性疾病的恢復。與MSCs免疫調節能力相關的主要機制包括細胞間聯絡和旁分泌活動,在這個過程中,MSCs被炎癥刺激、細胞外囊泡、細胞因子、趨化因子或與其他免疫細胞共培養所修飾。因此,間充質干細胞移植可以成為一種可管理的、有潛力的、可行的無細胞治療方法。
主要參考資料:Yang, G., Fan, X., Liu, Y.等。間充質干細胞的免疫調節機制和治療潛力。 干細胞 Rev and Rep (2023)。https://doi.org/10.1007/s12015-023-10539-9。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信