當胎兒由于胎盤的營養和氧氣供應不足而無法正常生長時,就會發生胎兒生長受限(FGR)。出生時患有FGR的兒童面臨終生不良神經發育結果的高風險,例如腦癱、行為問題以及學習和注意力困難。不幸的是,沒有治療方法可以保護FGR新生兒免受這些不良神經系統結果的影響。FGR新生兒大腦中普遍存在慢性炎癥和血管破壞,因此針對性治療可能是神經保護的關鍵。通過干細胞療法進行組織修復和再生已成為針對面臨神經損傷和長期殘疾風險的FGR嬰兒的潛在臨床干預措施。

這篇綜述討論了用于治療神經系統疾病的干細胞療法的研究進展,以及如何將其擴展用于FGR新生兒。將重點介紹在FGR動物模型中使用干細胞療法的領先臨床前研究,以及開發未來臨床試驗需要采取的近期步驟。
胎兒生長受限的原因
FGR的病因很復雜,病理生理過程的表現有幾個潛在的來源,包括母體(高血壓、子癇前期、營養不良)、胎盤(導致氧化應激的胎盤功能障礙)、胎兒(多胎妊娠、染色體異常)和遺傳。胎盤功能受損可導致胎兒長期缺氧、供氧不足或母體激素向胎兒循環的異常轉移。這些對胎兒的生長和發展具有重要影響。
FGR可大致分為兩類:早發型,發生在受孕后32周之前(對稱FGR);晚發型,發生在妊娠晚期(不對稱FGR)。胎兒循環再分配與遲發性FGR相關,并且是與外周器官相比,組合心室輸出優先重新分配到大腦和心臟的結果。這種“大腦保留”效應,稱為不對稱FGR,是最常見的生長受限形式,影響所有FGR嬰兒的70%-80%。早發型或對稱性FGR的特點是整個妊娠期整體生長受限,占FGR胎兒的20%-25%。
大腦保留被認為是FGR情況下的一種保護機制,但它并不能完全保護大腦免受與FGR相關的不良神經結果的影響。然而,最近的證據對這一理論提出了質疑,多項研究表明,不對稱FGR嬰兒的神經發育結果比對稱FGR新生兒更差。雖然FGR新生兒的腦損傷嚴重程度各不相同,顯然這些嬰兒仍然迫切需要神經保護。
傳統療法干預目前受到限制
隨著FGR胎兒相關妊娠臨床管理的改善,整體醫療護理提高了FGR新生兒的存活率。然而,伴隨著生存率提高的是更大的殘疾負擔、長期醫療護理以及與FGR相關的必要支持的普遍增加。這些神經系統疾病的治療范圍在很大程度上受到限制,但在過去十年中,干細胞療法因其在治療和逆轉神經系統疾病方面的潛力而引起了人們的興趣。干細胞/祖細胞表現出獨特的功能特征,使其對未來的臨床治療具有吸引力,例如通過增強受損組織周圍的分化和增殖能力從而驅動修復,以及通過發揮有效的旁分泌免疫調節作用,潛在地擴散慢性炎癥。
最近的研究表明,移植的干細胞具有遷移到受損區域的先天能力,并在帕金森病、阿爾茨海默病 (AD)、脊髓損傷、腦癱和缺血性中風模型中承擔神經元的功能。
截至今日,已有超過230項使用干細胞方法治療神經系統疾病的臨床研究已注冊 (Clinicaltrials.gov)。雖然迄今為止尚未開展干細胞應用的FGR新生兒臨床試驗,但臨床前試驗正在不斷涌現。在這篇綜述中,我們將討論目前針對FGR新生兒的可用臨床療法,并報告用于治療FGR的臨床前組織再生干細胞療法的進展。
如何保護FGR大腦?
針對炎癥和神經血管單元來保護FGR大腦
為了實現這些未來的研究,確定FGR新生兒腦損傷的治療目標機制非常重要。最近的動物研究揭示了介導FGR新生兒大腦細胞損傷的多種機制(圖1)。這些包括興奮毒性、氧化應激、壞死和凋亡變性、神經炎癥和血腦屏障(BBB)破壞。神經炎癥正在成為介導FGR中大腦異常發育的關鍵機制之一,涵蓋許多過程,包括小膠質細胞數量增加、星形膠質細胞增生、促炎細胞因子產生增加、抗炎細胞因子產生減少、趨化因子釋放和白細胞浸潤。最近的一項人體研究表明,有證據表明炎癥事件與FGR嬰兒異常神經系統結果相關。FGR新生兒在2周齡時血液中促炎細胞因子升高,這一發現與2歲時的不良神經發育結果相關。
最近的研究還使用實驗模型(包括嚙齒動物、綿羊和豬)證明了炎癥在FGR中的作用。FGR新生兒的大腦在出生后第1天就出現明顯的促炎癥狀態,在自發性FGR的臨床前豬模型中,這種狀態至少持續到第4天。這種促炎癥狀態不利于FGR大腦中神經元和白質的發育。動物研究表明,在某些大腦區域(例如頂葉皮層)普遍存在炎癥的地方,FGR新生兒大腦中成熟和未成熟的神經元和少突膠質細胞群都會受到負面影響,導致細胞破壞和損失,以及神經元上促炎細胞因子表達的增加。進一步的研究表明,針對炎癥通路的治療(如布洛芬和褪黑素)可減輕大型動物模型中與FGR相關的神經病理學,但還需要進行長期的安全性和有效性研究。這些研究強調了針對出生后炎癥的潛力,從而減少或消除FGR新生兒持續的神經發育問題。
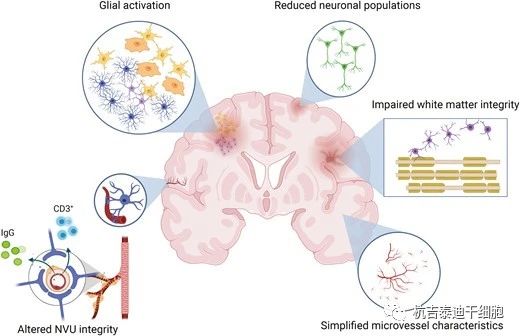
炎癥可能是導致神經病理情況下神經血管單元(NVU)功能障礙的關鍵介質。NVU是中樞神經系統的一個多細胞區,是大腦與血液(BBB)之間的屏障。組成NVU的細胞包括血管內皮細胞、神經膠質細胞(星形膠質細胞和小膠質細胞)、神經元、周細胞和基底膜。NVU在保護大腦免受有毒物質進入方面起著至關重要的作用,而有毒物質會對大腦產生長期的病理影響。在FGR新生兒的大腦中,內皮細胞數量明顯減少,星形膠質細胞末梢與血管之間的相互作用消失。使用抗炎藥物(布洛芬、褪黑素)治療不僅可減輕炎癥反應,還可減少NVU破壞,使神經膠質血管相互作用正常化,這表明大腦微環境是健康的。這些研究表明,FGR中NVU的破壞可能會加劇早期神經炎癥反應,因此早期針對炎癥通路和NVU的治療方法可能會保護FGR新生兒。
干細胞治療神經系統疾病
在過去的二十年中,對體內存在的干細胞群的生物學認識顯著增加。在此期間,已在治療神經系統疾病的背景下鑒定了幾種干細胞群,例如源自胚胎干細胞 (ESC) 和誘導多能干細胞 (iPSC) 編程的干細胞群。這包括神經干細胞(NSC)。間充質干細胞(MSC)、羊膜上皮細胞(AEC)和內皮祖細胞(EPC)也在神經系統疾病治療中進行了研究。這些群體已成功從胎兒(胎盤、臍帶血[UCB])和成人(脂肪、牙髓、骨髓、腦)組織中分離出來。此外,Yamanaka等人的iPSC的出現和開發為干細胞作為研究神經元穩態和神經疾病發展的遺傳基礎的代理奠定了基礎,同時也引起了人們對干細胞在臨床組織修復和再生治療中潛在大規模應用的興趣。
迄今為止,這些干細胞治療的臨床前和臨床應用旨在通過使用神經干細胞重新增殖星形膠質細胞和少突膠質細胞來修復神經損傷,通過驅動血管生成/血管生成來恢復EPC的血流,并通過MSC和AEC的有效免疫調節和旁分泌作用消除慢性炎癥。
干細胞技術與FGR的臨床試驗
目前還沒有臨床試驗研究干細胞治療對FGR新生兒神經保護的潛力。不過,目前有幾項注冊的試驗與鄰近的新生兒神經發育和心血管疾病有關,如HIE和早產新生兒。此外,對23名HIE新生兒進行的自體UCB細胞I期臨床試驗(NCT00593242)結果顯示,嬰兒存活率提高,神經發育結果改善,存活期長達1歲。此外,HIE通常在出生時急性發作,與FGR嬰兒出生前后的慢性腦重塑形成鮮明對比。
FGR臨床前試驗中的干細胞遞送
除了缺乏FGR嬰兒的臨床試驗外,臨床前動物模型研究也有限,迄今為止發表的研究僅有3篇(表1)。這些研究,包括FGR大鼠模型和2項大型動物研究,顯示出有希望的神經保護結果,報告了大腦干細胞治療后的多區室益處。

干細胞移植治療FGR的時機和方法
雖然FGR是一種慢性疾病,但它并不是全面缺血,隨著時間的推移,區域腦血流的 分布會出現差異,導致從妊娠27周開始的不良腦事件,并在產后持續存在。這一時期由于腦血管脆弱,NVU極易受損,但神經系統可塑性強,膠質細胞和NSC細胞增殖 ,突觸生成旺盛,髓鞘化加速。
例如,目前正在研究宮內臍靜脈輸送間充質干細胞,以治療先天性疾病。然而,如上所述,FGR早產兒檢測能力有限,這表明要滿足目前的臨床能力,產后干細胞療法仍是最容易獲得的方法。但這并非沒有益處,因為研究表明,子宮內生長過程的改變可在產后進行修正,改善FGR的結果,許多神經可塑性可維持至出生后2年,包括NVU的早產。無論如何,對FGR胎兒、新生兒和嬰兒的炎癥事件和NVU破壞的時空剖析將為最佳治療時機提供明確信息。
臨床FGR治療開發中的另一個考慮因素是干細胞輸送方法。目前還沒有研究直接比較臨床前FGR或嬰兒神經系統疾病的分娩方法,靜脈 (IV) 分娩目前被認為是最有利的,因為其侵入性低且治療新生兒FGR結果顯示有效。然而,對于新生兒模型中系統干細胞遞送的脫靶歸巢和隔離的研究很少。這是值得關注的,因為靜脈注射與周圍器官匯集相關,例如在肺部,導致神經功效降低,并可能與肺部并發癥相關。干細胞遞送的其他方法包括高度靶向的腦實質內遞送,該方法已使用MSC成功治療了小鼠新生兒缺氧缺血性腦損傷,以及鼻內遞送,該方法是微創的,并且由于良好的新生大鼠HIE和中風結局而近年來受到歡迎。
結論
總之,FGR引起的神經功能損傷是一種慢性疾病,會導致嚴重的長期損傷,目前幾乎沒有治療方法。隨著我們對干細胞群生物學的了解不斷加深,再加上在神經元和血管結構再生以及減少炎癥方面令人鼓舞且成功的臨床前研究的進展,用于出生后不久的FGR新生兒的細胞療法的進展無疑值得進一步研究。
從現有證據來看,神經干細胞作為FGR的神經保護劑提供了最大的潛力,甚至可能刺激對其他炎癥和NVU神經系統疾病的多細胞方法的進一步研究。
參考資料:Kirat Chand and others, Stem Cell Therapy for Neuroprotection in the Growth-Restricted Newborn, Stem Cells Translational Medicine, Volume 11, Issue 4, April 2022, Pages 372–382, https://doi.org/10.1093/stcltm/szac005
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信