自27年前首次衍生出人類多能干細(xì)胞 (hPSC) 以來(lái),控制其分化和制造的技術(shù)取得了巨大進(jìn)步,使得越來(lái)越多的 hPSC 衍生產(chǎn)品臨床試驗(yàn)成為可能。
近日,期刊雜志《Cell Stem Cell》一篇標(biāo)題為《臨床試驗(yàn)中的多能干細(xì)胞療法:2025年更新》的文章。在這里,我們回顧了全球介入性 hPSC 試驗(yàn)的概況,重點(diǎn)介紹了臨床安全性和有效性的現(xiàn)有數(shù)據(jù)。

截至2024年12月,我們確定了116項(xiàng)獲得監(jiān)管部門批準(zhǔn)的臨床試驗(yàn),測(cè)試了83種hPSC產(chǎn)品。大多數(shù)試驗(yàn)針對(duì)的是眼睛、中樞神經(jīng)系統(tǒng)和癌癥。迄今為止,已有1,200多名患者接受了hPSC產(chǎn)品,累計(jì)臨床給藥細(xì)胞數(shù)超過(guò)1011個(gè),到目前為止沒(méi)有發(fā)現(xiàn)普遍的安全問(wèn)題。
干細(xì)胞相關(guān)發(fā)現(xiàn)及意義
1998年人類胚胎干細(xì)胞(hESC)產(chǎn)生,能無(wú)限量生產(chǎn)非癌性人類細(xì)胞,可獲得多種具治療價(jià)值的細(xì)胞類型,為再生細(xì)胞療法發(fā)展奠基,有望改變慢性病治療。
2007年人類誘導(dǎo)性多能干細(xì)胞(hiPSC)產(chǎn)生,使體細(xì)胞可重新編程,能創(chuàng)建自體細(xì)胞系及HLA純合供體細(xì)胞系,有助于減少或消除移植個(gè)體免疫抑制需求,孤雌生殖和體細(xì)胞核移植是生成hPSC的替代方法,但受復(fù)雜技術(shù)及基因組印記問(wèn)題限制難用于臨床。
多能干細(xì)胞產(chǎn)品臨床轉(zhuǎn)化面臨的挑戰(zhàn)
技術(shù)層面:需數(shù)十年研究來(lái)掌握人體組織特性及分化為高純度功能性細(xì)胞、避免脫靶細(xì)胞的方法。 – 體內(nèi)安全性和有效性研究需開(kāi)發(fā)特定動(dòng)物模型用于人類異種移植長(zhǎng)期研究。
缺乏市售GMP級(jí)和無(wú)異種成分干細(xì)胞試劑,復(fù)雜制造程序適應(yīng)性受挑戰(zhàn),申辦方要做大量風(fēng)險(xiǎn)評(píng)估和原材料測(cè)試。
體內(nèi)CRO員工需費(fèi)力再培訓(xùn)以開(kāi)展相關(guān)長(zhǎng)期毒性等研究。
監(jiān)管層面:多年來(lái)hPSC產(chǎn)品開(kāi)發(fā)監(jiān)管指南未出臺(tái),且不同司法管轄區(qū)缺乏一致性,仍面臨挑戰(zhàn)。 ### 培養(yǎng)系統(tǒng)改進(jìn)情況 – 已引入如無(wú)飼養(yǎng)細(xì)胞培養(yǎng)系統(tǒng)、完全定義的無(wú)異種培養(yǎng)基等制造改進(jìn)措施。 – 2007年至2012年間,以色列、新加坡和英國(guó)在GMP條件下生成了hESC庫(kù),首次試驗(yàn)使用源自研究級(jí)hESC系的GMP主細(xì)胞庫(kù)(如WiCell的H1/WA01和H9/WA09系)。
目前各個(gè)國(guó)家/地區(qū)的多能干細(xì)胞臨床試驗(yàn)分布
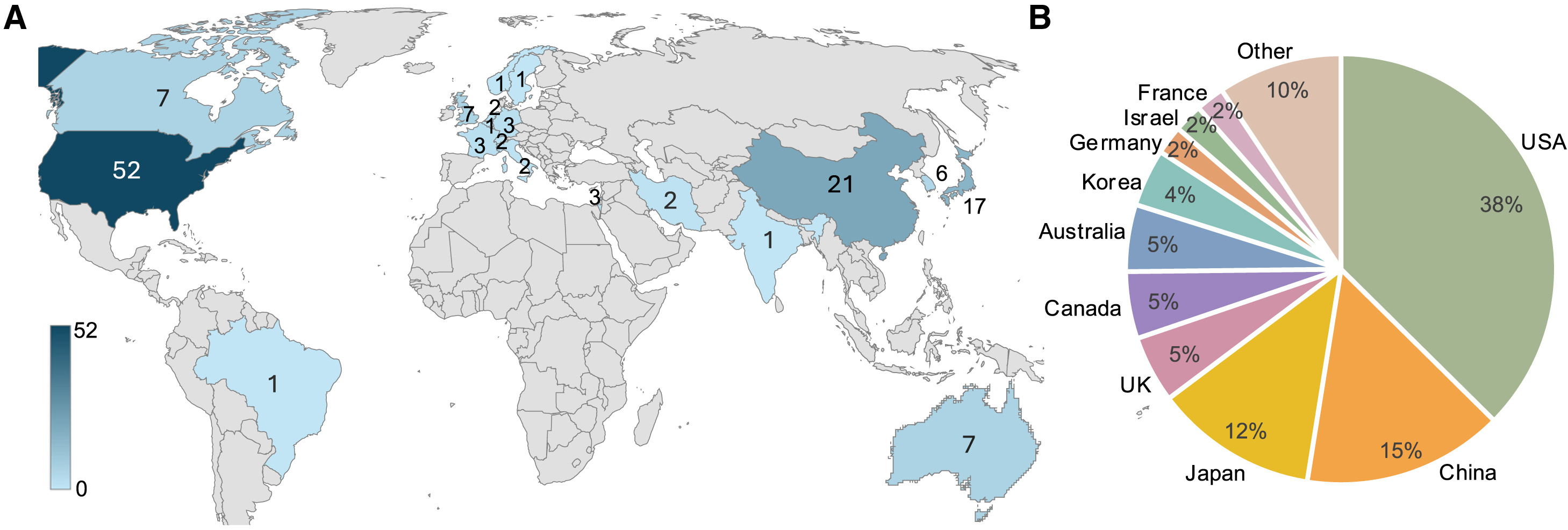
(A) 每個(gè)國(guó)家 hPSC 臨床試驗(yàn)數(shù)量概覽。數(shù)字表示參與試驗(yàn)的國(guó)家作為試驗(yàn)地點(diǎn),因此在不同國(guó)家有多個(gè)地點(diǎn)的試驗(yàn)將在地圖上被計(jì)算多次。在同一國(guó)家有多個(gè)地點(diǎn)的試驗(yàn)僅算作一次試驗(yàn)。圖表由Excel、Bing地圖制作。
(B) 餅圖顯示了每個(gè)國(guó)家/地區(qū)hPSC臨床試驗(yàn)地點(diǎn)的分布比例。
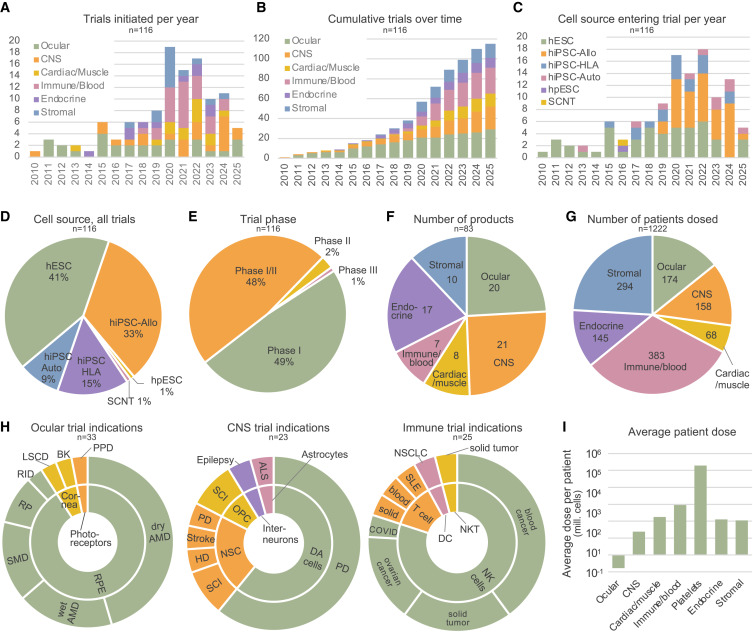
(A)自2010年以來(lái),每年啟動(dòng)的試驗(yàn)數(shù)量,按產(chǎn)品類型以顏色編碼。2025 年的數(shù)字是基于目前批準(zhǔn)的試驗(yàn)的不完整估計(jì)。
(B)2010年至2025年已啟動(dòng)的hPSC試驗(yàn)的累計(jì)數(shù)量,按產(chǎn)品類型用顏色編碼。
(C) 每年發(fā)起的試驗(yàn)數(shù)量,以顏色編碼表示所用的細(xì)胞來(lái)源。請(qǐng)注意,來(lái)自 HLA 單倍型 hiPSC(hiPSC-HLA)的產(chǎn)品并不總是與試驗(yàn)中的患者相匹配。
(D)餅圖顯示使用不同細(xì)胞來(lái)源的試驗(yàn)的比例。(E) 餅圖顯示不同臨床階段的試驗(yàn)比例。
(F)餅圖顯示獲批準(zhǔn)進(jìn)行臨床試驗(yàn)的不同產(chǎn)品類型的數(shù)量。
(G) 餅圖顯示服用每種產(chǎn)品類型的患者總數(shù)。
(H) 餅圖顯示針對(duì)眼部、中樞神經(jīng)系統(tǒng)和免疫產(chǎn)品試驗(yàn)的每個(gè)疾病適應(yīng)癥(外圓)所應(yīng)用的產(chǎn)品細(xì)胞類型(內(nèi)圓)。
(I)不同產(chǎn)品類型給每個(gè)患者注射的細(xì)胞平均劑量。
AMD,老年性黃斑變性;SMD,斯塔加特黃斑變性;RP,視網(wǎng)膜色素變性;RID,RPE受損疾病;LSCD,角膜緣干細(xì)胞缺乏癥;BK,大泡性角膜病變;PPD,原發(fā)性感光細(xì)胞疾病;DA,多巴胺;PD,帕金森病;SCI,脊髓損傷;HD,亨廷頓病;NSC,神經(jīng)干細(xì)胞;OPC,少突膠質(zhì)細(xì)胞祖細(xì)胞;ALS,肌萎縮側(cè)索硬化癥;SLE,系統(tǒng)性紅斑狼瘡;NSCLC,非小細(xì)胞肺癌。
1、多能干細(xì)胞治療黃斑變性及其他眼部疾病
多種黃斑變性疾病都是由RPE的功能障礙和缺失引起的,RPE是一層為上層感光細(xì)胞提供支持的單層細(xì)胞。RPE的缺失會(huì)導(dǎo)致感光細(xì)胞退化和視力喪失。探索性臨床研究通過(guò)從同一只眼睛的周邊視網(wǎng)膜自體移植健康RPE來(lái)替換受損的RPE,顯示出潛在的有益效果。多種黃斑變性疾病都是由RPE的功能障礙和缺失引起的,RPE是一層為上層感光細(xì)胞提供支持的單層細(xì)胞。RPE的缺失會(huì)導(dǎo)致感光細(xì)胞退化和視力喪失。探索性臨床研究通過(guò)從同一只眼睛的周邊視網(wǎng)膜自體移植健康RPE來(lái)替換受損的RPE,顯示出潛在的有益效果
為了讓患者更容易獲得此類治療,多個(gè)團(tuán)隊(duì)致力于開(kāi)發(fā)hPSC衍生的RPE產(chǎn)品,用于治療AMD、Stargardt型黃斑營(yíng)養(yǎng)不良 (SMD) 和其他變性疾病。隨后,用于眼部適應(yīng)癥的較新產(chǎn)品還包括感光細(xì)胞和角膜上皮和內(nèi)皮細(xì)胞。迄今為止,至少有21種針對(duì)眼部疾病的產(chǎn)品已經(jīng)進(jìn)入不同適應(yīng)癥的臨床試驗(yàn)(表1)。
干式AMD和SMD
基于hESC衍生細(xì)胞治療的相關(guān)試驗(yàn)情況
Advanced Cell Technology公司相關(guān)試驗(yàn):
- 2011年發(fā)起針對(duì)SMD(NCT01345006)或干性AMD(NCT01344993)患者的研究,通過(guò)玻璃體視網(wǎng)膜手術(shù)將hESC衍生的冷凍保存的RPE細(xì)胞懸浮液(MA09-hRPE)注入視網(wǎng)膜下腔,視力測(cè)量有略微改善,但晚期疾病患者視力測(cè)量結(jié)果可能不可靠。
- 2011年英國(guó)啟動(dòng)MA09-hRPE治療SMD的試驗(yàn)(NCT01469832),12個(gè)月時(shí)接受治療患者未顯著獲益,可能因患者處于疾病晚期。
- 2018年安斯泰來(lái)公司啟動(dòng)使用不同細(xì)胞系和產(chǎn)品配方(ASP7317-RPE,NCT03178149)的干性AMD I期試驗(yàn),結(jié)果未公布。
- 韓國(guó)CHABiotech對(duì)MA09-hRPE進(jìn)行試驗(yàn),SMD患者1年時(shí)視力有潛在改善,但解釋臨床改善需謹(jǐn)慎。
Lineage Cell Therapeutics子公司相關(guān)試驗(yàn): 2015年OpRegen產(chǎn)品(冷凍保存的hESC衍生RPE細(xì)胞懸浮液)進(jìn)入臨床試驗(yàn)(NCT02286089),視力低下患者病情進(jìn)展正常,視力障礙少的患者視力穩(wěn)定或改善,2023年啟動(dòng)該產(chǎn)品II期試驗(yàn)(NCT05626114)。
中國(guó)西南醫(yī)院相關(guān)試驗(yàn):2015年針對(duì)SMD的非冷凍保存RPE研究(NCT02749734),優(yōu)化細(xì)胞輸送,初期(1 – 4個(gè)月)視力穩(wěn)定或暫時(shí)增加,60個(gè)月時(shí)3名患者出現(xiàn)視力喪失情況。
圣保羅大學(xué)相關(guān)試驗(yàn):2015年發(fā)起比較AMD和SMD中單層RPE和細(xì)胞懸浮液移植的研究(NCT02903576),AMD相關(guān)比較結(jié)果未公布,報(bào)告稱移植的SMD患者視力無(wú)顯著增加。
Regenerative Patch Technologies相關(guān)試驗(yàn):2016年將hESC衍生的RPE作為非冷凍保存的細(xì)胞片放在合成膜上治療干性AMD(NCT02590692),4名16名植入患者在12個(gè)月時(shí)視力提高5個(gè)字母以上,2年尸檢隨訪顯示同種異體RPE細(xì)胞存活且無(wú)眼內(nèi)炎癥等問(wèn)題,中位3年隨訪植入眼睛更易提高視力,但患者數(shù)量不足未檢測(cè)到統(tǒng)計(jì)學(xué)顯著改善。
美國(guó)國(guó)立衛(wèi)生研究院相關(guān)試驗(yàn):2020年美國(guó)國(guó)立衛(wèi)生研究院國(guó)家眼科研究所的Kapil Bharti等人率先開(kāi)發(fā)自體hiPSC-RPE產(chǎn)品(使用PLGA支架)用于治療干性AMD(NCT04339764),已有2名患者接受給藥。
多能干細(xì)胞治療濕性黃斑變性
抗VEGF治療局限性:使用抗血管內(nèi)皮生長(zhǎng)因子(anti – VEGF)抗體治療濕性AMD非常有效,但無(wú)法解決晚期病例中的視網(wǎng)膜色素上皮(RPE)變性。
日本在這方面的試驗(yàn):
由Masayo Takahashi和日本理化學(xué)研究所于2013年發(fā)起(UMIN000011929),是首個(gè)針對(duì)濕性AMD的RPE治療及首個(gè)測(cè)試人誘導(dǎo)多能干細(xì)胞(hiPSC)衍生產(chǎn)品的試驗(yàn)。 將非冷凍保存的自體hiPSC衍生RPE細(xì)胞片(1.3×3毫米)分離自膠原基質(zhì),輸送到濕性AMD患者的一只眼睛中,無(wú)免疫抑制。 接受治療的眼睛在4年后仍保持移植物存活,1年和4年后視力保持穩(wěn)定,無(wú)需額外的抗VEGF治療。
2021年,Masayo Takahashi在日本神戶市立眼科醫(yī)院發(fā)起(UMIN000026003)。 – 在沒(méi)有免疫抑制的情況下向患者提供冷凍保存的HLA單倍型同種異體iPSC衍生細(xì)胞懸浮液。 – 5名患者視力穩(wěn)定或改善(2名患者視力增加>10個(gè)字母,3名患者視力穩(wěn)定),1年隨訪確認(rèn)移植物保留。
英國(guó)在這方面的研究 :2015年由Moorfields眼科醫(yī)院的Pete Coffey及其同事發(fā)起(NCT01691261)。
2名患者被植入聚酯膜上的RPE單層。12個(gè)月時(shí)視力明顯改善,兩名患者的視力均增加了20個(gè)字母以上。患者1的視力改善在5年后下降到低于基線2個(gè)字母,患者2的視力改善有所降低,但5年后仍比基線高出9個(gè)字母,移植物可持續(xù)長(zhǎng)達(dá)5年。因患者患濕性AMD的特殊亞型RPE撕裂,該研究難以與其他濕性AMD研究比較。
中國(guó)西南醫(yī)院研究:用于干性年齡相關(guān)性黃斑變性(SMD)患者的非冷凍保存RPE懸浮液產(chǎn)品和輸送技術(shù)也用于治療濕性AMD(NCT02749734),輸送細(xì)胞數(shù)量增加10倍(每只眼睛100萬(wàn)個(gè)細(xì)胞)。 3名患者的視力均有改善,提高了11 – 26個(gè)字母。
其他眼部適應(yīng)癥
法國(guó)、日本和中國(guó)已開(kāi)展三項(xiàng)針對(duì)視網(wǎng)膜色素變性的研究(NCT03963154、jRCTa050200027 和 NCT03944239)。法國(guó) iSTEM 的 Christelle Monville及其同事開(kāi)發(fā)的明膠 hESC-RPE 細(xì)胞片移植的初步結(jié)果表明,眼球震顫和注視可能穩(wěn)定(NCT03963154)。
神戶市立眼科醫(yī)院的 Masayo Takahashi 及其同事領(lǐng)導(dǎo)的另一項(xiàng)研究使用同種異體iPSC衍生的視網(wǎng)膜類器官片(jRCTa050200027),結(jié)果表明細(xì)胞存活2年,但與對(duì)側(cè)眼相比,視力沒(méi)有改善或惡化。
大阪大學(xué)的 Kohji Nishida 及其同事于2019年發(fā)起了一項(xiàng)日本研究 (UMIN000036539),研究了移植 hiPSC 衍生的角膜上皮細(xì)胞片治療角膜緣干細(xì)胞缺乏癥,結(jié)果顯示4名患者中有3名在2年的隨訪中沒(méi)有出現(xiàn)嚴(yán)重不良事件 (SAE),且疾病癥狀有所改善。64所有患者均為 HLA 不匹配,但只有兩名患者使用了全身免疫抑制治療。64一項(xiàng)針對(duì)大泡
性角膜病變的單獨(dú)研究也已啟動(dòng),該研究提供了角膜內(nèi)皮細(xì)胞 (CLS001)。此外,BlueRock Therapeutics 宣布即將進(jìn)行一項(xiàng)臨床試驗(yàn)的IND批準(zhǔn),該試驗(yàn)使用感光細(xì)胞 (OpCT-001) 治療原發(fā)性感光疾病 (表1)?。
多能干細(xì)胞治療眼科疾病的總結(jié)
臨床研究特點(diǎn)及安全性情況
- 特點(diǎn):針對(duì)眼部疾病的hPSC衍生產(chǎn)品臨床研究涉及多種適應(yīng)癥、疾病嚴(yán)重程度和給藥方法,難以總結(jié)出普適性知識(shí)。
- 安全性:眼部hPSC產(chǎn)品安全性總體可行,未出現(xiàn)因輸送細(xì)胞導(dǎo)致的嚴(yán)重不良事件,即便在同種異體環(huán)境下也基本無(wú)移植排斥跡象。
- 劑量、移植物存活率及功能驗(yàn)證相關(guān)情況
- 劑量與移植物存活率:劑量隨時(shí)間有所增加,且通常會(huì)對(duì)移植物存活率進(jìn)行報(bào)告。
- 移植物功能驗(yàn)證:在無(wú)活檢情況下證明RPE產(chǎn)品具有移植物功能頗具挑戰(zhàn),僅報(bào)道有一位患者活檢顯示2年后移植物有功能,僅憑移植區(qū)域色素情況難以確認(rèn)存在活的色素細(xì)胞,需活檢來(lái)確認(rèn)是否為碎片。
產(chǎn)品保存及交付狀態(tài)相關(guān)情況
- 所有細(xì)胞片產(chǎn)品制造后都未經(jīng)冷凍保存,而細(xì)胞懸浮液產(chǎn)品有非冷凍保存和冷凍保存兩種交付狀態(tài)。
- RPE細(xì)胞的分化狀態(tài)對(duì)懸浮液和細(xì)胞片中的冷凍保存存活十分關(guān)鍵,優(yōu)化產(chǎn)品制造以利用好冷凍保存、確保細(xì)胞最佳恢復(fù)和功能,或許是產(chǎn)品最終推向市場(chǎng)的必要條件。
未來(lái)展望
- 后續(xù)出現(xiàn)的臨床數(shù)據(jù)會(huì)更清晰地呈現(xiàn)RPE片、細(xì)胞懸浮液、自體和同種異體產(chǎn)品的臨床療效。
- 越來(lái)越多試驗(yàn)納入病情較輕患者,有望使移植組織產(chǎn)生更強(qiáng)的臨床反應(yīng)。
2、多能干細(xì)胞在治療中樞神經(jīng)系統(tǒng)適應(yīng)癥的研究
多能干細(xì)胞治療帕金森病
帕金森病及傳統(tǒng)治療局限性
疾病情況及傳統(tǒng)替代療法:帕金森病是因大腦基底神經(jīng)節(jié)深處多巴胺(DA)神經(jīng)元丟失導(dǎo)致的衰弱性運(yùn)動(dòng)疾病,自20世紀(jì)80年代末開(kāi)始用捐贈(zèng)的人類胎兒組織通過(guò)腦內(nèi)移植臨床替代DA神經(jīng)元,但該方法存在高度可變性、組織可用性不足、缺乏標(biāo)準(zhǔn)化質(zhì)量控制和倫理問(wèn)題,所以PD被視作干細(xì)胞替代療法的主要目標(biāo)。
早期相關(guān)試驗(yàn)情況
中國(guó)2015年試驗(yàn):第一項(xiàng)針對(duì)PD的人胚胎干細(xì)胞(hESC)試驗(yàn)于2015年在中國(guó)啟動(dòng)(NCT03119636),已為24名患者注射了DA祖細(xì)胞,臨床數(shù)據(jù)尚未公布(表2)。
澳大利亞2016年試驗(yàn):2016年國(guó)際干細(xì)胞公司(ISCO)在澳大利亞發(fā)起使用孤雌生殖干細(xì)胞(hpESC)的試驗(yàn),2021年達(dá)到主要安全終點(diǎn),但后續(xù)試驗(yàn)計(jì)劃暫未宣布,該試驗(yàn)引發(fā)對(duì)其通用神經(jīng)干細(xì)胞(NSC)產(chǎn)品能否取代多巴胺能功能的擔(dān)憂,因其主要是通過(guò)營(yíng)養(yǎng)支持抑制內(nèi)源性DA神經(jīng)元細(xì)胞死亡。
后續(xù)轉(zhuǎn)向更明確產(chǎn)品的試驗(yàn)情況:
日本CiRA相關(guān)試驗(yàn):首個(gè)進(jìn)入PD臨床試驗(yàn)的人誘導(dǎo)多能干細(xì)胞(hiPSC)產(chǎn)品由日本iPS細(xì)胞研究與應(yīng)用中心(CiRA)的Jun Takahashi開(kāi)發(fā),使用針對(duì)特定標(biāo)志物純化的同種異體HLA單倍型hiPSC系,2018年啟動(dòng)試驗(yàn),納入7名患者,完成后顯示良好安全性,部分患者有中度改善,目前住友制藥公司正在美國(guó)對(duì)該產(chǎn)品進(jìn)一步開(kāi)展臨床試驗(yàn)。
BlueRock Therapeutics相關(guān)試驗(yàn):2021年啟動(dòng)基于hESC的試驗(yàn)(NCT04802733),在美國(guó)和加拿大對(duì)12名患者使用H9衍生的Bemdaneprocel產(chǎn)品,報(bào)告顯示高劑量組在18和24個(gè)月時(shí)PD癥狀比基線減少約50%,促使其預(yù)計(jì)很快啟動(dòng)II期研究。
韓國(guó)S.Biomedics相關(guān)試驗(yàn):2023年啟動(dòng)基于hESC的試驗(yàn)(NCT05887466),報(bào)告稱12個(gè)月時(shí)前3名高劑量患者的PD癥狀減少了25% – 44%。
瑞典相關(guān)試驗(yàn):2022年瑞典斯科訥大學(xué)醫(yī)院?jiǎn)?dòng)DA細(xì)胞替代(STEM – PD)hESC試驗(yàn)(NCT05635409),由相關(guān)人員領(lǐng)導(dǎo)。
中國(guó)iRegene Therapeutics相關(guān)試驗(yàn):一家中國(guó)公司iRegene Therapeutics開(kāi)發(fā)的同種異體“化學(xué)誘導(dǎo)”hiPSC產(chǎn)品(NouvNeu001),2024年1月在中國(guó)進(jìn)入臨床試驗(yàn),2024年6月獲FDA批準(zhǔn)在美國(guó)進(jìn)行試驗(yàn)。
總體來(lái)看,美國(guó)、日本、瑞典和韓國(guó)這些臨床試驗(yàn)都采用了相對(duì)較短的16 – 28天的分化方案。
針對(duì)帕金森病的試驗(yàn)為自體細(xì)胞療法鋪平了道路。
早期自體hiPSC衍生移植情況
- 2017年,波士頓麥克萊恩醫(yī)院的一名帕金森病患者作為有史以來(lái)第二位接受自體人誘導(dǎo)多能干細(xì)胞(hiPSC)衍生移植的患者,依據(jù) “單個(gè)患者擴(kuò)大使用” 方案,在Kwang-Soo Kim及其同事領(lǐng)導(dǎo)下進(jìn)行了治療。
- 移植后12個(gè)月評(píng)估時(shí),通過(guò)正電子發(fā)射斷層掃描(PET)成像顯示該移植患者有適度的移植物存活跡象。
后續(xù)獲批試驗(yàn)情況
- 2023年,同一團(tuán)隊(duì)獲FDA批準(zhǔn),將自體多巴胺(DA)細(xì)胞移植擴(kuò)大到8名患者(NCT06687837)。
- 同樣在2023年,F(xiàn)DA還批準(zhǔn)了另外兩項(xiàng)使用自體hiPSC治療PD的試驗(yàn),分別是Aspen Neuroscience的ANPD001試驗(yàn)(第一位患者于2024年春季接受給藥),以及由波士頓麥克萊恩醫(yī)院的Penelope Hallett及其同事領(lǐng)導(dǎo)的試驗(yàn)(NCT06422208),至今已為兩名患者注射了自體細(xì)胞。
整體獲批試驗(yàn)數(shù)量及未來(lái)展望
- 目前總共有13項(xiàng)獲批的針對(duì)帕金森病的試驗(yàn)。
- 在未來(lái)幾年,評(píng)估移植后2-3年完全成熟的移植物患者的療效數(shù)據(jù),將會(huì)很有幫助。
多能干細(xì)胞治療脊髓損傷
少突膠質(zhì)細(xì)胞負(fù)責(zé)髓鞘化軸突并提供營(yíng)養(yǎng)支持,但在脊髓損傷后會(huì)丟失。因此,更換少突膠質(zhì)細(xì)胞可能在損傷后為受損的軸突提供支持。
Geron公司產(chǎn)品情況
產(chǎn)品及臨床前研究:Geron公司開(kāi)發(fā)了針對(duì)SCI的hESC衍生少突膠質(zhì)細(xì)胞祖細(xì)胞產(chǎn)品GRN-OPC1,動(dòng)物模型臨床前研究顯示其能產(chǎn)生神經(jīng)營(yíng)養(yǎng)因子、遷移至脊髓實(shí)質(zhì)、刺激血管形成并誘導(dǎo)損傷部位軸突髓鞘再生,支持后續(xù)臨床開(kāi)發(fā)。
首次人體試驗(yàn)情況:2010年GRN-OPC1獲FDA批準(zhǔn)進(jìn)入臨床試驗(yàn),成為全球首個(gè)進(jìn)入患者的hPSC產(chǎn)品。首次人體試驗(yàn)(NCT01217008)在5名亞急性胸部損傷患者中測(cè)試其輸送情況,10年安全性數(shù)據(jù)表明患者耐受性良好,無(wú)手術(shù)、細(xì)胞植入或免疫抑制相關(guān)的嚴(yán)重不良事件(SAE),也未發(fā)現(xiàn)異位組織或畸胎瘤,但患者未表現(xiàn)出明顯臨床改善,原因歸結(jié)為細(xì)胞劑量相對(duì)較低,2011年11月Geron公司停止該試驗(yàn)。
后續(xù)試驗(yàn)及產(chǎn)品更名情況:技術(shù)被Asterias Biotherapeutics收購(gòu)后,2015年以AST-OPC1形式在針對(duì)頸椎SCI患者的I/II期劑量遞增試驗(yàn)(NCT02302157)中推出,患者受傷后21 – 42天接受不同劑量細(xì)胞,多數(shù)患者(96%)至少在身體一側(cè)恢復(fù)一個(gè)或多個(gè)神經(jīng)功能水平,32%患者在移植后1年至少在身體一側(cè)恢復(fù)2個(gè)或更多神經(jīng)功能水平,支持產(chǎn)品安全性,但因試驗(yàn)規(guī)模有限,難以確定恢復(fù)是產(chǎn)品作用還是自然恢復(fù)。后因公司被收購(gòu)更名,產(chǎn)品更名為L(zhǎng)CTOPC1。
其他研究小組情況
S.Biomedics小組:正在測(cè)試hESC衍生的神經(jīng)前體細(xì)胞(PSA-NCAM+),可鞘內(nèi)注射給亞急性頸椎SCI患者,不過(guò)安全性和有效性數(shù)據(jù)尚未公布。
慶應(yīng)義塾大學(xué)小組:由Hideyuki Okano及其同事領(lǐng)導(dǎo),測(cè)試hiPSC衍生的神經(jīng)干細(xì)胞(NSC)在完全性頸椎/胸部亞急性SCI中的作用,目前4名患者受傷后2-4周接受了200萬(wàn)hiPSC-NSC注射,雖暫無(wú)療效數(shù)據(jù),但未觀察到SAE。
多能干細(xì)胞治療癲癇
疾病背景及相關(guān)研究
基礎(chǔ)疾病情況:藥物抵抗性局灶性癲癇是中樞神經(jīng)系統(tǒng)疾病,由大腦孤立亞區(qū)興奮性神經(jīng)元不受控制地過(guò)度活躍引發(fā),導(dǎo)致神經(jīng)元放電,表現(xiàn)為運(yùn)動(dòng)性癲癇和痙攣。
研究基礎(chǔ):加州大學(xué)舊金山分校的Arturo Alvarez-Buyulla及其同事率先開(kāi)展研究,發(fā)現(xiàn)將hESC衍生的抑制性GABAergic中間神經(jīng)元移植到大腦癲癇灶中,能抑制神經(jīng)元過(guò)度活躍,減少遺傳性或間皮性顳葉癲癇(MTLE)小鼠模型中的癲癇發(fā)作。該團(tuán)隊(duì)采用特定的中間神經(jīng)元分化方案,并于2009年成立了Neurona Therapeutics公司。
Neurona Therapeutics公司相關(guān)試驗(yàn)情況:
首次試驗(yàn):2022年在耐藥性MTLE(NCT05135091)試驗(yàn)中為第一位患者移植了中間神經(jīng)元產(chǎn)品NRTX-1001。初步療效數(shù)據(jù)顯示,在最初用較低劑量NRTX-1001治療的5名患者中,4名癲癇發(fā)作減少50%以上,3名擺脫最嚴(yán)重的局灶性癲癇發(fā)作類型,隨訪時(shí)間最長(zhǎng)的2名患者(16個(gè)月和21個(gè)月)癲癇發(fā)作減少95%以上,其中一名患者8個(gè)月內(nèi)無(wú)癲癇發(fā)作。
后續(xù)進(jìn)展:Neurona Therapeutics已將試驗(yàn)范圍擴(kuò)大到美國(guó)21個(gè)活躍臨床站點(diǎn),并啟動(dòng)第二項(xiàng)雙側(cè)移植試驗(yàn)(NCT06422923)。重要意義 – Neurona Therapeutics的研究結(jié)果令人鼓舞,一方面證實(shí)移植的人類神經(jīng)元能在人腦中長(zhǎng)期存活并發(fā)揮作用,另一方面也證實(shí)大腦在無(wú)免疫抑制情況下可長(zhǎng)期耐受同種異體移植物,在此次試驗(yàn)中患者移植12個(gè)月后停止使用免疫抑制藥物。
其他中樞神經(jīng)系統(tǒng)適應(yīng)癥
以色列KadimaStem公司針對(duì)ALS的試驗(yàn)
- 試驗(yàn)情況:2018年發(fā)起將hESC衍生的星形膠質(zhì)細(xì)胞(AstroRx)鞘內(nèi)注射到肌萎縮側(cè)索硬化癥(ALS)患者脊髓中的研究,納入接受兩種不同劑量治療的10名患者。
- 試驗(yàn)結(jié)果:患者在移植后的前3個(gè)月內(nèi)病情進(jìn)展速度有所下降,但兩個(gè)給藥組在12個(gè)月的隨訪中均未出現(xiàn)高于基線的顯著改善。
斯坦福大學(xué)針對(duì)缺血性皮質(zhì)下中風(fēng)的試驗(yàn)
- 試驗(yàn)情況:2021年發(fā)起使用H9 hESC衍生的神經(jīng)干細(xì)胞(NSC)產(chǎn)品治療缺血性皮質(zhì)下中風(fēng)的試驗(yàn)。
- 試驗(yàn)結(jié)果:2023年初發(fā)布中期數(shù)據(jù),報(bào)告稱前6名移植患者在6個(gè)月時(shí)對(duì)該治療的耐受性良好。
加州大學(xué)歐文分校針對(duì)亨廷頓氏病的相關(guān)情況
- 產(chǎn)品及獲批情況:Leslie Thompson及其同事開(kāi)發(fā)了用于治療亨廷頓氏病的NSC產(chǎn)品,于2024年獲得FDA批準(zhǔn)(雖尚未開(kāi)始臨床試驗(yàn))。
- 臨床前研究效果:移植的NSC可以減少內(nèi)源性突變亨廷頓蛋白的積累,并增強(qiáng)神經(jīng)營(yíng)養(yǎng)因子的產(chǎn)生以支持內(nèi)源性神經(jīng)元。
3、多能干細(xì)胞治療心臟衰竭
目前正在對(duì)心肌梗塞 (MI) 和慢性心力衰竭 (CHF) 患者進(jìn)行使用各種細(xì)胞類型的細(xì)胞替代療法測(cè)試。
疾病背景及細(xì)胞替代療法概況
疾病引發(fā)情況:心肌梗塞(MI)后,大量心肌細(xì)胞丟失并被無(wú)收縮性疤痕組織取代,可能繼發(fā)性發(fā)展為慢性心力衰竭(CHF),因此有實(shí)驗(yàn)室開(kāi)發(fā)hPSC衍生的心肌細(xì)胞來(lái)改善心臟收縮功能,其產(chǎn)品劑量范圍為5至8億個(gè)細(xì)胞,且有多種提供形式。
Philippe Menasche團(tuán)隊(duì)相關(guān)試驗(yàn)
試驗(yàn)情況:2013年,Philippe Menasche及其同事進(jìn)行臨床試驗(yàn),測(cè)試心外膜遞送嵌入纖維蛋白支架并手術(shù)遞送到梗塞區(qū)域的心肌細(xì)胞祖細(xì)胞(NCT02057900),6名患者接受治療,僅接受短暫免疫抑制治療。
試驗(yàn)結(jié)果:治療一年后,無(wú)產(chǎn)品相關(guān)不良事件報(bào)告,心臟功能略有改善,但因患者數(shù)量少難以得出明確結(jié)論,后續(xù)團(tuán)隊(duì)停止心肌細(xì)胞移植,轉(zhuǎn)去進(jìn)行hPSC衍生的細(xì)胞外囊泡試驗(yàn)(NCT0577450),可能是因缺乏明顯細(xì)胞植入跡象。
2019-2023年間其他國(guó)家相關(guān)試驗(yàn)
日本大阪大學(xué)研究小組:由Yoshiki Sawa等人領(lǐng)導(dǎo)的試驗(yàn)(jRCT2053190081),第一位患者在心外膜移植3個(gè)心肌細(xì)胞貼片并短暫免疫抑制后,移植一年無(wú)不良事件且心臟功能改善(表3)。
德國(guó)哥廷根大學(xué)醫(yī)學(xué)中心與Repairon合作研究:使用在I型膠原水凝膠中設(shè)計(jì)的成纖維細(xì)胞和心肌細(xì)胞貼片(NCT04396899),新聞稿報(bào)告有心壁持續(xù)增厚和心臟射血分?jǐn)?shù)提高的證據(jù)。
總體情況:這些研究呈現(xiàn)出早期癥狀改善、無(wú)室性心律失常、腫瘤形成和免疫抑制相關(guān)不良事件的跡象,但試驗(yàn)效力不足以得出確切結(jié)果,且臨床前研究表明心肌細(xì)胞懸浮液注射在某些情況會(huì)致心律失常,不過(guò)涉及心肌細(xì)胞片的臨床研究至今未報(bào)告移植患者出現(xiàn)心律失常。
中國(guó)相關(guān)試驗(yàn)情況
Help Therapeutics:進(jìn)行將心肌細(xì)胞懸浮液注射到受損組織多個(gè)位置并輔以全身抗心律失常治療的臨床試驗(yàn)(NCT03763136)。
HeartSeed:2022年啟動(dòng)心肌遞送心臟球體的試驗(yàn)(NCT04945018),前兩名患者初步結(jié)果顯示移植后26周左心室射血分?jǐn)?shù)(LVEF)分別提高2個(gè)百分點(diǎn)和11個(gè)百分點(diǎn)。 影響因素及未來(lái)關(guān)鍵
影響因素:hPSC衍生心肌細(xì)胞的植入和功能受多種因素影響,包括成熟度、純度、產(chǎn)品類型、冷凍保存狀態(tài)和遞送方式等。
未來(lái)關(guān)鍵:實(shí)現(xiàn)移植細(xì)胞的功能整合同時(shí)避免心律失常,是未來(lái)心肌細(xì)胞產(chǎn)品成功的基礎(chǔ)。
4、多能干細(xì)胞治療糖尿病
1型糖尿病及尸體胰島移植情況
疾病成因及傳統(tǒng)治療探索:1型糖尿病(T1DM)由自身免疫介導(dǎo)的胰腺內(nèi)分泌胰島中產(chǎn)生胰島素的β細(xì)胞損失引起,早在20世紀(jì)70年代就開(kāi)始探索尸體胰島移植作為治療選擇,經(jīng)改進(jìn)臨床胰島移植方案后,超50%接受者能在移植后至少1年內(nèi)實(shí)現(xiàn)胰島素獨(dú)立性,2023年美國(guó)FDA正式批準(zhǔn)尸體胰島移植(Lantidra)用于治療反復(fù)發(fā)作嚴(yán)重低血糖的T1DM患者。
Viacyte公司相關(guān)試驗(yàn)情況
早期試驗(yàn)及裝置設(shè)計(jì):Viacyte公司于2014年啟動(dòng)首次臨床試驗(yàn),其技術(shù)涉及從人胚胎干細(xì)胞(hESC)到胰腺內(nèi)胚層祖細(xì)胞(PEC-01)的分化方案,將PEC-01細(xì)胞裝入Encaptra大膠囊裝置(VC-01產(chǎn)品)用于皮下植入,該裝置旨在隔離免疫細(xì)胞以避免免疫抑制治療,但因裝置核心缺氧致患者移植物存活率低。
后續(xù)試驗(yàn)及改進(jìn)情況:2017年啟動(dòng)兩項(xiàng)后續(xù)試驗(yàn),使用改進(jìn)后的裝置(允許血管長(zhǎng)入,VC-02產(chǎn)品)并配合PEC-01細(xì)胞植入,患者接受免疫抑制治療,不過(guò)裝置內(nèi)出現(xiàn)廣泛宿主源性纖維化,移植細(xì)胞占比低,僅35%患者有刺激C肽釋放的適度增加。2019年又試驗(yàn)裝置第三版(由膨體聚四氟乙烯制成,有免疫隔離和促血管生成特性,無(wú)需免疫抑制劑),相關(guān)試驗(yàn)數(shù)據(jù)待定。
其他相關(guān)公司情況
Viacyte與BetaLogics合并:2016年,Viacyte與強(qiáng)生公司的BetaLogics合并,后者有替代性β細(xì)胞分化方案。
Semma Therapeutics及Vertex相關(guān)情況:Semma Therapeutics于2014年創(chuàng)立,2019年被Vertex Pharmaceuticals收購(gòu),推動(dòng)其hESC衍生成熟胰島產(chǎn)品臨床開(kāi)發(fā),Vertex于2021年啟動(dòng)首次人體試驗(yàn),使用非封裝細(xì)胞VX-880經(jīng)門靜脈輸送給接受慢性免疫抑制方案的患者(NCT04786262),2024年試驗(yàn)取得較好結(jié)果,12名接受目標(biāo)劑量VX-880單次輸注患者有胰島細(xì)胞植入證據(jù),11名減少或無(wú)需外源性胰島素,3名隨訪超1年患者實(shí)現(xiàn)胰島素獨(dú)立性和良好血糖控制,期間雖因兩名患者死亡暫停數(shù)月(事件與VX-880無(wú)關(guān)),但2024年11月Vertex宣布將初始I/II期試驗(yàn)轉(zhuǎn)變?yōu)殛P(guān)鍵的I/II/III期試驗(yàn),推動(dòng)產(chǎn)品接近市場(chǎng)發(fā)布。
2023年Vertex又啟動(dòng)第二項(xiàng)試驗(yàn)(NCT05791201),使用封裝在“通道陣列裝置”中的VX-880細(xì)胞產(chǎn)品以避免免疫抑制。
中國(guó)天津市第一中心醫(yī)院相關(guān)情況
鄧洪奎、沈忠陽(yáng)及其同事于2023年在3名患者初始隊(duì)列中啟動(dòng)自體胰島樣細(xì)胞臨床試驗(yàn)(ChiCTR23000722009),發(fā)表第一位患者12個(gè)月隨訪數(shù)據(jù),報(bào)告稱從移植后第75天起持續(xù)不再依賴胰島素。
5、多能干細(xì)胞治療肝臟疾病
用于治療急性肝衰竭的PSC衍生肝細(xì)胞一直是開(kāi)發(fā)難度最大的產(chǎn)品之一。對(duì)于急性肝衰竭患者,在肝臟再生或有器官可供移植之前,使用PSC衍生肝細(xì)胞作為過(guò)渡療法可以挽救生命。然而,由于維持肝細(xì)胞增殖和功能的培養(yǎng)條件尚不完善,因此從hPSC有效生成成熟肝細(xì)胞仍然很困難。
此外,據(jù)估計(jì),有效治療需要10億到100億個(gè)肝細(xì)胞。盡管如此,我們還是取得了進(jìn)展,目前正在進(jìn)行2項(xiàng)臨床試驗(yàn),測(cè)試PSC衍生肝細(xì)胞在肝病中的作用(表4)。
中南大學(xué)湘雅醫(yī)院正在肝衰竭患者中測(cè)試hESC衍生肝細(xì)胞,目標(biāo)招募10名患者(ChiCTR2100052988)。日本國(guó)家兒童保健與發(fā)展中心已在2名患有尿素循環(huán)障礙的新生兒身上測(cè)試了hESC-肝細(xì)胞(JMA-IIA00412)。
這些產(chǎn)品的具體細(xì)節(jié)尚未披露,包括劑量和免疫抑制要求,目前兩組均未報(bào)告安全性或有效性數(shù)據(jù)。
6、免疫和血液制品
自體嵌合抗原受體T細(xì)胞 (CAR-T) 療法的開(kāi)發(fā)為患有難治性血液系統(tǒng)惡性腫瘤的患者帶來(lái)了變革。然而,這些自體療法價(jià)格昂貴,且患者來(lái)源細(xì)胞的質(zhì)量往往參差不齊,使得CAR-T細(xì)胞產(chǎn)品的制造具有挑戰(zhàn)性。
為了讓這些救命療法更容易為患者所用,幾個(gè)團(tuán)隊(duì)正在開(kāi)發(fā)同種異體現(xiàn)成的 hPSC 來(lái)源的自然殺傷 (NK) 和T細(xì)胞產(chǎn)品。目前,13種不同的PSC來(lái)源的NK或T細(xì)胞產(chǎn)品已在臨床試驗(yàn)中或正在接受測(cè)試(表5)。與自體免疫療法一樣,患者在施用細(xì)胞產(chǎn)品之前會(huì)進(jìn)行淋巴細(xì)胞清除。
7、NK細(xì)胞
Fate Therapeutics公司產(chǎn)品及試驗(yàn)情況
初始產(chǎn)品及改進(jìn)情況:其初始產(chǎn)品FT500由未經(jīng)工程化的人誘導(dǎo)多能干細(xì)胞(hiPSC)衍生的NK細(xì)胞組成,用于37名晚期實(shí)體瘤患者(NCT03841110),后被改進(jìn)的NK產(chǎn)品取代,改進(jìn)涉及基因編輯,如表達(dá)hnCD16增強(qiáng)抗體依賴性細(xì)胞毒性、白細(xì)胞介素(IL)-15RF使NK細(xì)胞持久存在無(wú)需外源性細(xì)胞因子支持,還推出針對(duì)疾病特異性的嵌合抗原受體(CAR),如用于多發(fā)性骨髓瘤的B細(xì)胞成熟抗原、用于彌漫性大B細(xì)胞淋巴瘤的CD19,借此構(gòu)建產(chǎn)品線安全數(shù)據(jù),利用hPSC生產(chǎn)含多基因編輯的克隆免疫細(xì)胞產(chǎn)品。
改進(jìn)型產(chǎn)品試驗(yàn)情況:幾種改進(jìn)型iNK細(xì)胞產(chǎn)品(FT516、FT522、FT538、FT576和FT596)在血癌(如急性髓細(xì)胞白血病、多發(fā)性骨髓瘤、慢性淋巴細(xì)胞白血病、B細(xì)胞淋巴瘤)患者中測(cè)試,雖臨床數(shù)據(jù)未公布,但據(jù)新聞稿和摘要可知,試驗(yàn)證明患者劑量在3000萬(wàn)到10億個(gè)細(xì)胞時(shí)的安全性和耐受性,無(wú)劑量限制性毒性、免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性綜合征或移植物抗宿主病(GvHD),僅偶爾出現(xiàn)細(xì)胞因子釋放綜合征,療效衡量標(biāo)準(zhǔn)為達(dá)到客觀緩解(腫瘤負(fù)荷或癌癥減少30%以上)和完全緩解(所有癌癥跡象消失)情況,部分試驗(yàn)仍在進(jìn)行中,新聞稿中期數(shù)據(jù)顯示30% – 50%的患者在30天后達(dá)到完全緩解。
Century Therapeutics公司相關(guān)試驗(yàn)情況
試驗(yàn)情況:發(fā)起測(cè)試hPSC衍生的CAR19-iNK細(xì)胞在復(fù)發(fā)或難治性CD19陽(yáng)性B細(xì)胞惡性腫瘤患者中的作用試驗(yàn)(NCT05336409),該產(chǎn)品含多項(xiàng)編輯促進(jìn)免疫逃避,如敲除主要組織相容性復(fù)合體(MHC)I類和II類、過(guò)度表達(dá)HLA -E以及設(shè)置安全開(kāi)關(guān)。
試驗(yàn)結(jié)果:2024年6月新聞稿披露,12名患者在劑量遞增試驗(yàn)中接受治療,7名接受低劑量治療的患者顯示良好安全性且有2次完全緩解,高劑量水平顯示良好安全性及30%-60%的完全緩解,此次試驗(yàn)結(jié)果有助于了解低免疫基因編輯對(duì)同種異體細(xì)胞產(chǎn)品耐久性的影響。
實(shí)體瘤相關(guān)試驗(yàn)情況
開(kāi)發(fā)用于治療實(shí)體瘤的hiPSC-CAR療法更具挑戰(zhàn)性,F(xiàn)T500、FT516、FT538已在實(shí)體瘤中測(cè)試,但相關(guān)試驗(yàn)結(jié)果數(shù)據(jù)少。此外,還有日本為實(shí)體瘤開(kāi)發(fā)的抗GPC3NK細(xì)胞產(chǎn)品(jRCT2033200431)和中國(guó)為血癌開(kāi)發(fā)的抗CD33 NK細(xì)胞產(chǎn)品(QN – 023a)在進(jìn)行相關(guān)試驗(yàn)。
展望未來(lái)——如何避免免疫排斥
免疫抑制規(guī)避策略及現(xiàn)狀
主要策略概述:隨著改良的人多能干細(xì)胞(hPSC)產(chǎn)品出現(xiàn),規(guī)避患者免疫抑制愈發(fā)重要,主要有四種策略,分別是患者自身細(xì)胞的自體移植、使用HLA單倍型hiPSC庫(kù)進(jìn)行HLA匹配、對(duì)低免疫細(xì)胞系進(jìn)行基因編輯以逃避宿主免疫識(shí)別、對(duì)移植細(xì)胞進(jìn)行免疫保護(hù)性封裝來(lái)物理保護(hù)移植物免受宿主免疫細(xì)胞侵害。
自體移植情況:已啟動(dòng)9項(xiàng)自體hiPSC試驗(yàn),但至今只有11名患者接受了自體細(xì)胞治療,將該技術(shù)以合理成本擴(kuò)展到更多患者的潛力有待證明。
HLA匹配情況:日本的CiRA致力于建立含27個(gè)來(lái)自HLA純合供體的hiPSC系的GMP級(jí)單倍體庫(kù),可滿足40%日本人口匹配要求,已在日本12項(xiàng)臨床試驗(yàn)中使用,但僅部分情況能與接受者HLA亞型匹配,且尚無(wú)無(wú)免疫抑制下長(zhǎng)期存活數(shù)據(jù);中國(guó)科學(xué)院兩項(xiàng)試驗(yàn)用HLA匹配獲取hESC衍生細(xì)胞,臨床數(shù)據(jù)未公布。
低免疫細(xì)胞系相關(guān)情況
策略及動(dòng)物實(shí)驗(yàn)驗(yàn)證:生成普遍適用的低免疫細(xì)胞系是制藥公司推行策略,可通過(guò)刪除MHC I類和II類表達(dá)基因,強(qiáng)制表達(dá)如CD47、CD64、HLA-E或HLA-G等“不要吃我”信號(hào)來(lái)生成。Sana Biotechnologies證明基因編輯的低免疫恒河猴iPSC在同種異體動(dòng)物宿主中能存活至少4個(gè)月無(wú)免疫排斥跡象,提示該方法可能適用于人類。
相關(guān)試驗(yàn)情況:Century Therapeutics一項(xiàng)試驗(yàn)用相關(guān)“同種異體逃避”NK細(xì)胞,中期數(shù)據(jù)顯示淋巴瘤患者有存活跡象;Viacyte曾于2022年2月為首位T1DM患者注射合作開(kāi)發(fā)的基因編輯免疫逃避細(xì)胞產(chǎn)品VCTX210(NCT05210530),但細(xì)胞系詳情未披露,后因被Vertex收購(gòu),Vertex不再繼續(xù)開(kāi)發(fā)該產(chǎn)品,而是于2023年啟動(dòng)自己的免疫保護(hù)封裝細(xì)胞產(chǎn)品試驗(yàn)(NCT05791201)。
免疫保護(hù)封裝及特殊部位情況
封裝的局限性:封裝雖可用于部分具內(nèi)分泌功能產(chǎn)品(如β細(xì)胞),但不適用于需在宿主組織內(nèi)建立功能性細(xì)胞接觸的細(xì)胞(如心肌細(xì)胞、神經(jīng)元或RPE細(xì)胞)。
中樞神經(jīng)系統(tǒng)和眼部情況:中樞神經(jīng)系統(tǒng)和眼部是部分免疫豁免部位,可能無(wú)需長(zhǎng)期免疫抑制實(shí)現(xiàn)移植物終身存活,來(lái)自RPE、PD和癲癇試驗(yàn)的數(shù)據(jù)顯示停止初始免疫抑制治療后,移植物仍可存活數(shù)月至數(shù)年,與此前非匹配胎兒組織移植到大腦治療PD患者的數(shù)據(jù)相符,所以多數(shù)相關(guān)臨床試驗(yàn)對(duì)輸送同種異體細(xì)胞到中樞神經(jīng)系統(tǒng)和眼部采用先進(jìn)行6-12個(gè)月免疫抑制的方法,未來(lái)需更多移植患者數(shù)據(jù)來(lái)確定同種異體移植物能否在人類中長(zhǎng)期維持無(wú)偶發(fā)性排斥,評(píng)估HLA匹配、自體和低免疫產(chǎn)品的臨床結(jié)果有助于確定最佳發(fā)展方向。
結(jié)論
hPSC衍生產(chǎn)品臨床試驗(yàn)及安全性情況
- 試驗(yàn)規(guī)模及植入情況:自2010年起,全球有83種hPSC衍生產(chǎn)品在116項(xiàng)臨床試驗(yàn)中接受測(cè)試,至少1200名患有34種不同適應(yīng)癥的患者接受了植入,累計(jì)植入細(xì)胞與血小板數(shù)量可觀。
- 安全性表現(xiàn):數(shù)據(jù)顯示在監(jiān)管控制下的PSC衍生產(chǎn)品安全且耐受性良好,即便隨訪長(zhǎng)達(dá)10年(如GRN-OPC1產(chǎn)品),不過(guò)有中國(guó)1例2型糖尿病患者接受自體hiPSC衍生胰島細(xì)胞后出現(xiàn)未成熟畸胎瘤和淋巴結(jié)轉(zhuǎn)移的情況,該治療不屬于獲批臨床試驗(yàn),強(qiáng)調(diào)了監(jiān)管下正確制造、把控產(chǎn)品特性及發(fā)布產(chǎn)品的重要性。
臨床試驗(yàn)產(chǎn)品類型分布及療效數(shù)據(jù)情況
- 產(chǎn)品類型變化:起初中樞神經(jīng)系統(tǒng)和眼部產(chǎn)品在臨床hPSC領(lǐng)域占主導(dǎo),如今免疫、心臟和內(nèi)分泌細(xì)胞產(chǎn)品試驗(yàn)增多,免疫和血細(xì)胞產(chǎn)品類別占接受治療患者的31%。
- 療效數(shù)據(jù)展現(xiàn):已開(kāi)始看到多項(xiàng)試驗(yàn)(如糖尿病、癲癇、帕金森病和AMD相關(guān)試驗(yàn))呈現(xiàn)可靠療效數(shù)據(jù)。
后續(xù)面臨的障礙與挑戰(zhàn)
- 試驗(yàn)設(shè)計(jì)方面:下一個(gè)障礙是為關(guān)鍵的II/III期試驗(yàn)設(shè)計(jì)良好方案,提供產(chǎn)品療效證據(jù),同時(shí)平衡患者擔(dān)憂與監(jiān)管對(duì)安慰劑對(duì)照研究的期望,對(duì)于侵入性手術(shù)(如眼內(nèi)、腦內(nèi)移植)需考慮替代的III期試驗(yàn)設(shè)計(jì),避免不必要的假手術(shù)及漫長(zhǎng)免疫抑制。
- 生產(chǎn)與免疫逃避策略方面:公司面臨擴(kuò)大生產(chǎn)規(guī)模以適應(yīng)市場(chǎng)以及確定現(xiàn)成產(chǎn)品最有前景免疫逃避策略的挑戰(zhàn)。
- 市場(chǎng)定價(jià)方面:成功進(jìn)入市場(chǎng)的hPSC產(chǎn)品需找到可持續(xù)定價(jià)模式,避免出現(xiàn)像其他細(xì)胞和基因療法上市后遭遇的“第二次死亡之谷”情況,解決這些障礙對(duì)推動(dòng)hPSC療法從動(dòng)物研究走向患者可用治療至關(guān)重要。
參考資料:https://www.sciencedirect.com/science/article/pii/S1934590924004454
免責(zé)說(shuō)明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問(wèn),請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加微信
掃碼添加微信