干細胞是一組具有自我復制和多向分化潛能的原始細胞。在某些條件下,它們可以在體內分化成多個成體細胞。干細胞療法,也稱為干細胞移植,是通過全身或局部注射將干細胞輸送到身體的特定部位,以修復患病或受損的組織。許多人類疾病是由某些器官內的異常病變或組織死亡引起的。通過將干細胞移植到這些受損區域,可以再生健康細胞,從而改善器官功能并逆轉疾病狀態。
幾十年來,干細胞及其副產物在眾多臨床前研究和臨床試驗中顯示出修復組織和器官的功效,為代謝性疾病、神經系統疾病等重要疾病的替代療法和可能治愈提供了希望)、血液系統疾病、自身免疫性疾病和心血管疾病,包括心臟病。
設計更好的干細胞療法來治療心臟病

干細胞療法修復心臟病
根據美國心臟協會最近的報告,心血管疾病仍然是全世界的頭號死因。冠心病、擴張型心肌病和嚴重的瓣膜病可在病程末期因心肌細胞缺血壞死而導致心力衰竭(HF)。同時,心臟移植存在供體缺乏、需要長期服用抗排斥藥物、醫療費用高等問題。
由于現有的治療方法對心肌梗死后HF過程的逆轉能力仍然有限,因此心肌細胞的再生成為許多科學家研究的方向。越來越多的干細胞類型已被證明在心臟修復中可見,包括骨骼肌祖細胞、骨??髓干細胞、間充質干細胞 (MSCs)、造血干細胞 (HSCs)、單核細胞等]、脂肪-衍生的干細胞、骨髓和血液衍生的內皮祖細胞、心臟基質細胞 (CSC) 等。
2016年8月,生物科技公司CardioCell在歐洲心臟病學會大會上公布了應用干細胞治療慢性心力衰竭適應癥的有效成果。這是世界上第一個研究間充質干細胞 (itMSCs) 靜脈缺血耐受治療慢性心力衰竭效果的 2a 期臨床試驗。該試驗的結果證明是安全且耐受性良好的,但僅具有邊際功效。同年,在心血管造影和介入學會(SCAI)年會上,多位教授和專家共同宣布了RENEW(Auto CD34+ Stem Cells for Improvement難治性心絞痛患者的能力)試驗和ATHENA(用于難治性慢性心肌缺血伴左心室功能障礙的自體脂肪再生細胞)試驗。盡管這些試驗的結果由于提前終止和有限的樣本量,它們仍然可能是有前途的發展,展示了可行的基于干細胞的心臟療法的潛力。
從工作臺到床邊的當前限制和挑戰
干細胞移植具有巨大的潛力。理論上,干細胞可以分化成幾乎所有類型的人體細胞。然而,根據國際干細胞研究協會的說法,干細胞移植目前僅在造血系統治療中被認為是安全有效的。其他廣泛使用的干細胞療法應用于皮膚(在燒傷的情況下)、骨骼和角膜疾病以及骨髓移植。
幾十年來,干細胞已在臨床前動物模型和臨床試驗中得到廣泛研究。然而,很少有試驗獲得FDA的批準并成功上市。對于心血管缺血等心臟病,干細胞療法在心臟病中的臨床試驗有264項,但尚未進入臨床(表1)。其他基于細胞的 HF 或心肌病療法包括 DREAM-HF(間充質前體細胞在慢性HF中的3期試驗)、CONCERT-HF(間充質和c-kit+心臟干細胞的組合作為心力衰竭的再生療法)、ELPIS(左心發育不全綜合征患者的同種異體人MSC注射)和POSEIDON-DCM(同種異體與非缺血性擴張型心肌病的自體 MSCs)。
干細胞療法修復心臟病的機制
最初,干細胞治療領域在治療心臟病方面有兩種機制。
一種是“替代”理論。在這種情況下,移植的干細胞分化成心肌細胞,取代因心肌梗塞而丟失的細胞。在一次重大心臟病發作事件中,患者可能會損失多達5億個心肌細胞。干細胞向心肌細胞分化的研究自該理論首次建立以來一直在積累。然而,許多研究中記錄的低存活率和植入效率使這種機制的重要性受到質疑。同時,多項研究表明,成體干細胞不能分化為心肌細胞,但這似乎并不影響其修復受損心肌、改善心肌功能的能力。一系列不斷改進的檢測技術繼續增加了解其行為背后機制的可能性。
另一種觀點是“清醒”學說,認為干細胞分泌細胞因子營養素,促進內源性細胞增殖,從而減少因心肌梗死而死亡的細胞數量。旁分泌活動是細胞與附近其他細胞交流的重要過程。它似乎對體內活躍的細胞間過程特別有價值,例如基于干細胞的再生。事實上,現在有大量證據支持旁分泌機制對組織再生至關重要的假設。
近年來,更多證據表明移植的干細胞通過向常駐細胞分泌生物活性蛋白或旁分泌因子來發揮其治療作用。在心臟中,還有多種旁分泌因子在心臟修復中起著關鍵作用,包括生長因子和趨化因子,如血管內皮生長因子(VEGF)、堿性成纖維細胞生長因子(FGF)、肝細胞生長因子(HGF)、胰島素樣生長因子1 (IGF-1) 和分泌的卷曲相關蛋白2 (Sfrp2) 。
對急性心肌梗死 (AMI) 干細胞療法的研究越來越多,這對心臟無法修復的傳統觀念提出了質疑。推而廣之,人們對針對心血管疾病的干細胞療法的熱情持續高漲。但不幸的是,無論是基于干細胞的心臟再生的臨床前研究,還是干細胞療法的臨床試驗,仍然存在許多局限性。
未來干細胞療法治療心臟病需要克服哪些挑戰?
長期療效
盡管有證據表明心臟功能有短期改善,但尚不清楚心臟干細胞療法是否具有長期益處。
2009年4月,Meyer等人發表了一項涉及骨髓細胞移植以促進ST段抬高心肌梗死再生 (BOOST) 的臨床試驗的長期(5 年)隨訪。結果顯示,與對照組相比,6個月后左心室功能(以左心室射血分數 (LVEF) 衡量)明顯改善。然而,在應用治療后5年的長期隨訪中,兩組在左心室心臟功能或主要不良心血管事件 (MACE) 的改善方面沒有顯著差異。研究人員認為,盡管治療組LVEF恢復較快,但需要解決接受干細胞移植的AMI患者左心室收縮功能長期改善不足的問題。
無法控制的生物分布
損傷或疾病部位的干細胞移植不良被認為是某些干細胞試驗療效不佳的主要原因。傳統的干細胞全身輸送,通過靜脈注射完成,雖然很容易,但并不是特別擅長將細胞送到需要的地方。更重要的是,大部分注射細胞會積聚在其他器官中,例如肺。一種替代方法是直接將細胞或副產品注射到損傷組織中。這一直是心臟修復的流行研究策略。我們和許多其他人通常通過心肌內注射將治療性干細胞注入心臟的梗塞邊界區。這種方法的一個明顯缺點是它通常需要開胸手術,導致術后疼痛增加和患者的一般風險。
另一個必須解決的臨床障礙是體內干細胞的低存活。在許多基于干細胞的心臟修復臨床試驗中,自體細胞被靜脈內或冠狀動脈內注射到患者體內。不知何故,在移植24到48小時后,通常只有一小部分細胞(約 5%)留在移植部位。移植后四到六周,99%的保留細胞無法存活。據信導致細胞活力下降的原因之一是心臟或其他器官的惡劣環境,這會威脅到它們的增殖,加速細胞凋亡和向其他問題的遷移。
提高干細胞療法治療心臟病的方式有哪些?
提高瞄準能力
干細胞療法面臨的第一個挑戰是有效遞送。具體來說,與常規的藥物治療類似,重要的是將細胞有針對性地送到損傷部位。實現這一點是生物工程的目標之一。
克服低細胞保留
在實現更有效的細胞治療靶向遞送后,下一個要克服的障礙是改善損傷部位的細胞植入。為了改善移植干細胞的低保留率和存活率,在過去十年中開發了許多創新的生物材料,將它們封裝起來并在注射后保護它們。可注射水凝膠采用不同類型的材料設計,并與內部的特定干細胞結合。
無細胞療法
如上所述,干細胞移植不可避免的風險是致瘤性或免疫原性。因此,該領域的許多人都傾向于研究從干細胞中釋放的生物活性劑,這些生物活性劑具有相當的治療效果,這表明有可能成為干細胞療法的有前途的替代方案。目前正在研究的最重要的生物活性劑是EV,包括微泡和外泌體,它們含有在干細胞中發現的生物活性成分 [mRNA、miRNA、蛋白質(生長因子)]。這些已被證明對損傷后的心肌修復具有有益作用(類似于細胞療法)。
結論
縱觀數十年的干細胞臨床前研究和臨床試驗,挑戰和風險并存,前景和創新也并存。如何以更具創新性的策略克服最顯著的短板,是擺在每一位生物工程師面前,一直在努力做,未來也需要做的問題(圖1)。無論如何,一個不可或缺的前提是更全面地解讀和理解干細胞有益于心臟再生的機制。
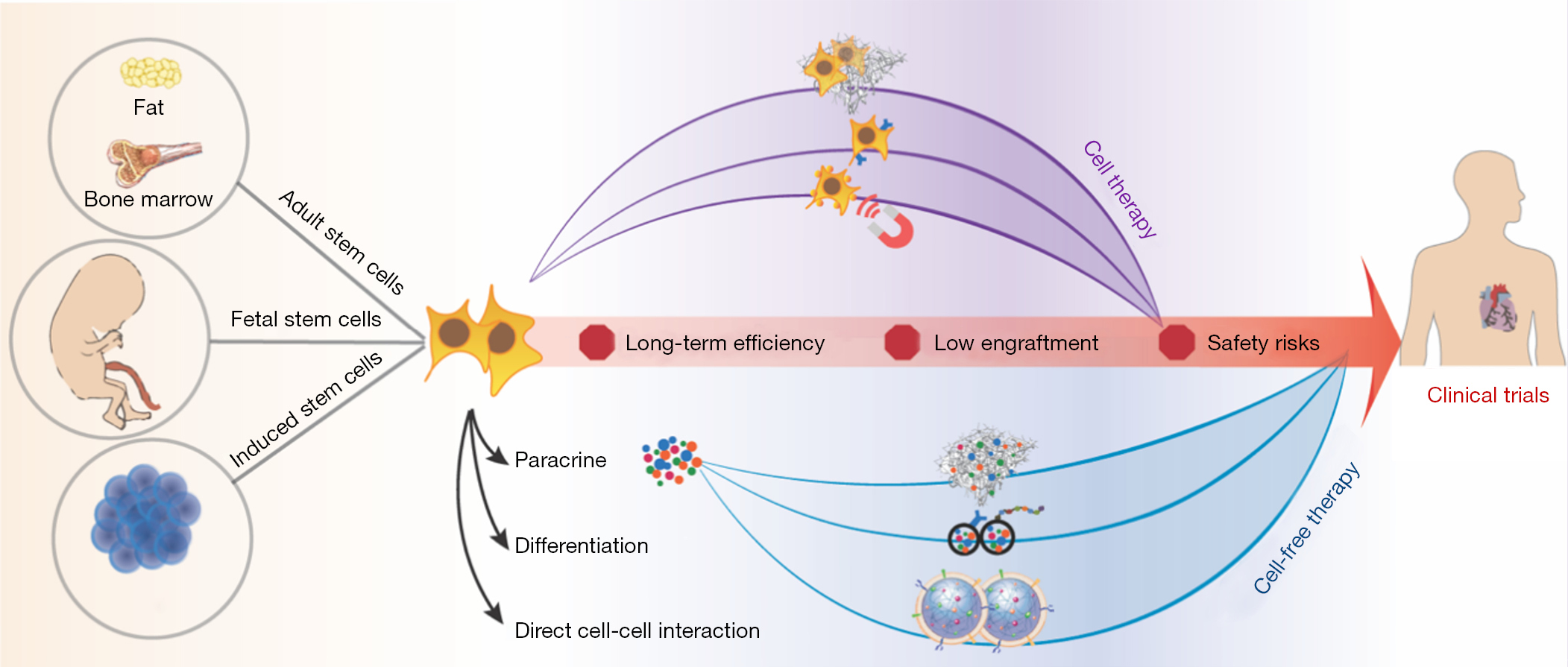
正如我們之前提到的,除了旁分泌效應外,我們仍然認為細胞與細胞的直接接觸在此過程中起著至關重要的作用。因此,結合旁分泌效應和由細胞間串擾觸發的心臟細胞內在程序的潛在激活,然后進一步觀察細胞命運、細胞生態位和細胞原位遷移,是我們的首要任務為未來十年推進用于心臟修復的干細胞療法。



 掃碼添加微信
掃碼添加微信