外傷或中風引起的腦損傷是成人死亡和殘疾的主要原因。不幸的是,很少有干預措施對腦組織損傷后修復有效。
在關于內源性神經發生是否確實發生在成年人腦中的長期爭論之后,現在有大量證據支持其發生。盡管損傷通常會顯著刺激神經發生,但神經干/祖細胞內源分化的修復潛力通常不足。另外,外源干細胞移植在動物模型中顯示出有希望的結果,但長期存活率差和神經元分化效率低等局限性使其在臨床應用中仍然具有挑戰性。

成人神經再生的多功能策略:干細胞移植修復受損大腦的途徑
在這篇綜述中,我們旨在總結成人神經發生三個不同方面的歷史研究和最新進展:內源性神經發生、外源性干細胞移植和直接膠質細胞到神經元的轉換。
內源性神經發生:關于神經再生基礎的爭論
20世紀初,西班牙著名神經科學家Ramon y Cajal聲稱神經發生僅發生在胚胎發育過程中。因此,幾十年來人們一直相信成人大腦中不會出現新的神經元。Altman(1962)通過提供第一個證據證明成年嚙齒動物大腦中可以產生新的神經元,對這一觀點提出了挑戰。雖然隨后的證據支持這種可能性,但相應的放射自顯影和組織學技術被認為是有爭議的,并且多年來對這一新興領域的關注較少。20世紀90年代,基于抗體的生物標志物檢測方法等新技術的迅速發展,越來越多的證據進一步支持了成年嚙齒動物大腦中神經發生的存在。
室下區(SVZ)和顆粒下區(SGZ)是成年嚙齒動物大腦中兩個特征明確的神經源性生態位。然而,神經發生是否發生在成年人身上仍然存在爭議。因此,在解決改善ABI結果的神經源性策略之前,有必要考慮支持或反駁這一重要概念的論點。
經典神經源性生態位:嗅球、紋狀體和皮質中SVZ衍生的神經發生
二十多年前,成年神經發生領域的先驅團體之一Alvarez-Buylla及其同事將SVZ星形膠質細胞鑒定為成年嚙齒類動物大腦中的神經干細胞 (NSC)。后來研究人員發現,在小鼠和大鼠中,SVZ中的NSC可以通過遷移到紋狀體或皮層并分化為神經元來對中風引起的腦損傷做出快速反應。動物研究中鼓舞人心的結果使許多科學家和臨床醫生相信通過刺激SVZ內源性神經發生來促進紋狀體和皮質中風后神經修復的可行性。新方法為成人大腦中神經發生的存在提供了新的證據。
經典神經發生生態位:海馬SGZ衍生的神經發生
海馬體是學習和記憶最重要的大腦區域。它非常容易受到腦損傷,并且也受到癡呆癥,特別是阿爾茨海默病的影響。齒狀回SGZ中的NSC可以補充海馬神經元,以整合到現有的神經回路中。20世紀90年代,Fred Gage小組報告了大鼠和小鼠的年齡依賴性海馬神經發生。嚙齒動物的神經源性活動可以通過豐富的環境和跑步來增強。
新穎的神經源性生態位
嚙齒類動物的成年神經發生可能不僅限于SVZ和SGZ,因為在其他腦區也有報道,如下丘腦、黑質和杏仁核。與SVZ和SGZ相比,這些大腦區域的神經發生似乎表現出年齡依賴性下降。隨著人類研究的深入,探索這些新的潛在神經源性生態位是否可能在損傷后恢復中具有治療相關性將會很有趣。
總而言之,經典神經源性生態位中的成體神經發生在嚙齒類動物中得到了充分研究,但在人類中仍然存在爭議。表格1)。
| 神經源性生態位 | 主要技術 | 成人神經發生 | 參考 |
|---|---|---|---|
| SVZ | 免疫染色 | 不 | 薩奈等人,2011 |
| 是的 | 金等人,2006 | ||
| IdU 標記、14 C 標記、免疫染色 | 是的 | 恩斯特等人,2014 | |
| SGZ | BrdU 標記、免疫染色 | 是的 | 埃里克森等人,1998 |
| 14 C標記、免疫染色 | 是的 | 斯伯丁等人,2013 | |
| 免疫染色 | 是的 | 丹尼斯等人,2016 | |
| 不 | 諾蓋拉等人,2018;索雷爾斯等人,2018 | ||
| 體視免疫染色 | 是的 | 博爾德里尼等人,2018 | |
| 單細胞測序、免疫染色 | 不屬于人類 | 弗蘭吉克等人,2022 | |
| 是的 | 周等人,2022 |
目前可以獲得大量有關健康成人神經發生的信息,并且在TBI或中風患者中,只要可以獲得高質量的大腦樣本。在許多創傷性腦損傷和中風病例中,皮質、紋狀體和海馬體是受影響的關鍵大腦區域。如果成年人的神經發生在這些區域得到證實,那么開發增強內源性神經發生的藥物策略對于補償神經元損失可能非常有價值。
然而,由于內源性神經發生在成年人中似乎充其量也極其有限,因此依靠這種機制可能不足以切實改善患者的治療結果。因此,需要探索利用外源性神經源的補充策略來恢復ABI病例的神經功能。
外源干細胞移植:安全且有效?
由于內源性神經發生可能不足以修復腦損傷,因此引入外源性干細胞成為一種有前途的補充或替代策略。近年來,干細胞移植已在動物模型中廣泛探索,以治療腦和脊髓損傷以及神經退行性疾病。盡管這些研究證明了不同干細胞療法在動物模型中具有強大的神經保護和神經修復能力,并引發了多項臨床試驗,但目前尚不清楚這些策略是否有益于腦損傷患者。
干細胞的來源
干細胞的常見來源:包括間充質干細胞/基質細胞 (MSC)、胚胎干細胞 (ESC)、誘導多能干細胞 (iPSC) 和神經干細胞,所有這些細胞至少可以在體外分化為成熟的神經元。
干細胞治療常用的不同干細胞的特點總結如下:表2
| 細胞類型 | 來源 | 優勢 | 壞處 | 參考 |
|---|---|---|---|---|
| 間充質干細胞 | 各種成人組織 | 來源廣泛,倫理問題較少,移植排斥和腫瘤發生的風險低 | 神經分化能力有限 | 烏魯蒂亞等人,2019;Fri?ová 等人,2020 |
| 神經干細胞 | 流產胎兒的大腦 | 神經分化的比能力 | 來源極其有限,存在重大倫理問題、移植排斥和腫瘤發生的風險 | 哈里森,2012;Fri?ová 等人,2020 |
| 胚胎干細胞 | 胚胎 | 高效神經分化 | 來源有限和主要倫理問題、移植排斥和腫瘤發生的風險 | Fri?ová 等人,2020;瓦拉德茲-巴爾巴等人,2020 |
| 誘導多能干細胞 | 原則上任何組織,通常是皮膚或血液 | 來源無限,無倫理問題,移植排斥風險低 | 操作過程中基因組的不穩定性、技術/經濟障礙、致瘤風險 | Fri?ová 等人,2020;瓦拉德茲-巴爾巴等人,2020 |
干細胞移植治療腦損傷的動物研究
迄今為止,人們已經做出了大量努力來研究干細胞移植對嚙齒動物腦損傷模型的影響。二十多年前,靜脈注射大鼠骨髓來源的間充質干細胞被用于治療大鼠腦缺血性損傷。
為了更好地適應潛在的臨床并發癥,后來的研究將非人類靈長類動物甚至人類干細胞引入嚙齒動物模型中。例如,移植用視黃酸處理的猴源ECS來誘導神經細胞,可顯著改善實驗性腦損傷小鼠的運動功能。
此后不久,據報道,在中風小鼠模型中,猴胚胎干細胞誘導的神經元祖細胞在移植后存活并增殖直至4周。同樣,之前的研究表明,人類胎兒神經干細胞在移植到缺血性中風大鼠體內后至少4周內會分化為神經元并增殖。
干細胞移植治療腦損傷的臨床試驗
這些有希望的結果加速了干細胞療法在創傷性腦損傷、中風和其他腦損傷的臨床試驗中的應用。
在一項涉及97名治療TBI患者和69名對照TBI患者的臨床試驗中,通過腰椎穿刺將自體骨髓來源的間充質干細胞移植到蛛網膜下腔后,未報告明顯的不良反應,并且運動功能得到改善。通過類似的程序,使用臍帶間充質干細胞和胎兒神經和造血細胞的療法也表現出安全性,但在TBI恢復中的療效有些有限。
對于中風治療,改良的骨髓間充質干細胞(SB623細胞)被認為是安全的,并且在一項包含18名患者的I/IIa期研究中提供了顯著的臨床改善。一項對65名接受干細胞治療和58名接受安慰劑治療的患者進行的隨機對照II期研究表明,靜脈注射多能成體祖細胞通過了安全性評估,但主要終點神經功能恢復尚未達到。
此外,一項針對23名中風患者的多中心單臂研究得出結論,胎兒神經干細胞腦內植入是可行的,并且可以適度改善上肢功能,其中一名患者在治療3個月后有所改善,三名患者在治療6-12個月后有所改善。
盡管試驗間差異較大(即累積移植細胞劑量從1×106至1×109個細胞不等),但干細胞移植的安全性和可行性已在幾乎所有臨床試驗中得到證實,不良反應可接受且較低腫瘤發生的機會。然而,必須指出的是,幾乎所有已發表的臨床研究都是I/II期試驗,治療組患者少于100名。盡管有一些跡象表明某些適應癥有好處,但統計功效不足以得出干細胞治療后神經功能恢復顯著改善的結論,而且主要終點主要顯示治療組和對照組之間差異不大。表3)。
| ABI型 | 臨床試驗類型 | 患者體型 | 干細胞類型/劑量 | 主要結論 | 參考 |
|---|---|---|---|---|---|
| 創傷性腦損傷 | 非隨機、開放標記、干預性隊列研究 | 97例接受治療,69例控制 | 骨髓間充質干細胞/5×10 6 | 97名患者中有38名的意識或運動功能得到改善 | 田等人,2013 |
| 隨機、單盲對照臨床研究 (ChiCTR-TNRC-11001528) | 20名治療者和20 名對照者 | UC-MSCs/4×10 6 | 通過FMA和FIM 評估改善神經功能 | 王等人,2013 | |
| 隨機研究,未指定 | 38名治療者和38 名對照者 | 人胎腦、神經及造血肝組織/200×10 6 | 治療促進意識覺醒和神經康復 | ||
| 缺血性中風 | 單臂、開放標簽研究、I/IIa 期試驗 (NCT01287936) | 18名患者接受治療(3組,每組6名患者) | 改良BM-MSC (SB623)/2.5×10 6、5.0×10 6或10×10 6 | 治療與12個月時的改善相關 | 斯坦伯格等人,2016 |
| 隨機、雙盲、安慰劑對照、II 期試驗 (NCT01436487) | 65名接受治療的患者和58名接受安慰劑的患者 | 多能成體祖細胞/4×10 8 –1.2×10 9 | 主要終點無顯著改善 | 赫斯等人,2017 | |
| 多中心、單臂、開放標簽研究 (EudraCT 2012-003482-18) | 23治療 | 人胎兒NSCs/2×10 7 | 23名患者中有4名上肢運動得到改善 | 繆爾等人,2020 |
膠質細胞到神經元的直接轉換:損傷后神經發生的新時代?
與其他類群相比,哺乳動物的神經膠質細胞比例較高。在無脊椎動物模型(如秀麗隱桿線蟲或黑腹果蠅)的大腦中,神經膠質細胞的比例不到25%。相比之下,小鼠大腦中約65%的細胞是膠質細胞。早期研究表明,人腦中約有一萬億個神經膠質細胞,神經膠質細胞與神經元的比例為10:1。然而,最近的證據表明,膠質細胞與神經元的比例為1:1更準確地描述了成人大腦,膠質細胞的數量估計下降到4000-1.3億個。有趣的是,在成人大腦中,包括星形膠質細胞、小膠質細胞和少突膠質細胞前體(OPCs)在內的膠質細胞可以不斷產生子細胞。
如果神經膠質細胞向神經元的轉化真的發生了,那么神經膠質細胞就可能代表一個內源性的、幾乎無限的細胞池,用于補充腦損傷后失去的神經元。我們將重點關注ABI的潛在治療應用,并在下文中總結了 “神經膠質細胞到神經元 “細胞轉換的最新進展。
星形膠質細胞到神經元的重編程
雖然星形膠質細胞和神經元最初都起源于NSCs,但這兩種細胞類型最終都產生于特定的、命運受限的(神經元和膠質細胞)祖細胞,它們表現出不同的分化路徑。因此,通過簡單而可行的重編程方法發現從星形膠質細胞到神經元的直接轉換路徑是一項重大突破。
OPC到神經元重編程
成熟的髓鞘化少突膠質細胞為大型神經軸突提供髓鞘,對保障神經連接至關重要。然而,人們認為它們的增殖潛力極為有限。相比之下,廣泛存在于中樞神經系統(CNS)灰質和白質區域的一小部分表達NG2的OPCs,可以很容易地增殖并分化成成熟的少突膠質細胞。盡管OPCs具有干細胞特性,但其是否也能生成星形膠質細胞和神經元仍存在爭議。2008年,Rivers等人報告說,NG2+膠質細胞主要能在前腦產生少突膠質細胞,在較小程度上能產生神經元,但不能在灰質或白質產生星形膠質細胞。因此,需要更多確鑿證據來說服科學家和臨床醫生相信在體內對NG2+膠質細胞進行重編程的可行性。
小膠質細胞到神經元的重編程
小膠質細胞是特化的中樞神經系統駐留巨噬細胞,來源于胚胎卵黃囊中的原始髓樣前體細胞。在大多數研究中,研究人員關注的重點是小膠質細胞的吞噬功能,如清除受損神經元的碎片,以及它們在中風后神經炎癥中作為促炎和抗炎狀態調節器的雙重作用。
表4總結了神經膠質細胞-神經元直接重編程的主要研究成果。

有趣的一點是,在所有類型的中樞神經系統損傷中,包括中風、創傷性腦損傷和脊髓損傷,神經膠質疤痕都會迅速形成,并在初期起到防止損傷擴大的屏障作用。然而,在慢性恢復階段,神經膠質疤痕會抑制神經再生并誘發神經炎癥反應。膠質疤痕主要由反應性星形膠質細胞組成,此外還有NG2+膠質細胞和小膠質細胞,它們在損傷后會被激活并迅速增殖。
如上所述,據報道,所有這三種類型的膠質細胞都可能具有直接重編程為神經元的能力。這為治療腦損傷提供了一種誘人的策略:抑制膠質細胞的活化以限制膠質疤痕的形成并減輕過度炎癥,同時利用膠質細胞的增殖能力將其重新編程為功能性神經元。
結論與展望
神經元損傷的特征是ABI后立即發生,并且在慢性階段損傷將進一步加劇,導致進行性神經元死亡。為了盡量減少或防止這種結果,確認成人神經發生的存在至關重要。然而,考慮到成人大腦中的神經發生似乎非常有限,即使在受傷后迅速受到刺激,這種機制也可能是不夠的。另外,外源干細胞移植已在臨床試驗中顯示出安全性和可行性;然而,其療效仍有待III期研究驗證。
同樣,神經膠質細胞向神經元轉化的進展為腦損傷后的神經發生開辟了一條新途徑,但其可靠性仍不確定。目前關于成體神經發生的基礎及其通過干細胞移植和神經膠質細胞到神經元轉換進行神經修復的潛力的知識總結于圖1。
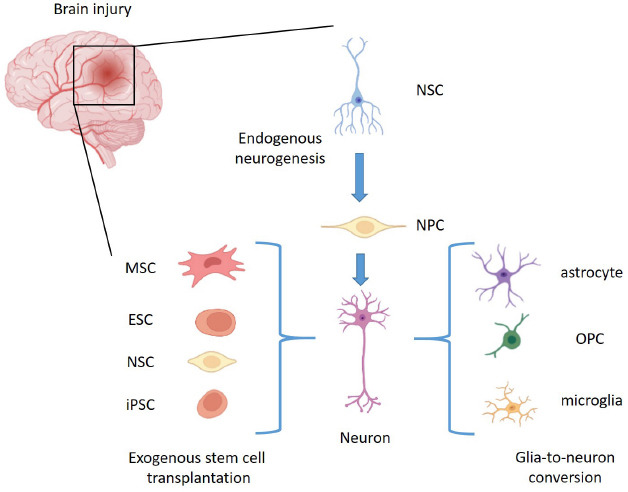
盡管神經發生在成人大腦中的存在仍存在爭議,但預計損傷刺激的神經發生只能在有限程度上彌補神經元的損失。外源移植間充質干細胞、胚胎干細胞、神經干細胞或誘導多能干細胞被認為可替代性地增強損傷后的神經發生,并已在臨床試驗中進行了評估。
最近的研究進一步提出,神經膠質細胞(包括星形膠質細胞、OPCs和小膠質細胞)有可能重編程為神經元,并在腦損傷后補充神經元群體,這為腦損傷治療提供了一條新途徑。
研究技術的不斷改進正穩步拓寬我們在成體神經發生領域的知識。總之,盡管仍然存在巨大的障礙,但毫無疑問,利用定向干細胞移植療法修復大腦的新時代已經到來。
參考資料:Zhao J, Liu S, Xiang X, Zhu X. Versatile strategies for adult neurogenesis: avenues to repair the injured brain. Neural Regeneration Research. 2024 Apr;19(4):774-780. DOI: 10.4103/1673-5374.382224. PMID: 37843211; PMCID: PMC10664121.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信