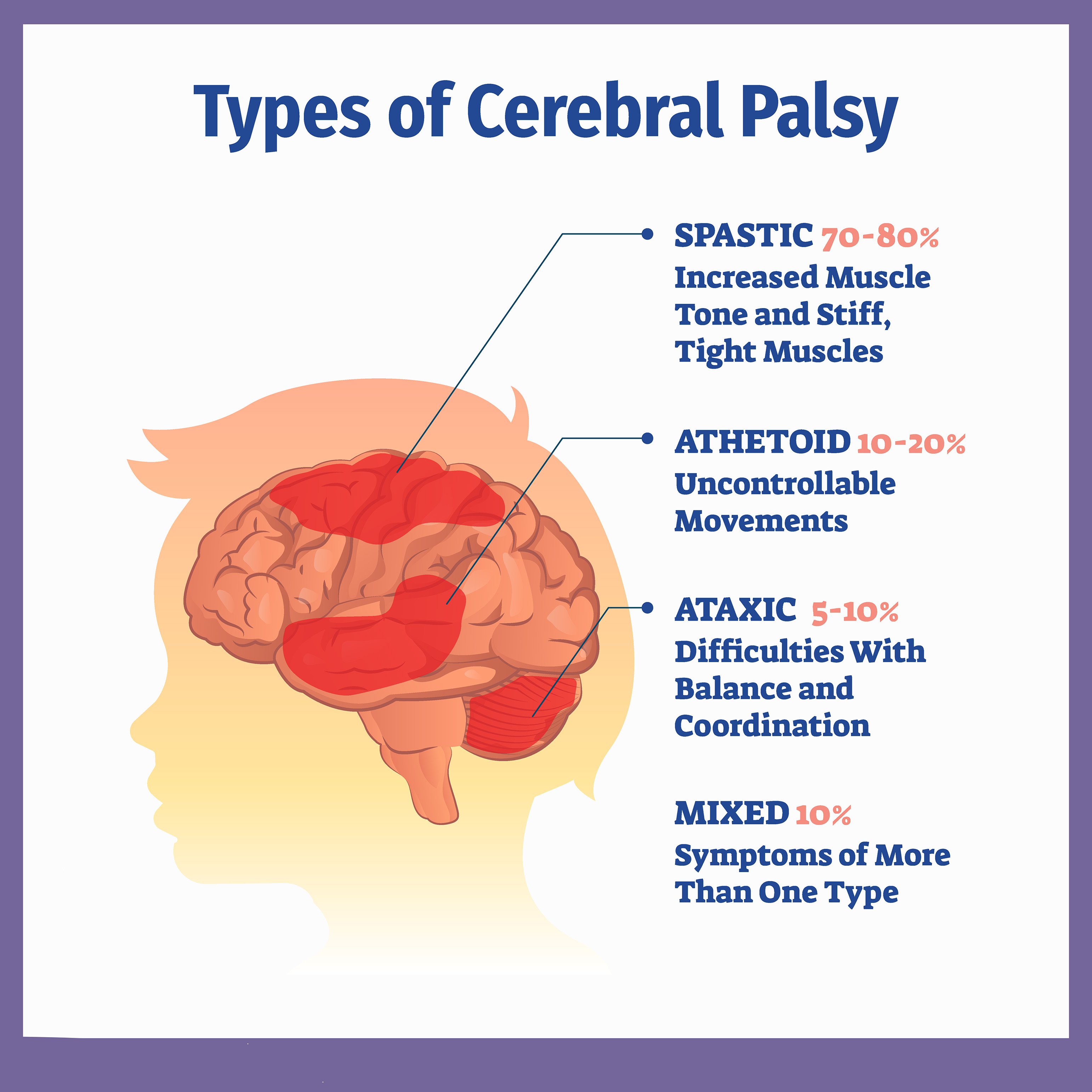
在世界衛生組織(WHO)最新發布的統計數據中,美國腦癱患兒有75萬,患病率大約2.5%。日本腦癱患病率1.5%,丹麥2.08%,挪威2.34%,英國1.8-5%;而在中國0-6歲兒童的腦癱患病率為1.8-4%,并以每年4.6萬的速度遞增。中國有400多萬腦癱患兒,相當于一個中等城市的總人口數。其中多數患兒因沒有早期發現和治療,造成了終身殘疾。
目前臨床治療腦癱的手段,僅能保住患者的生命,卻無法讓他們重獲生活的尊嚴。患者迫切需要一種新的治療技術,不僅僅能讓自己活下來,還能讓自己有尊嚴地活著。那么,是否存在一種更為有效的治療手段呢?
近年來,干細胞療法憑借其獨特的再生能力,為腦癱治療帶來了新希望。干細胞具有分化為多種細胞類型的能力,可替代受損神經元,促進神經回路修復;同時通過分泌神經營養因子、抗炎因子等生物活性分子,調節炎癥反應和免疫系統,從而改善神經功能。然而,干細胞治療的療效與安全性高度依賴于劑量選擇及給藥方案的優化
本文結合現有臨床證據,系統分析不同干細胞劑量在腦癱治療中的安全性,探討劑量優化的潛在策略,以期為臨床實踐提供科學依據。
低劑量VS高劑量:不同劑量的干細胞治療腦癱哪個更加安全?
一、干細胞治療腦癱的劑量-效應關系
干細胞(如間充質干細胞、神經干細胞)的療效與劑量呈非線性關系:
- 閾值效應:需達到最低有效劑量才能激活修復機制;
- 飽和效應:超過臨界劑量后療效不再顯著提升,但不良反應風險增加;
- 個體差異:患兒年齡、體重及腦損傷程度影響最佳劑量窗口。
二、劑量相關安全性風險的臨床觀察
2.1 低劑量組(≤20×106細胞/次)
2023年,我國科研人員在行業期刊《干細胞研究與治療》上發表了一篇關于《經鼻給予神經干細胞治療腦癱的安全性和有效性結果:一項隨機1/2期對照試驗》的臨床研究成果。
本研究評估了經鼻給藥NSC對腦癱 (CP) 兒童的安全性和有效性,將25例3~12歲的腦性癱瘓(CP)患者隨機分為治療組(n=15)和對照組(n=10)。參與者每公斤體重接受2×106個低劑量的hCT-MSCs劑量,每3個月進行3次輸注。

本研究對25例接受神經干細胞(NSCs)聯合康復治療或單純康復治療的患者進行24個月隨訪,結果顯示:鼻腔給藥及NSCs移植未引發任何與治療相關的嚴重不良事件(AE),所有AE均為I級或II級事件或短暫癥狀(持續時間≤3天)。(見圖1)
上述結果表明,NSCs聯合鼻腔給藥治療在24個月長期隨訪期內具有良好的安全性,且不良反應可控、無長期殘留效應。

2024年,《Stem Cell Reviews and Reports》期刊發表的一項研究顯示,152名腦癱(CP)患者在輸注10次人臍帶間充質干細胞(hUC-MSCs)后,運動功能和病情嚴重程度得到了明顯改善。

本次研究納入了152例腦癱患兒讓他們接受最多兩個療程、每療程五次的接受人臍帶間充質干細胞(hUC-MSCs)治療,每次劑量按體重分為10×106至40×106細胞。結果顯示所有劑量組均未報告嚴重不良反應(如感染或腫瘤形成)。
2.2 中高劑量組(30-40×106細胞/次)
2018年,西安神經生物學研究所牽頭在行業期刊《細胞移植》上發表了一篇關于《針對腦癱兒童進行人臍帶血間充質干細胞輸注的隨機、安慰劑對照試驗》的臨床研究成果,并在治療后3、6、12、24個月對54例腦癱患者進行了隨訪評估。

輸注組包括27例患者,接受4次高劑量hUCB-MSCs輸注(靜脈輸注,劑量為5×107)和基礎康復治療,而對照組中的27例患者接受0.9%生理鹽水和基礎康復治療。
根據研究計劃,通過不良事件(AE)記錄和分析進行安全性評估。任何在體格檢查、實驗室檢查、心電圖和其他檢查中出現具有臨床意義的不適、癥狀或異常結果均視為AE。
整個研究期間未觀察到嚴重不良事件(SAE)。在所有觀察到的非SAE中,上呼吸道感染和腹瀉是最常見的報告癥狀。所有觀察到的AE均未對研究產生顯著影響。此外,未檢測到發熱或白細胞減少等免疫排斥事件。MRI結果顯示在整個研究過程中未見腦腫瘤征兆。此外,在一般實驗室檢查結果和體格檢查中未觀察到其他AE。(見圖2)

2021年,伊朗德黑蘭醫科大學在行業期刊《干細胞研究與治療》上發表了一篇關于《臍帶組織間充質干細胞鞘內注射治療腦癱的臨床及影像學結果:一項隨機雙盲假手術對照臨床試驗》的臨床結果。

患有痙攣性腦性癱瘓的參與者(4-14 歲)按 1:1 的比例分配接受UCT-MSC或假手術。實驗組注射單劑量(2 × 107)細胞。
該研究納入了72名腦癱參與者進行分析。從基線到干預后12個月,在參與者中發現了5起不良事件。UCT-MSC組中有2 例(2/36或5.5%)在鞘內細胞注射后24小時內出現發燒(38至38.7o C),但自行緩解,且未診斷出感染(例如腦膜炎)。其他術后24小時內報告的不良事件包括:
- 輕度至中度煩躁:對照組3例(8.3%),UCT-MSC組6例(16.7%);
- 頭痛:對照組1例(2.8%),UCT-MSC組5例(13.9%);
所有癥狀均未發展為嚴重不良事件(SAE),且通過對癥處理后完全緩解。隨訪期間未發現與治療相關不良反應。
三、不同干細胞劑量治療腦癱安全性總結
低劑量組(≤20×10?細胞/次)的安全性顯著優于中高劑量組(30-50×10?細胞/次)。低劑量組(如鼻腔給藥或靜脈輸注)未引發任何嚴重不良事件(SAE),僅出現短暫、輕微的反應(如鼻黏膜刺激、低熱或腹瀉),且癥狀均在3天內自愈,無長期殘留效應或腫瘤風險。
像鼻腔給藥NSC的研究中,所有AE均為I級或II級,且24個月隨訪未發現長期副作用。相比之下,中高劑量組(如5×10?靜脈輸注或2×10?鞘內注射)雖未突破安全閾值,但不良事件發生率略高,如發熱(5.5%)、頭痛(13.9%)或上呼吸道感染,需對癥處理但未發展為嚴重并發癥。
這些結果表明,低劑量方案在安全性上更具優勢,而中高劑量需通過密切監測和個體化調整來平衡風險。
四、劑量相關安全性的影響因素
干細胞類型:
- 間充質干細胞(MSCs)耐受劑量較高,因其低免疫原性;
- 神經干細胞(NSCs)因遷移能力強,推薦劑量≤2×106 cells/kg。
輸注途徑:
- 鞘內注射有效劑量僅為靜脈的1/10,可降低全身暴露風險;
- 腦內局部輸注需嚴格限制劑量,避免局部水腫。
輸注頻次:分次輸注(如每周1次×4周)較單次大劑量更安全,可降低急性反應風險。
結語
干細胞劑量選擇需兼顧療效與安全性:低劑量適用于兒童及首次治療,中高劑量針對重癥患者需嚴格監測。未來需通過高質量臨床試驗、標準化劑量方案及個體化治療策略,進一步優化干細胞治療的安全性,為腦癱患者提供更可靠的治療選擇。
相關閱讀:干細胞治療腦癱:靜脈、鞘內、局部與鼻腔給藥的安全性對比
參考資料:
Lv, Z., Li, Y., Wang, Y. et al. Safety and efficacy outcomes after intranasal administration of neural stem cells in cerebral palsy: a randomized phase 1/2 controlled trial. Stem Cell Res Ther 14, 23 (2023). https://doi.org/10.1186/s13287-022-03234-y
Chro?cińska-Kawczyk, M., Zdolińska-Malinowska, I. & Boruczkowski, D. The Impact of Umbilical Cord Mesenchymal Stem Cells on Motor Function in Children with Cerebral Palsy: Results of a Real-world, Compassionate use Study. Stem Cell Rev and Rep 20, 1636–1649 (2024). https://doi.org/10.1007/s12015-024-10742-2
Huang L, Zhang C, Gu J, et al. A Randomized, Placebo-Controlled Trial of Human Umbilical Cord Blood Mesenchymal Stem Cell Infusion for Children With Cerebral Palsy. Cell Transplantation. 2018;27(2):325-334. doi:10.1177/0963689717729379
Amanat, M., Majmaa, A., Zarrabi, M. et al. Clinical and imaging outcomes after intrathecal injection of umbilical cord tissue mesenchymal stem cells in cerebral palsy: a randomized double-blind sham-controlled clinical trial. Stem Cell Res Ther 12, 439 (2021). https://doi.org/10.1186/s13287-021-02513-4
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信