糖尿病作為一種常見的慢性疾病,給患者的生活帶來了極大的困擾。近年來,干細(xì)胞治療在糖尿病領(lǐng)域展現(xiàn)出了巨大的潛力。在進(jìn)行干細(xì)胞治療糖尿病之前,對干細(xì)胞進(jìn)行恰當(dāng)?shù)奶幚砗团囵B(yǎng)至關(guān)重要。本文將詳細(xì)探討干細(xì)胞治療糖尿病前細(xì)胞的處理和培養(yǎng)方法。
干細(xì)胞治療糖尿病前,細(xì)胞需要如何處理和培養(yǎng)?

首先需要選擇細(xì)胞來源(自體和異體干細(xì)胞)
- 來源:從患者自身的體細(xì)胞(如皮膚細(xì)胞、血液細(xì)胞等)中提取,通過重編程技術(shù)誘導(dǎo)成多能干細(xì)胞.
- 作用機制:具有分化為各種細(xì)胞類型的潛能,可以被誘導(dǎo)分化為具有分泌胰島素功能的胰島β細(xì)胞,從而恢復(fù)患者的胰島功能。
自體外周血干細(xì)胞(PBSCs)
- 來源:從患者自身的外周血液中分離提取。
- 作用機制:通過移植到患者體內(nèi),促進(jìn)胰島β細(xì)胞的再生和修復(fù),改善胰島功能。
- 來源:廣泛存在于患者自身的骨髓、脂肪、胎盤和臍帶等組織中。
- 作用機制:通過分泌多種細(xì)胞因子和生長因子,發(fā)揮抗炎、免疫調(diào)節(jié)、促血管生成、細(xì)胞再生修復(fù)的作用,調(diào)節(jié)胰島素敏感性,改善β細(xì)胞功能障礙。
異體間充質(zhì)干細(xì)胞(MSCs)
- 來源及特性:
- 間充質(zhì)干細(xì)胞可以從多種組織中獲取,如骨髓、脂肪組織、臍帶血和胎盤等。它具有自我更新能力和多向分化潛能。例如,從骨髓中提取的間充質(zhì)干細(xì)胞可以在合適的誘導(dǎo)條件下分化為骨細(xì)胞、軟骨細(xì)胞和脂肪細(xì)胞等多種細(xì)胞類型。
異體胰島干細(xì)胞
- 來源及特性:胰島干細(xì)胞主要來源于胰腺組織,它們具有分化為胰島各種細(xì)胞類型(包括胰島 α 細(xì)胞、胰島 β 細(xì)胞、胰島 δ 細(xì)胞等)的潛能。
- 在胚胎胰腺發(fā)育過程中,這些干細(xì)胞可以產(chǎn)生大量的胰島細(xì)胞,而在成年胰腺中,也存在少量的胰島干細(xì)胞,它們在一定條件下可以被激活并參與胰島細(xì)胞的更新和修復(fù)。
- 來源及特性:
- 造血干細(xì)胞主要來源于骨髓、外周血和臍帶血。它是一種能夠自我更新并分化為各種血細(xì)胞(如紅細(xì)胞、白細(xì)胞、血小板等)的多能干細(xì)胞。造血干細(xì)胞具有歸巢特性,即它們可以遷移到身體需要造血重建的部位。
詳情信息請點擊(干細(xì)胞治療糖尿病前,患者應(yīng)該如何選擇細(xì)胞來源?)
干細(xì)胞的處理
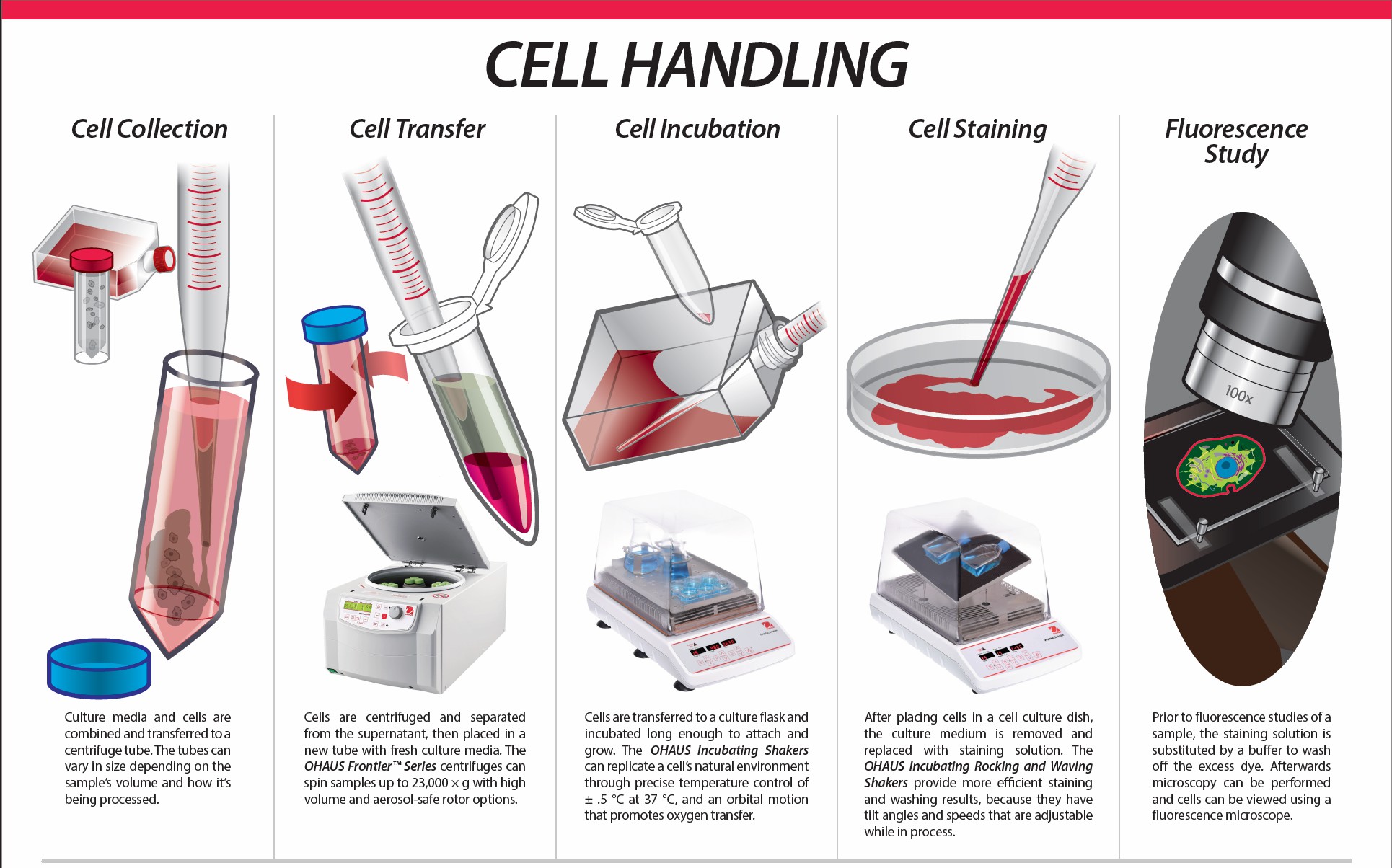
干細(xì)胞分離與純化
密度梯度離心法:
- 原理:根據(jù)不同細(xì)胞成分的密度差異,利用密度梯度離心介質(zhì)(如 Ficoll – Hypaque)來分離干細(xì)胞。當(dāng)離心力作用時,密度不同的細(xì)胞會分層,從而可以收集目標(biāo)干細(xì)胞。
- 操作步驟:將采集到的骨髓、血液等樣本小心地鋪在密度梯度離心介質(zhì)的上層,然后放入離心機,以適當(dāng)?shù)霓D(zhuǎn)速(如 1500 – 2000 轉(zhuǎn) / 分鐘)和時間(如 20 – 30 分鐘)離心。離心后,干細(xì)胞會聚集在特定的層次,用移液器小心地將其吸出。
免疫磁珠分選法:
- 原理:基于細(xì)胞表面標(biāo)志物的特異性抗體。將帶有磁性的微珠與能識別干細(xì)胞表面特定標(biāo)志物的抗體結(jié)合,當(dāng)這些磁珠 – 抗體復(fù)合物與細(xì)胞樣本混合時,會與目標(biāo)干細(xì)胞結(jié)合。然后通過磁場將結(jié)合了磁珠的干細(xì)胞分離出來。
- 操作步驟:首先制備免疫磁珠 – 抗體復(fù)合物,將其加入細(xì)胞樣本中,在適當(dāng)?shù)臏囟龋ㄈ?4℃)和時間(如 30 – 60 分鐘)下孵育,使復(fù)合物與干細(xì)胞充分結(jié)合。然后將樣本置于磁場中,被磁珠標(biāo)記的干細(xì)胞會吸附在管壁上,去除未吸附的細(xì)胞,最后將吸附的干細(xì)胞從磁場中取出,收集備用。
流式細(xì)胞術(shù)分選法:
- 原理:流式細(xì)胞儀能夠檢測細(xì)胞的多種物理和化學(xué)特性,如細(xì)胞大小、顆粒度、熒光標(biāo)記等。通過對細(xì)胞表面標(biāo)志物進(jìn)行熒光標(biāo)記,流式細(xì)胞儀可以精確地識別和分選目標(biāo)干細(xì)胞。
- 操作步驟:首先用熒光標(biāo)記的抗體對細(xì)胞樣本進(jìn)行染色,標(biāo)記干細(xì)胞的特定標(biāo)志物。然后將樣本放入流式細(xì)胞儀,儀器會逐個檢測細(xì)胞的熒光信號等特征。根據(jù)預(yù)設(shè)的分選標(biāo)準(zhǔn)(如特定的熒光強度范圍),儀器會將符合要求的干細(xì)胞分選到收集管中。
干細(xì)胞的培養(yǎng)
培養(yǎng)前處理
細(xì)胞清洗
- 目的:
- 在干細(xì)胞分離后,其表面或周圍可能殘留有分離試劑(如密度梯度離心介質(zhì)、免疫磁珠分選時的抗體 – 磁珠復(fù)合物、流式細(xì)胞術(shù)分選后的熒光標(biāo)記抗體等)。這些殘留物質(zhì)可能會對干細(xì)胞的后續(xù)培養(yǎng)產(chǎn)生不良影響,如干擾細(xì)胞生長信號通路、引起細(xì)胞毒性反應(yīng)等。因此,清洗細(xì)胞是為了去除這些雜質(zhì),為細(xì)胞創(chuàng)造一個純凈的培養(yǎng)環(huán)境。
- 操作方法:
- 通常使用磷酸鹽緩沖液(PBS)進(jìn)行清洗。將分離得到的干細(xì)胞懸浮液轉(zhuǎn)移至離心管中,加入適量的 PBS(一般為細(xì)胞懸液體積的 3 – 5 倍),輕輕顛倒離心管使細(xì)胞與緩沖液充分混合。然后將離心管放入離心機,以相對較低的轉(zhuǎn)速(如 1000 – 1200 轉(zhuǎn) / 分鐘)離心 5 – 10 分鐘。離心后,細(xì)胞沉淀在管底,小心地吸出上清液(含有雜質(zhì)的緩沖液)。重復(fù)上述步驟 2 – 3 次,直到上清液清澈,基本不含雜質(zhì)。
細(xì)胞計數(shù)和活力檢測
- 細(xì)胞計數(shù):
- 目的:準(zhǔn)確了解干細(xì)胞的數(shù)量對于后續(xù)的培養(yǎng)操作至關(guān)重要。合適的細(xì)胞接種密度是保證細(xì)胞正常生長和增殖的關(guān)鍵因素之一。如果接種密度過高,細(xì)胞可能會因為營養(yǎng)物質(zhì)競爭、代謝廢物積累等原因生長不良;而接種密度過低,則可能會導(dǎo)致細(xì)胞生長緩慢,不能充分利用培養(yǎng)資源。
- 操作方法:
- 血細(xì)胞計數(shù)板法:將清洗后的干細(xì)胞用適量的培養(yǎng)基重懸,制成細(xì)胞懸液。然后,使用血細(xì)胞計數(shù)板進(jìn)行計數(shù)。先將血細(xì)胞計數(shù)板的蓋玻片蓋好,用移液器吸取少量細(xì)胞懸液,從計數(shù)板的邊緣緩緩滴入,使細(xì)胞懸液自然充滿計數(shù)室。在顯微鏡下,根據(jù)計數(shù)室的方格,按照一定的規(guī)則(如計數(shù)四角和中央五個中方格內(nèi)的細(xì)胞數(shù))進(jìn)行計數(shù)。最后根據(jù)計數(shù)室的規(guī)格和稀釋倍數(shù),計算出細(xì)胞濃度(細(xì)胞數(shù) / 毫升)。
- 自動細(xì)胞計數(shù)儀法:現(xiàn)代的自動細(xì)胞計數(shù)儀可以更快速、準(zhǔn)確地計數(shù)細(xì)胞。將細(xì)胞懸液按照儀器的要求進(jìn)行適當(dāng)稀釋后,將樣本加入計數(shù)儀的樣本槽中。計數(shù)儀通過光學(xué)或電學(xué)原理,自動識別和計數(shù)細(xì)胞,并直接給出細(xì)胞濃度和其他相關(guān)參數(shù)(如細(xì)胞大小分布等)。
- 活力檢測:
- 目的:檢測干細(xì)胞的活力可以評估細(xì)胞的質(zhì)量,只有活力高的細(xì)胞才適合用于培養(yǎng)和后續(xù)的治療。細(xì)胞活力受到多種因素的影響,如采集過程中的損傷、分離和純化方法的影響等。
- 操作方法 – 臺盼藍(lán)染色法:將細(xì)胞懸液與 0.4% 的臺盼藍(lán)溶液按照一定比例(如 1:1)混合,在室溫下靜置 3 – 5 分鐘。臺盼藍(lán)是一種細(xì)胞活性染料,它不能透過活細(xì)胞完整的細(xì)胞膜,而死細(xì)胞的細(xì)胞膜通透性增加,會被臺盼藍(lán)染成藍(lán)色。然后,使用血細(xì)胞計數(shù)板或顯微鏡載玻片,在顯微鏡下觀察細(xì)胞。隨機選取幾個視野,計數(shù)未染色的活細(xì)胞和染色的死細(xì)胞的數(shù)量,通過以下公式計算細(xì)胞活力:細(xì)胞活力(%)=(活細(xì)胞數(shù) / 總細(xì)胞數(shù))×100%。一般要求干細(xì)胞的活力在 90% 以上才適合進(jìn)行培養(yǎng)。
培養(yǎng)的選擇
基礎(chǔ)培養(yǎng)基類型:
- 常用的基礎(chǔ)培養(yǎng)基包括 DMEM(Dulbecco’s Modified Eagle Medium)高糖培養(yǎng)基和 α – MEM(Minimum Essential Medium – α)培養(yǎng)基。DMEM 高糖培養(yǎng)基含有豐富的葡萄糖和氨基酸,能為干細(xì)胞提供充足的能量和營養(yǎng)物質(zhì),適合大多數(shù)干細(xì)胞的生長。α – MEM 培養(yǎng)基則更側(cè)重于為細(xì)胞提供必需的營養(yǎng)成分,如維生素、礦物質(zhì)等,其成分相對更簡單、更接近細(xì)胞的生理環(huán)境,對于一些較為敏感的干細(xì)胞培養(yǎng)可能更合適。
添加成分:
- 血清:胎牛血清(FBS)是最常用的添加成分,一般添加量為 10% – 20%。胎牛血清中富含多種生長因子,如表皮生長因子(EGF)、成纖維細(xì)胞生長因子(FGF)等,這些生長因子能夠刺激干細(xì)胞的增殖和分化。同時,血清還含有多種蛋白質(zhì)、氨基酸和維生素等營養(yǎng)成分,為干細(xì)胞的生長提供全面的營養(yǎng)支持。不過,由于血清成分復(fù)雜,可能存在批間差異和潛在的病原體污染風(fēng)險,所以也有研究在探索使用無血清培養(yǎng)基。
- 抗生素:為防止細(xì)菌和真菌污染,通常會添加青霉素和鏈霉素。一般使用的終濃度為 100 U/mL 青霉素和 100μg/mL 鏈霉素。這樣可以在細(xì)胞培養(yǎng)過程中有效抑制常見細(xì)菌的生長,但要注意長期使用抗生素可能會導(dǎo)致耐藥菌的產(chǎn)生,所以如果細(xì)胞培養(yǎng)環(huán)境比較穩(wěn)定,也可以考慮適時停用抗生素。
- 生長因子和誘導(dǎo)劑(如果需要誘導(dǎo)分化):對于希望誘導(dǎo)干細(xì)胞向胰島樣細(xì)胞分化用于糖尿病治療的情況,需要添加特定的生長因子和誘導(dǎo)劑。例如,尼克酰胺是一種常用的誘導(dǎo)劑,它可以促進(jìn)干細(xì)胞向胰島 β 細(xì)胞方向分化。激活素 A 也被廣泛應(yīng)用,它可以在細(xì)胞分化的早期階段發(fā)揮作用,引導(dǎo)干細(xì)胞向內(nèi)胚層細(xì)胞分化,為后續(xù)形成胰島樣細(xì)胞奠定基礎(chǔ)。這些生長因子和誘導(dǎo)劑的濃度和添加時間需要根據(jù)具體的實驗方案和干細(xì)胞類型進(jìn)行精確調(diào)整。
培養(yǎng)條件的設(shè)定
溫度:
- 人體細(xì)胞的生理溫度是 37℃,干細(xì)胞培養(yǎng)也通常保持在這個溫度。這是因為細(xì)胞內(nèi)的酶等生物活性物質(zhì)在 37℃時能夠發(fā)揮最佳的功能。如果溫度過高,會導(dǎo)致酶失活、細(xì)胞膜流動性改變等問題,使細(xì)胞代謝紊亂甚至死亡;而溫度過低,則會使細(xì)胞的代謝活動減慢,生長和增殖受到抑制。
二氧化碳濃度:
- 培養(yǎng)環(huán)境中的二氧化碳濃度一般維持在 5% 左右。這是因為培養(yǎng)基中通常含有緩沖體系,如碳酸氫鈉(NaHCO?)。二氧化碳可以與培養(yǎng)基中的碳酸氫鈉相互作用,根據(jù)以下化學(xué)方程式調(diào)節(jié)培養(yǎng)基的 pH 值:CO? + H?O + NaHCO? ? H?CO? + NaHCO? ? 2Na? + 2HCO??。
- 當(dāng)二氧化碳濃度合適時,可以使培養(yǎng)基的 pH 值穩(wěn)定在 7.2 – 7.4 的適宜范圍內(nèi),為干細(xì)胞的生長提供穩(wěn)定的酸堿度環(huán)境。
濕度和氣體交換:
- 培養(yǎng)箱內(nèi)的濕度需要保持在 95% 左右,以防止培養(yǎng)基過度蒸發(fā)。同時,培養(yǎng)容器需要有適當(dāng)?shù)耐笟庑裕员WC細(xì)胞能夠獲得足夠的氧氣和排出二氧化碳。
- 例如,培養(yǎng)瓶通常有透氣的瓶蓋,多孔板也會有透氣的封口膜,這些設(shè)計可以在防止污染的同時滿足細(xì)胞對氣體交換的需求。
細(xì)胞接種與培養(yǎng)過程
接種密度:
- 合適的接種密度對于干細(xì)胞的生長和增殖至關(guān)重要。一般來說,間充質(zhì)干細(xì)胞的接種密度在 1×103 – 1×10?個 /cm2 左右。如果接種密度過低,細(xì)胞之間的信號交流不足,可能會導(dǎo)致細(xì)胞生長緩慢甚至停滯
- 而接種密度過高,則會導(dǎo)致細(xì)胞之間競爭營養(yǎng)物質(zhì)和生長空間,引起細(xì)胞死亡或分化異常。接種密度的具體數(shù)值需要根據(jù)干細(xì)胞的類型、來源以及培養(yǎng)目的等因素進(jìn)行調(diào)整。
培養(yǎng)過程中的觀察與換液:
- 在培養(yǎng)過程中,需要定期觀察細(xì)胞的生長狀態(tài)。可以使用倒置顯微鏡觀察細(xì)胞的形態(tài)、大小、密度等變化。一般在細(xì)胞接種后的 24 – 48 小時內(nèi),細(xì)胞會逐漸貼壁(對于貼壁生長的干細(xì)胞),開始生長和增殖。隨著培養(yǎng)時間的延長,細(xì)胞數(shù)量會逐漸增加。
- 為了給細(xì)胞提供充足的營養(yǎng)物質(zhì)并清除代謝廢物,需要定期更換培養(yǎng)基。通常每隔 2 – 3 天更換一次培養(yǎng)基,具體的換液頻率也可以根據(jù)細(xì)胞的生長速度和培養(yǎng)基的消耗情況進(jìn)行調(diào)整。
傳代培養(yǎng):
- 當(dāng)細(xì)胞生長達(dá)到一定密度(如 80% – 90% 匯合度)時,需要進(jìn)行傳代培養(yǎng)。傳代培養(yǎng)可以擴大細(xì)胞數(shù)量,同時也有助于保持細(xì)胞的活力和正常的生長特性。傳代培養(yǎng)的方法主要是使用胰蛋白酶或其他細(xì)胞消化酶將細(xì)胞從培養(yǎng)容器的壁上脫離下來,然后將細(xì)胞懸液按照一定的比例(如 1:3 或 1:4)接種到新的培養(yǎng)容器中,繼續(xù)培養(yǎng)。
- 在傳代過程中,要注意酶的濃度和消化時間,避免過度消化導(dǎo)致細(xì)胞損傷。
總結(jié)
干細(xì)胞治療糖尿病為患者帶來了新的希望,而在治療前對干細(xì)胞進(jìn)行科學(xué)合理的處理和培養(yǎng)是確保治療效果和安全性的關(guān)鍵。嚴(yán)格遵守實驗室規(guī)范和質(zhì)量控制標(biāo)準(zhǔn),不斷探索和完善干細(xì)胞處理與培養(yǎng)技術(shù),將為糖尿病的治療開辟更加廣闊的前景。
若想了解更多關(guān)于糖尿病和干細(xì)胞治療糖尿病的信息請點擊此處!
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。
版權(quán)說明:本文來自杭吉干細(xì)胞科技內(nèi)容團(tuán)隊,歡迎個人轉(zhuǎn)發(fā)至朋友圈,謝絕媒體或機構(gòu)未經(jīng)授權(quán)以任何形式轉(zhuǎn)載至其他平臺,轉(zhuǎn)載授權(quán)請在網(wǎng)站后臺下方留言獲取。



 掃碼添加微信
掃碼添加微信