目前全球有約4.6億糖尿病患者,每年有420萬人死于糖尿病,我國有近1.3億糖尿病患者。在1糖尿病中,胰島β細胞遭到機體免疫系統無情地破壞,部分或完全失去了分泌胰島素的功能,造成體內胰島素絕對缺乏,引起了血糖水平持續升高,于是糖尿病出現了。胰島移植可以使患者完全脫離胰島素注射,實現疾病治愈,是未來糖尿病治療的理想途徑。
胰島移植,雖可以改善患者的胰島素不足問題,但是供源不足,臨床上無法大規模開展。人多能干細胞具有自我更新和定向分化為功能性細胞的潛能,利用人多能干細胞來源的功能細胞有望用于多種重大疾病治療。
《自然》子刊:鄧宏魁團隊建立全新胰島移植策略,解決干細胞治療糖尿病的關鍵難題
-01-
基礎知識介紹
- 如何獲得人多能干細胞,
- 如何將人多能干細胞誘導分化為胰島細胞,
- 如何將胰島細胞移植到體內。
胰島細胞來源策略
2022年,鄧宏魁研究組建立了一種安全、簡單、易于調控和標準化的人多能干細胞制備技術,即化學重編程技術,完全使用小分子誘導人成體細胞轉變為多能干細胞(hCiPSC)。鄧宏魁研究組進一步將hCiPSC定向誘導分化的胰島細胞(hCiPSC-islets),并在非人靈長類動物模型中展示了hCiPSC-islets應用于1型糖尿病治療的安全性和有效性。
在解決了人多能干細胞來源和定向分化兩個難題后,關鍵瓶頸是如何高效的將多能干細胞分化的胰島細胞移植回體內、長期發揮功能。
胰島細胞移植策略
臨床常用的胰島細胞移植策略是肝門靜脈移植,移植后胰島長期定植于肝臟內。2000年,加拿大阿爾伯塔大學Shapiro團隊建立埃德蒙頓方案(Edmonton protocol),使接受胰島移植的1型糖尿病患者,完全脫離外源胰島素注射,血糖恢復至正常水平,實現了疾病的治愈。然而,肝臟門靜脈內移植也有不足,存在較高的出血和凝血風險;并且,胰島移植早期會發生瞬時血液介導的炎癥反應(IBMIR),導致胰島細胞大量死亡。同時,移植后的胰島彌散分布于肝臟中,難以追蹤觀察,且不能被移除。胰島移植,迫切需要一種更理想的移植方案。
-02-
全新胰島移植策略
2023年1月9日,北京大學鄧宏魁研究組、中國醫學科學院/北京協和醫學院彭小忠研究組合作,在Nature Metabolism期刊發表一項題為:Implantation underneath the abdominal anterior rectus sheath enables effective and functional engraftment of stem cell-derived islets 的研究論文。

本項研究:開發了一個全新的胰島移植策略,有效支持人多能干細胞分化的胰島細胞在體內存活、功能成熟以及功能長期維持。相較于傳統的胰島移植策略,該方案創傷小、操作簡便、移植物易于長期追蹤觀察;更重要的是,多能干細胞分化的胰島細胞使用該方案移植到體內,細胞功能顯著優于臨床常用的移植方案。
-03-
研究思路和內容
本研究中,研究者建立了全新的移植策略:腹直肌前鞘下移植。相較于門靜脈內移植,腹直肌前鞘下移植優勢明顯。首先,手術方案安全、易行,在B超引導下即可完成移植,移植過程無出血和凝血風險。其次,移植物被局限在腹直肌前鞘下的特定的空間,通過影像學手段可以對移植物進行監測和控制。

相較于其它腹腔外移植方案(皮下移植和肌肉內移植),腹直肌鞘下移植能夠有效支持人多能干細胞(hCiPSC)分化胰島細胞的早期細胞存活和長期功能維持。
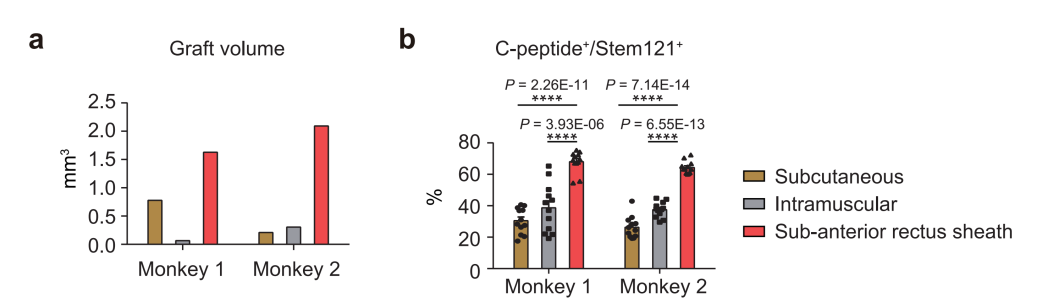
研究者將hCiPSC-islets輸注到糖尿病模型猴腹直肌前鞘下,所有接受移植的糖尿病猴的血糖控制都得到了顯著改善。
從移植后第6周開始,空腹血糖、餐前血糖以及餐后2小時血糖下降至10mM以下。移植后12周,糖化血紅蛋白(HbA1c)平均下降44%,到達健康猴水平;同時,外源胰島素輸注量下降43%。
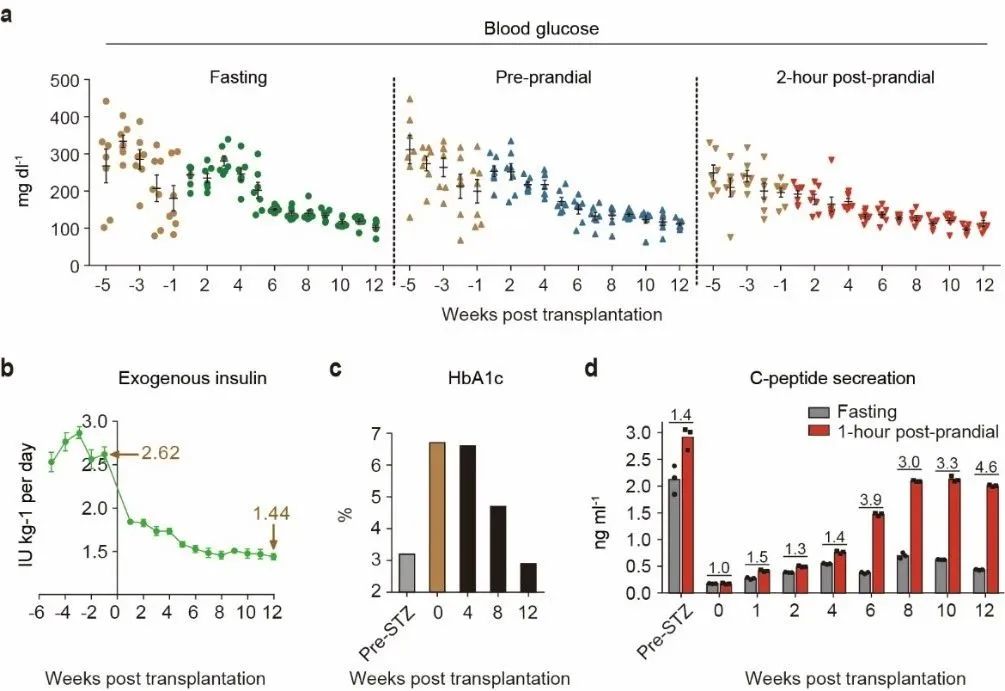
研究人員證實,hCiPSC-islets移植后,內源胰島素分泌水平大幅提升,且能夠響應血糖濃度變化;與肝臟門靜脈移植相比,新移植方案胰島素標志物(C肽)分泌水平提升5倍以上,其中一只糖尿病猴C肽分泌水平達到了健康人的水平。
結果表明,未來,在人多能干細胞分化胰島細胞臨床移植中,接受腹直肌鞘下移植有望使糖尿病患者可能完全脫離胰島素注射,實現1型糖尿病的治愈。
-04-
文末小結
綜上所述,腹直肌前鞘下移植,是一種適于人多能干細胞分化胰島的移植的全新移植策略。其操作方法簡單,移植相關不良反應少,移植后多能干細胞分化胰島細胞高效存活、在體內逐漸獲得成熟功能并長期穩定地維持其生理功能。腹直肌鞘下移植,成為未來人多能干細胞用于臨床糖尿病治療理想的移植策略。這個移植策略也可能被廣泛用于其它多種類型的細胞的移植。
同期Nature Metabolism“研究簡報(Research briefing)”對研究成果進行了評價:這項研究成果令人興奮。首先,該研究為胰島細胞移植提供了一個全新的部位,此部位便于移植且細胞容量大。其次,移植的胰島細胞在該部位存活和功能很好。此外,從臨床轉化的角度來看,研究在非人類靈長類模型上實施,意義重大。
論文審稿專家之一,糖尿病研究領域的國際著名專家 Gordon Weir 教授對本項研究予以高度評價:研究有力地證明了腹直肌前鞘下作為誘導多能干細胞(iPSC)分化的胰島細胞的移植場所的潛在價值。這個移植位點可能擴展應用到任何來源的細胞移植。在該部位的移植組織的存活率和功能令人印象深刻。
論文鏈接:https://www.nature.com/articles/s42255-022-00713-7
北京大學鄧宏魁教授、杜媛媛博士、中國醫學科學院/北京協和醫學院彭小忠教授為論文共同通訊作者。梁振博士、孫東博士和魯帥堯博士為本論文的共同第一作者。婁晉寧教授,桂林大學附屬醫院眭維國教授、羅志峰教授,天津市第一中心醫院沈中陽教授、王樹森教授,對本文作出重要貢獻。這項研究得到了國家自然科學基金、生命科學聯合中心和浙江省“領雁”計劃的支持。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加微信
掃碼添加微信