近幾年,從國家到地方,干細胞領域的政策愈加清晰地展示我國對發展生物科技以及細胞治療技術的重視,預示著我國干細胞行業在國家政策的支持下進入快速發展期。自2017年以來,中國建立了雙軌監管框架,促進了細胞治療管線的快速增長,使其成為全球第二大細胞治療管線。盡管取得了這一進展,但中國也面臨著類似的全球性挑戰。
根據有關研究人員統計,目前在中國注冊的細胞療法臨床試驗研究達到2794項,其中包括2045項免疫細胞臨床試驗、683項干細胞臨床試驗和66項其他體細胞臨床試驗。
繪制細胞療法進展圖:以便洞察中國細胞治療的臨床試驗和監管進展
為了讓廣大讀者更好的了解中國干細胞的臨床試驗和監管進展,清華大學萬科公共衛生學院聯合中國北京國家藥品監督管理局創新藥物研究與評價重點實驗室在期刊雜志《Journal of Hematology& Oncology》上發表一篇“Mapping the cell therapy landscape: insights into clinical trials and regulatory advances in China”(繪制細胞療法圖景:洞察中國干細胞的臨床試驗和監管進展)的文章。

我們的研究結果表明,盡管中國實體腫瘤的疾病負擔高且臨床需求尚未得到滿足,但2021年至2023年期間超過38%的試驗集中于血液系統惡性腫瘤,其靶點已確定為CD19和BCMA。超過90%的試驗為IIT,其臨床表現與IST有顯著差異。我們建議中國監管機構制定具體指導方針,以促進臨床價值驅動的研究。還應實施更嚴格的監管標準,以最大限度地減少重復研發。
近年來,細胞療法的研究和商業化進程明顯加快[1]。由于認識到細胞療法的復雜性和較高風險,美國、歐盟和日本建立了專門的細胞療法監管框架。截至2024年8月1日,美國、歐盟和日本分別批準了27種、13種和18種細胞治療產品(圖1)。
自2017年起,中國建立了細胞治療雙軌監管框架,明確了細胞治療的要求,促進了研究者發起試驗(IIT)和行業贊助試驗(IST)的發展[2]。因此,中國的細胞治療管線已迅速發展成為世界第二大管線。然而,在中國和全球范圍內,重復研發、靶點集群和臨床需求得不到滿足等挑戰依然存在[3]。
本研究探討了中國不斷變化的臨床試驗格局,并將其與全球趨勢進行了比較,同時強調了國際獨立臨床試驗機構與國際科技機構之間的差異,并針對未滿足的臨床需求提出了潛在的解決方案。
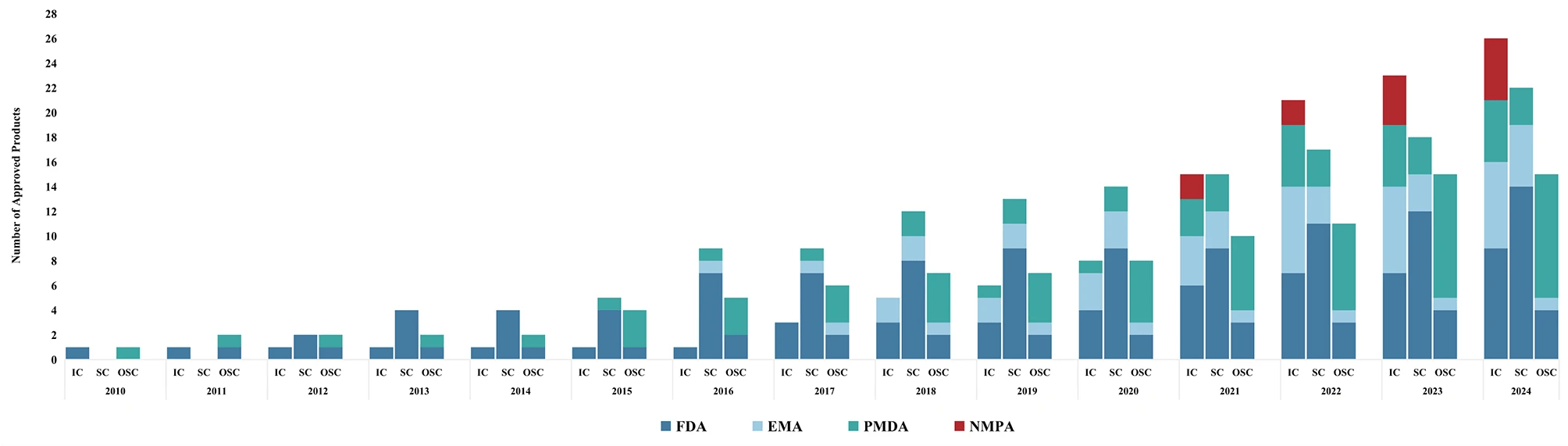
縮寫:FDA,食品藥品管理局;EMA,歐洲藥品管理局;PMDA,藥品和醫療器械管理局;NMPA,國家藥品管理局。IC,免疫細胞;SC,干細胞;OSC,其他體細胞。注:截止日期為2024年8月1日。
01中國細胞治療臨床試驗概述:類型和階段
本研究分析了2005年1月1日至2024年8月1日的細胞療法臨床試驗,分類與之前的研究一致[2, 4]。
研究涵蓋2,794項注冊試驗:免疫細胞2,045項(73.2%)、干細胞683項(24.4%)和其他體細胞66項(2.4%)。最常見的免疫細胞療法是CAR-T細胞(46.9%)。
對于干細胞,間充質干細胞(18.3%)占主導地位。其他體細胞主要包括心肌細胞(0.4%)。超過一半的試驗處于I期(40.5%)或I/II期(21.2%)(圖2a)。
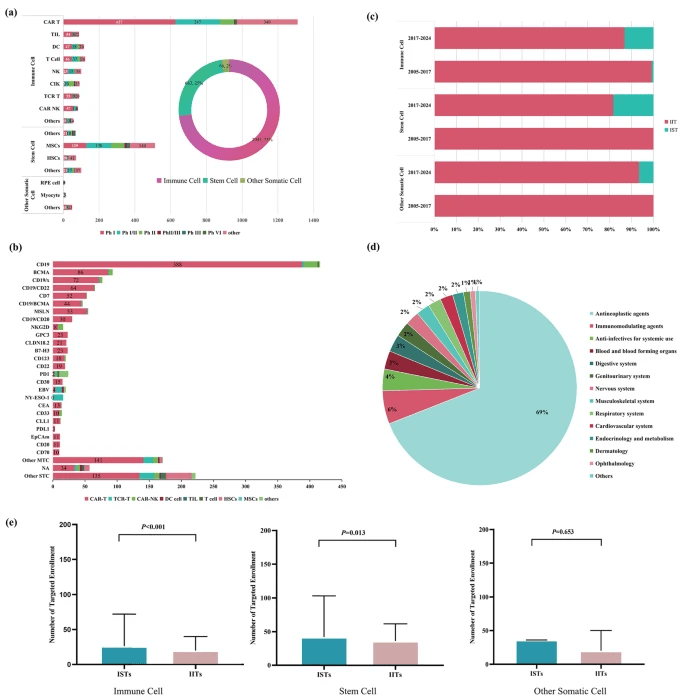
(a)2005年至2024年中國不同發展階段的各種治療類型細胞治療。
(b)2005年至2024年中國細胞治療臨床試驗的分子靶點分布。
(c)2000-2017年和2017-2024年啟動的所有三類細胞治療的IST和IIT比較。
(d)2005年至2024年細胞治療臨床試驗適應癥分布。
(e)2005年至2024年所有三類細胞治療的IIT和IST之間的目標入組人數比較。縮寫:IST,企業發起的試驗;IIT,研究者發起的試驗。注:截止日期為2024年8月1日
02中國細胞治療的適應癥和目標的特征
中國大多數細胞治療臨床試驗針對癌癥,占所有試驗的69.0%(圖2d)。從2005年到2024年,超過37.5%的試驗集中在血液系統惡性腫瘤上。
除腫瘤學外,臨床試驗越來越多地關注其他領域,包括感染(4.0%)和免疫疾病(5.5%)(圖2d)。
最突出的目標是血液系統惡性腫瘤,其中CD19領先,有416項試驗(26.7%),其中388項(93.3%)為CAR-T(圖2b和d)。值得注意的是,在2021年至2023年期間,針對實體瘤中不太常見的靶點(如CLDN18.2、HER2 MSLN)的試驗有所增加。
03研究者發起試驗(IIT)和行業贊助試驗(IST)的特點
截至2024年8月1日,IIT (n=2,519, 90.2%) 遠遠超過IST (n=275, 9.8%)。
自2017年國家藥品監督管理局 (NMPA) 指南明確了細胞治療產品的監管要求以來,干細胞和體細胞治療中的IST從零顯著增加。
在免疫細胞治療中,IST的目標入組人數通常高于IIT (26vs20,P<0.001)。干細胞在IIT中的目標入組人數多于IST (36vs27,P=0.013),體細胞沒有顯著差異(圖2)。
04前景
細胞技術的進步使細胞治療產品多樣化[5]。目前,全球已有9種實體瘤產品獲批;但在中國,盡管實體瘤占癌癥病例的90%以上[6],但獲批產品的范圍仍然有限且相對同質化。為了滿足尚未滿足的臨床需求,我們建議國家藥品監督管理局制定具體指導原則,促進臨床價值驅動的研究[7]。
中國有限的研發資源阻礙了細胞治療試驗中新靶點的探索,導致了重復研發和靶點聚集。雖然全球試驗都在研究像CLDN18(+400%)和KRAS(+125%)這樣的新靶點,但中國的試驗仍然集中于已建立的靶點,超過38.0%的試驗針對CD19和BCMA,而全球這一比例為36.2%。3這種趨勢意味著中國更傾向于選擇已證實的靶點以降低成本并縮短開發周期。FDA最近發布了關于CAR-T細胞療法的指導意見,鼓勵同時開發伴隨診斷工具以提高試驗準確性[8]。
因此,我們建議制定更嚴格的監管標準,以最大限度地減少重復研發。此外,由于特定的細胞治療適應癥已被納入中國的報銷清單,建立基于價值的報銷制度有助于降低同類靶向細胞治療產品的成本并減少市場聚集[9,10]。
IIT在試驗設計方面提供了更大的靈活性,并生成了大量早期探索性數據。盡管NMPA自2017年以來的指導方針允許IIT數據支持IND申請,但研究質量和細胞生產管理方面仍然存在挑戰[11]。
我們建議NMPA明確使用IIT數據進行IND申請的監管和技術要求,以建立一條加速細胞治療研究和滿足未滿足臨床需求的新途徑。
主要參考文獻:Du, X., Luo, X., Liu, L. et al. Mapping the cell therapy landscape: insights into clinical trials and regulatory advances in China. J Hematol Oncol 17, 96 (2024). https://doi.org/10.1186/s13045-024-01616-8
1、Yu JX, Upadhaya S, Tatake R, Barkalow F, Hubbard-Lucey VM. Cancer cell therapies: the clinical trial landscape. Nat Rev Drug Discov. 2020;19:583–4.
2、Yin C, Gao J, Li G, Hu H, Zhou L, Lu S, Chen X. Gene and cell therapies in China: booming landscape under dual-track regulation. J Hematol Oncol. 2022;15(1):139.
3、Saez-Iba?ez AR, Upadhaya S, Partridge T, Winkelman D, Correa D, Campbell J. The changing landscape of cancer cell therapies: clinical trials and real-world data. Nat Rev Drug Discov. 2024 May 31.
4、El-Kadiry AE, Rafei M, Shammaa R. Cell therapy: types, regulation, and clinical benefits. Front Med (Lausanne). 2021;8:756029.
5、Chen Z, Zhong H, Hu HX, Kong FP, Liang WN, Li GQ. Chinese innovative drug R&D trends in 2024. Nat Rev Drug Discov. 2024. https://doi.org/10.1038/d41573-024-00120-5.
6、Han B, Zheng R, Zeng H, Wang S, Sun K, Chen R, Li L, Wei W, He J. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 2024;4(1):47–53.
7、China Center for Drug Evaluation, National Medical Products Administration. Guiding Principles for Clinical Research and Development of Anti-tumor Drugs Guided by Clinical
Value.https://www.cde.org.cn/main/news/viewInfoCommon/ef7bfde96c769308ad080bb7ab2f538e (2021). Accessed September 5, 2024 (in Chinese).
8、U.S. Food and Drug Administration. Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2021). Accessed September 5, 2024.
9、Beaver JA, Pazdur R. The wild west of checkpoint inhibitor development. N Engl J Med. 2022;386(14):1297–301.
10、Luo X, Du X, Huang L, Guo Q, Tan R, Zhou Y, Li Z, Xue X, Li T, Le K, Qian F, Chow SC, Yang Y. The price, efficacy, and safety of within-class targeted anticancer medicines between domestic and imported drugs in China: a comparative analysis. Lancet Reg Health West Pac. 2022;32:100670.
11、China Center for Drug Evaluation, National Medical Products Administration. Guidelines for clinical trials of human stem cells and derived cell therapy products (for Trial Implementation). https://www.cde.org.cn/main/news/viewInfoCommon/f82a0fee1e625a1a3834a93cee3836c7 (2023). Accessed 5 Sept 2024 (in Chinese).
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信