銀屑病是一種由先天性和適應性免疫系統介導的慢性炎癥性疾病,其發病機制涉及多個方面,包括白細胞介素 (IL)-23–Th17軸異常、Treg等免疫細胞功能障礙以及角質形成細胞與血管內皮之間的復雜關系。銀屑病皮膚中間充質干細胞的功能障礙也可能是導致炎癥反應失調的主要原因。間充質干細胞是一類具有多分化潛能的成體干細胞,參與調控銀屑病發病機制中的多個環節和靶點。因此,深入探索這些機制可能有助于開發新的銀屑病治療策略。
廣州中醫藥大學第二臨床學院:間充質干細胞如何成為銀屑病治療的“多面手”?
近日,廣州中醫藥大學第二臨床學院/廣州中醫藥大學第二附屬醫院/廣東省中醫院/廣東省中醫科學院聯合廣東省中醫院國家干細胞臨床研究中心等研究機構(以下簡稱我們)在期刊雜志“Biomolecules”發表了一篇“Multimodal Function of Mesenchymal Stem Cells in Psoriasis Treatment”(間充質干細胞在牛皮癬治療中的多模式功能)的文章[1]。

該文章主要就間充質干細胞在皮膚穩態中的作用、銀屑病的發病機制以及間充質干細胞在銀屑病治療中的多模態作用進行綜述。
銀屑病的簡介
銀屑病是一種由先天性和適應性免疫系統異常介導的慢性全身性炎癥性皮膚病,以炎性細胞浸潤、表皮增生和異常角化為特征,全球累及超過6000萬患者,患病率存在地域差異。
其臨床表現為皮膚紅斑、脫屑及丘疹,好發于面部、四肢和軀干,并常合并銀屑病關節炎、代謝綜合征、心血管疾病等系統性病變。該疾病不僅導致軀體損害,還顯著增加抑郁癥及自殺風險,嚴重影響患者心理健康。

銀屑病發病機制的主要方面
銀屑病的發病機制尚未完全闡明,其誘因可能涉及感染、創傷、應激事件等,但部分患者無明顯誘因。一旦疾病觸發,大量免疫細胞(尤其是T細胞)向真皮及表皮募集,形成特征性銀屑病斑塊。
具體來說,表皮被大量活化的T細胞浸潤,這些T細胞似乎能夠誘導角質形成細胞增殖。
免疫細胞與角質形成細胞的相互作用
而角質形成細胞在銀屑病的起始和維持階段都發揮著至關重要的作用(圖1)。表皮中浸潤的活化T細胞(如Th17細胞)通過分泌IL-17、IFN-γ等細胞因子,直接刺激角質形成細胞異常增殖。而角質形成細胞不僅是炎癥的靶細胞,更是免疫反應的主動參與者。
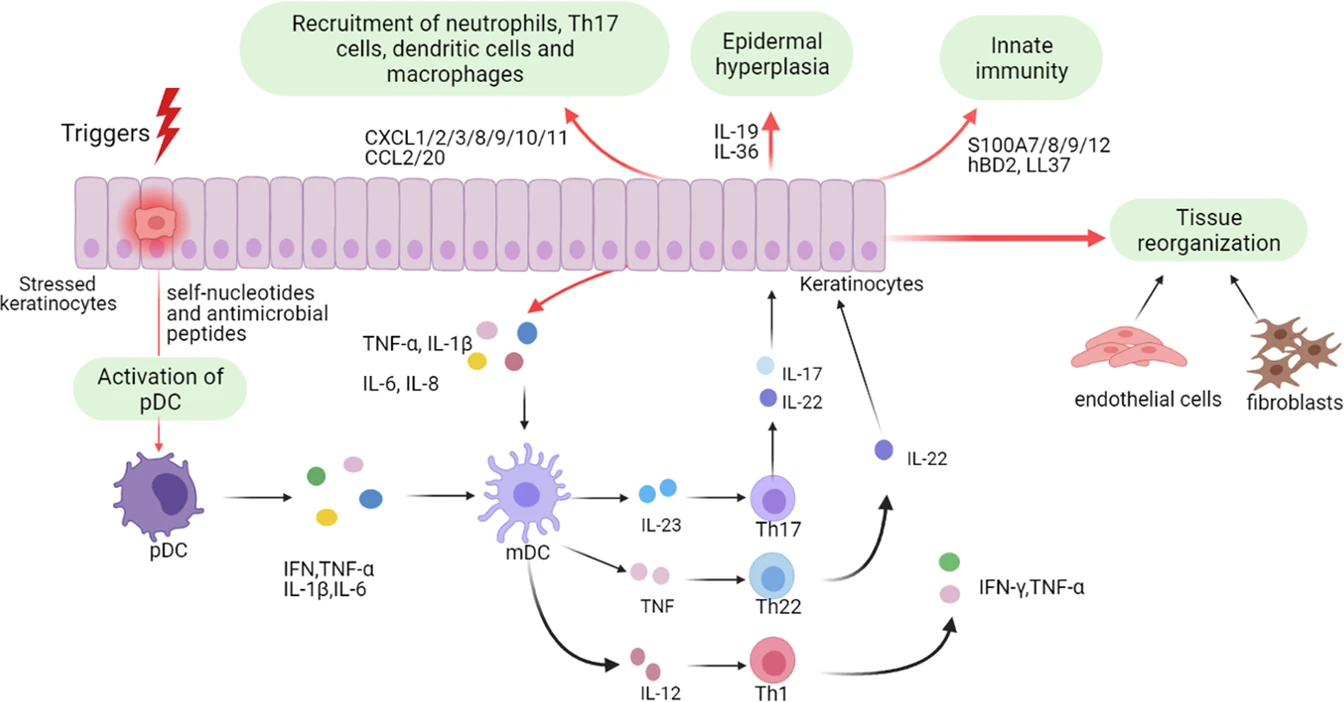
該圖主要從角質形成細胞的角度描繪了銀屑病的病理過程。角質形成細胞可受到初始觸發因素的刺激,應激的角質形成細胞釋放自身核苷酸和抗菌肽,激活漿細胞樹突狀細胞(pDC)以及隨后的髓系樹突狀細胞(mDC),參與銀屑病的起始階段。在細胞因子刺激后,活化的角質形成細胞從炎癥浸潤、表皮增生、先天免疫、組織重組等方面影響銀屑病的病理。
作為先天免疫的關鍵組分,角質形成細胞可響應外界刺激(如損傷、病原體),釋放自身核苷酸(如DNA/RNA)和抗菌肽(如LL37、S100A家族),激活漿細胞樣樹突狀細胞(pDC)。pDC分泌的IFN-α進一步促進 髓系樹突狀細胞(mDC) 成熟,后者釋放IL-23、TNF-α,驅動Th17細胞分化并形成 IL-23/Th17軸這一核心炎癥通路。
炎癥放大與組織重構
在炎癥維持階段,角質形成細胞被促炎因子(如IL-17、TNF-α)激活后,通過以下途徑放大病理進程:
- 分泌趨化因子(CXCL1/8/10、CCL20)招募中性粒細胞、Th17細胞等;
- 釋放抗菌肽(S100A7/8/9、hBD2)激活先天免疫;
- 與成纖維細胞、內皮細胞相互作用,促進血管增生及細胞外基質沉積,導致真皮增厚和紅斑形成。
組織學證據與細胞因子級聯
銀屑病斑塊的組織學特征包括表皮過度增生、角化不全及炎性細胞浸潤。免疫組化顯示,皮損內T細胞數量顯著升高(例如:體表面積20%受累的患者,斑塊內T細胞可達約200億個)。活化的免疫細胞與角質形成細胞通過 JAK-STAT和NF-κB等信號通路持續交互,導致促炎因子(TNF-α、IL-17、IL-23)大量釋放,形成惡性循環。其中,TNF-α水平升高與疾病活動度密切相關,而IL-17可直接誘導角質形成細胞增殖分化異常,形成銀屑病典型的銀白色鱗屑。
目前治療銀屑病的方式及創新療法
目前銀屑病的治療方法包括局部用藥、紫外線(UV)療法(用于中度銀屑病)、全身用藥(例如,甲氨蝶呤和環孢素)以及用于更嚴重銀屑病的生物制劑。大多數治療方法通過干預銀屑病發病機制的某個環節(單一靶點)發揮治療作用。
例如,維生素D3衍生物通過與維生素D3受體結合抑制角質形成細胞增殖,甲氨蝶呤在表皮細胞增殖時阻止DNA合成。雖然目前通過生物制劑治療IL-17和IL-23細胞因子的免疫靶向治療顯示出顯著的療效,但這種療效不足,并且該治療在個體中缺乏臨床反應,并且無法阻止銀屑病的復發。此外,長期使用生物制劑可能導致不良事件,這是銀屑病常規治療中需要克服的關鍵問題。
總而言之,傳統療法和上述先進的生物制劑只能抑制致病免疫細胞的活性,但無法清除這些異常細胞。因此,在停止治療后,這些致病免疫細胞會被重新激活并引起炎癥病變,導致疾病復發。更有效的治療方案仍然是一個未滿足的醫療需求。
間充質干細胞的免疫調節機制為治療銀屑病提供新方向
間充質干細胞(MSC)作為具有多向分化潛能的成體干細胞,可從骨髓、脂肪、臍帶等組織中獲取,其免疫調節功能為銀屑病治療提供了新方向。研究顯示,MSC通過抑制T細胞過度活化、阻礙樹突狀細胞成熟及減少促炎因子分泌,多維度干預銀屑病病理進程。
基于團隊基礎研究及首例臨床試驗(NCT34988162),本綜述系統探討銀屑病分層發病機制、MSC在皮膚穩態中的多維調控作用、靶向治療的多模式機制,以及MSC療法的優勢與前景,旨在闡明其在銀屑病等復雜疾病中的治療潛力。
間充質干細胞在皮膚穩態和銀屑病發展中的多作用功能
間充質干細胞在皮膚穩態中的重要作用
作為具有自我更新及多向分化潛能的成體干細胞,MSCs通過細胞間接觸、旁分泌/自分泌機制及分化能力動態調節皮膚微環境,具體表現為:
- 組織修復:在損傷部位分化為皮膚細胞,促進再生與發育;
- 免疫平衡:抑制Th1/Th17分化、促進Treg擴增,調節B細胞、NK細胞活性,誘導巨噬細胞向抗炎M2型極化,并調控樹突狀細胞(DC)亞群功能(如抑制I型DC分泌TNF-α、促進II型DC釋放IL-10);
- 血管穩態:通過分泌黏附分子及趨化因子(如IL-6、IL-8、GM-CSF)維持血管穩定性并促進新生血管形成;
- 角質形成細胞(KC)調控:直接或間接誘導KC增殖,參與表皮屏障重建。這些功能協同維持細胞因子網絡平衡,是皮膚免疫防御、代謝調節及損傷修復的核心樞紐(圖2)。
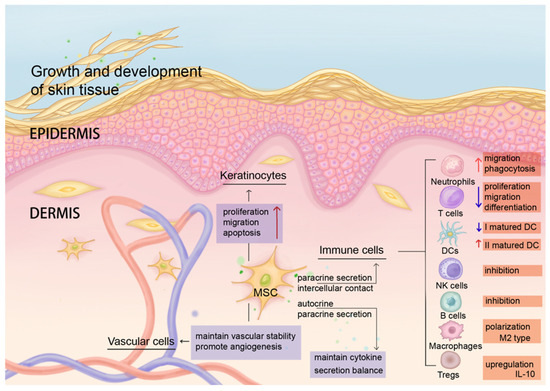
正常情況下,駐留在人體真皮內的MSCs通過細胞間接觸和旁分泌維持皮膚穩態。MSCs通過調節免疫細胞的遷移、分化、抑制、細胞因子表達、吞噬等功能(紅色箭頭表示功能上調,紫色箭頭表示功能下調)。MSCs還影響角質形成細胞的增殖、遷移和凋亡,維持血管穩定性,促進血管生成。
銀屑病皮膚病變中駐留間充質干細胞的病理變化
銀屑病中駐留的MSCs發生異常改變,包括自身表面分子表達水平改變或細胞因子異常分泌,促進角質形成細胞增殖能力受限及凋亡,以及免疫調節能力改變,如抑制T細胞增殖和促炎因子表達,促進抗炎因子分泌、炎癥及血管生成,抗氧化等,破壞了銀屑病患者皮膚內環境的平衡(圖3)。然而,駐留的MSCs究竟是銀屑病的受害者,還是其最初的病因,值得探究。

在銀屑病中,MSC的表型和功能隨著病情進展而發生顯著改變,導致皮膚穩態紊亂。病理性MSC的分泌功能發生改變,維持角質形成細胞增殖和凋亡平衡的能力下降。
銀屑病角質形成細胞的異常相互作用
駐留MSCs通過分泌生長因子、趨化因子(如干細胞因子、表皮生長因子)及調控PI3K-AKT信號通路,直接增強角質形成細胞增殖并抑制其凋亡。同時,銀屑病角質形成細胞代謝重編程(糖酵解和線粒體代謝增強)可反向刺激真皮MSC增殖。此外,MSCs誘導角質形成細胞表達補體成分C3,進一步放大炎癥級聯反應。二者的異常相互作用形成惡性循環,推動皮損進展。
免疫調節功能失調
銀屑病患者MSCs免疫調節能力顯著下降:例如,抑制T細胞增殖的功能減弱,促炎因子(如TNF-α)分泌增多,抗炎因子(如IL-10)減少。其ROR-γt和T-bet表達降低,抑制Th17分化并破壞Th17/Treg平衡。同時,促炎miR-155上調,而免疫調控相關基因(PGE2、TLR4)下調,導致局部T細胞浸潤增多和炎癥持續惡化。
促血管生成與炎癥介質增加
銀屑病的特征性改變之一是明顯的真皮血管擴張,血管內皮生長因子在刺激血管生成和銀屑病發病機制中起重要作用。銀屑病患者真皮來源的MSCs具有異常的增殖能力、促炎和促血管生成潛能,這可能參與了銀屑病的早期發展。銀屑病患者與正常健康人真皮MSCs的比較結果顯示,銀屑病患者MSCs促炎及血管生成相關介質表達增多,如脂多糖(LPS)誘導的TNFα、轉錄因子(LITAF)、血管內皮生長因子,此外,TGF-β、血管生成素基因等血管生成基因表達增多。
在銀屑病炎癥反應中發揮重要作用的促炎因子miR-155的表達也顯著增多。此外,促炎表型相關因子表達增強和糖代謝異常導致銀屑病患者局部血管異常。
抗氧化能力缺陷
銀屑病MSCs的抗氧化功能受損:皮損中iNOS含量升高,抑制其清除活性氧的能力;動物模型顯示,MSCs利用超氧化物歧化酶的能力降低,導致氧化應激累積。這種抗氧化缺陷進一步加重炎癥和細胞損傷,形成銀屑病慢性遷延的病理基礎。
間充質干細胞(MSCs)治療銀屑病的作用及臨床研究進展
MSCs通過細胞間接觸、旁分泌/自分泌信號及分化潛能,靶向調控銀屑病發病的多個環節(如免疫失衡、角質形成細胞異常增殖及血管增生),其多靶點協同效應顯著優于傳統單一療法,可延長緩解期并減少復發。
然而,MSCs具有高度異質性,不同組織來源(骨髓BM-MSCs、臍帶UC-MSCs、脂肪AD-MSCs等)的生物學特性差異顯著:例如,AD-MSCs對T、B、NK細胞的抑制能力更強,而BM/UC-MSCs更傾向于促進Treg和Th1細胞極化。其免疫調節功能通過調控T細胞、B細胞、巨噬細胞、樹突狀細胞及中性粒細胞等實現。
基于此,臨床前及臨床研究(表1、表2)已系統評估不同來源MSCs的療效差異,為個體化治療策略提供依據。
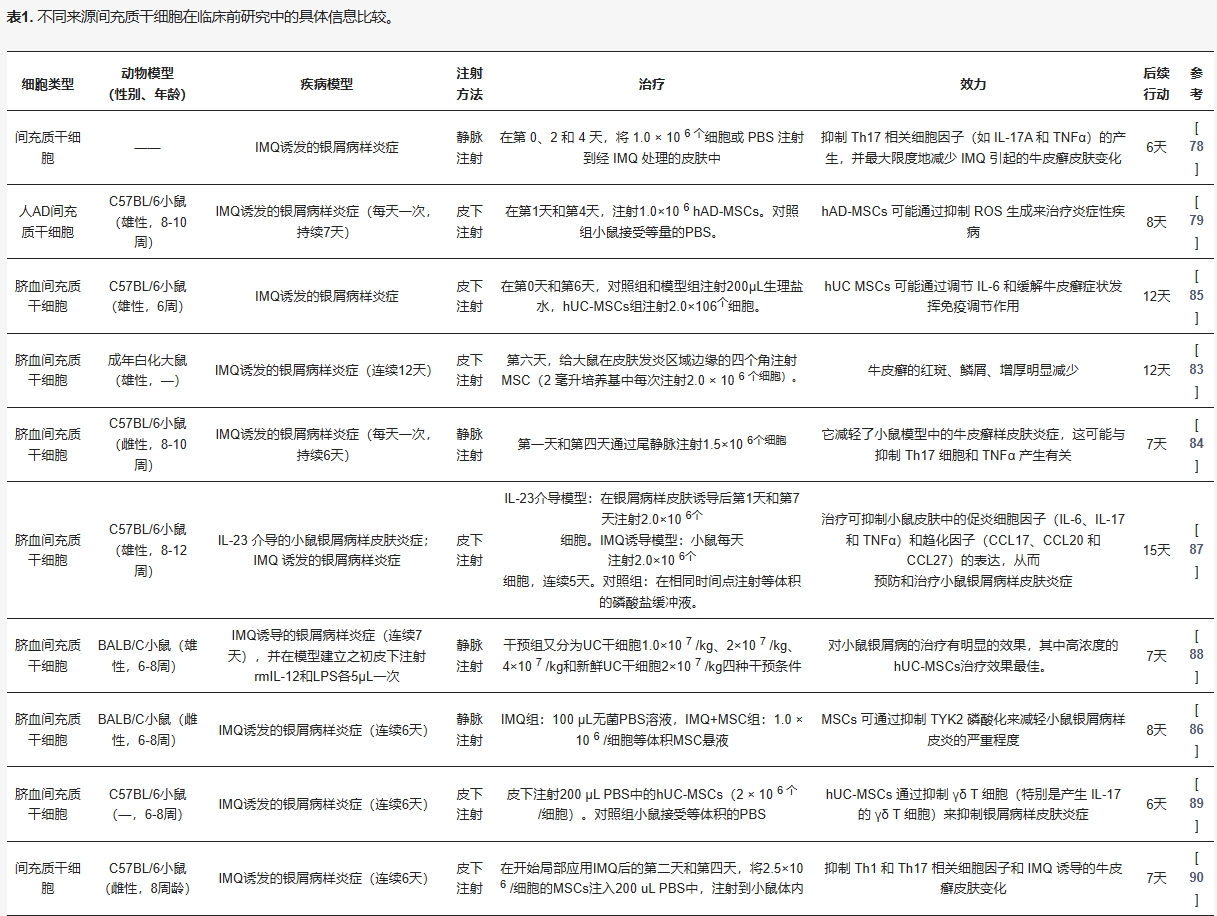

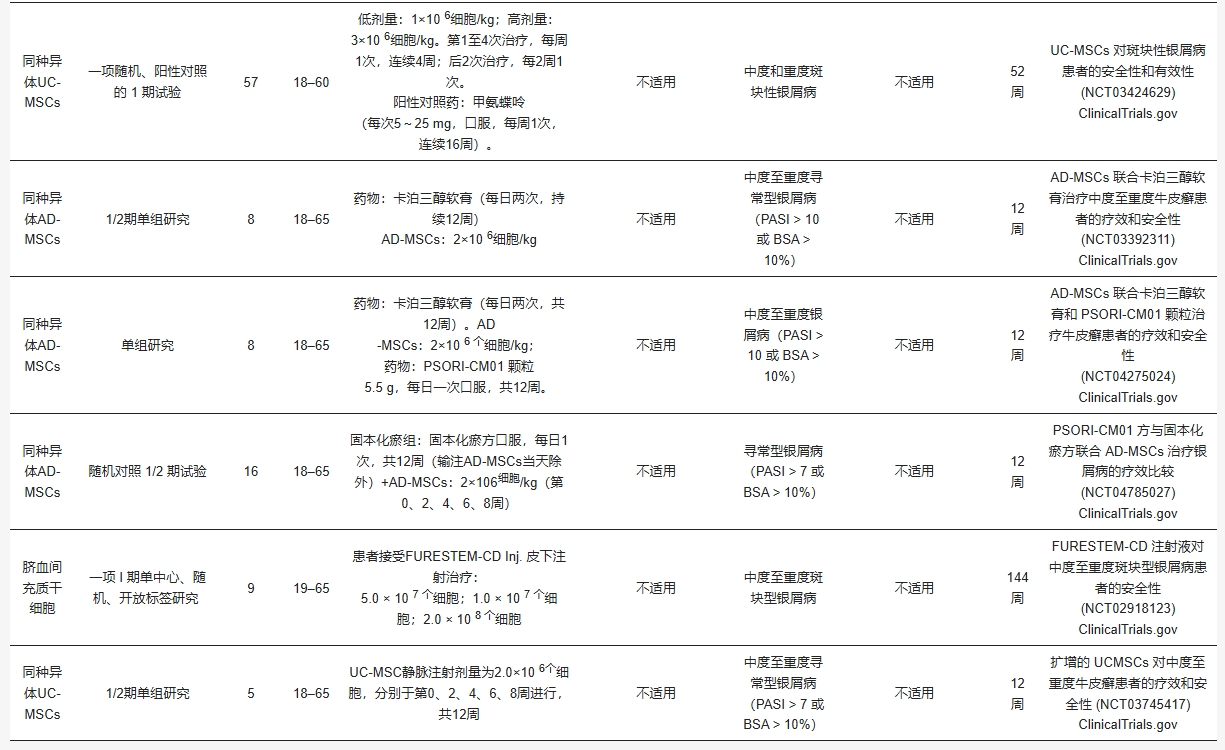
脂肪來源的間充質干細胞治療銀屑病的臨床研究
AD-MSCs治療銀屑病不僅安全、療效持久,而且在延緩銀屑病復發方面也顯示出卓越的潛力。
2016年,De Jesus等人在一項“自體脂肪來源的間充質基質細胞治療尋常型銀屑病和銀屑病關節炎”報告稱,兩例尋常型銀屑病患者在接受AD-MSCs治療后紅斑鱗屑得到改善,PASI-50維持了9.7個月。

2021年,我們是第一個報告AD-MSCs輸注治療中度至重度銀屑病患者的臨床試驗結果的機構。我們的數據表明,七名入選患者中有四名完成了試驗,兩名完成了1年的隨訪,在1年未治療后達到并維持了PASI-50。即使在隨訪期間,一名患者也維持了近3年的PAS評分提高了50%。

人臍帶間充質干細胞(hUC-MSCs)治療銀屑病的臨床研究
2016年,中國北京軍事醫學科學院附屬醫院造血干細胞移植科報道了兩例尋常型銀屑病患者在接受臍帶MSC治療后,PASI維持4-5年。
2021年,Ahn H等報道了一名47歲的患者,該患者接受了25年的銀屑病常規治療,但癥狀無明顯改善。患者在2周內接受三輪最小二乘MSCs靜脈移植和局部移植后,紅斑逐漸消失。第一輪治療三個月后,PASI評分從9.9降至1.7,DLQI評分從27降至3,生活質量明顯改善。銀屑病也沒有復發。此外,尚無不良反應或副作用的報告。

牙齦間充質干細胞(GMSC)治療銀屑病的臨床研究
2020年,Wang SG等人在“皮膚病醫學病例報告主頁”報道了一篇“同種異體牙齦間充質干細胞成功治療斑塊性銀屑病:案例研究”的文章。

一名患者患有嚴重斑塊性銀屑病,在多次局部和全身治療后仍持續存在5年。患者連續兩周接受同種異體GMSC輸注(3×106/kg),皮疹斑塊逐漸消退。五周后,患者再次接受每三周一次的MSC輸注,最后一次輸注后一周,銀屑病皮損完全消失。此外,患者隨訪3年,未見復發。
基于間充質干細胞治療銀屑病的總結與展望
基礎及臨床研究(表1、表2)表明,不同來源MSCs(如臍帶、骨髓)通過抗炎、免疫調節等機制有效控制銀屑病進展,其中臍帶來源MSCs可維持4-5年PASI-50緩解率,且安全性良好。
MSCs的治療潛力與安全性爭議
間充質干細胞(MSCs)憑借其多向分化、免疫調節及抗炎特性,為銀屑病這一慢性全身性炎癥疾病提供了多維度治療策略。現有研究表明,MSCs通過靶向調控免疫失衡、角質形成細胞異常增殖及血管生成等關鍵環節,展現出顯著的臨床潛力,且多數臨床試驗報告安全性良好,未發現腫瘤相關不良事件。
未來研究方向與技術突破
深化MSCs作用機制研究是未來的核心任務:需開發新型示蹤技術解析MSCs體內分布、代謝及作用時效,結合多組學技術挖掘其在銀屑病中的新靶點(如特定樹突狀細胞亞群調控)。同時,優化MSCs來源選擇、給藥方案(劑量、頻率)及功能強化策略(如工程化修飾),以提升療效精準性。基礎研究需突破現有小鼠模型的局限性,探索更貼近人類疾病特征的實驗體系,為臨床轉化夯實理論根基。
臨床試驗優化與安全性驗證
然而,當前MSCs治療銀屑病的臨床研究面臨樣本量小、隨訪期短、缺乏隨機對照等局限。未來需開展大規模、多中心、雙盲隨機對照試驗,嚴格評估長期療效及安全性,尤其是腫瘤發生風險的終身隨訪。
此外,應建立標準化治療指南,整合單細胞測序、生物標志物檢測等前沿技術,實現個體化精準治療。唯有通過嚴謹的科學設計與跨學科協作,方能推動MSCs從潛力療法轉化為銀屑病臨床實踐的安全支柱。
主要參考資料:
[1]Ou, J.; Li, Z.; Yao, D.; Lu, C.; Zeng, X. Multimodal Function of Mesenchymal Stem Cells in Psoriasis Treatment. Biomolecules 2025, 15, 737. https://doi.org/10.3390/biom15050737
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信