糖尿病腎病的流行病學
據估計,2019年全球20-79歲成年人糖尿病(DM)患病率為9.3%(4.63億),到2030年將上升至 10.2%(5.78億),到2045年將上升至10.9%(7億)。城市地區(10.8%)的患病率高于農村地區(7.2%),高收入國家(10.4%)的患病率高于低收入國家(4.0%)。重要的是,二分之一 (50.1%) 的糖尿病患者不知道自己患有糖尿病。因此,全世界有近5億人患有糖尿病,預計到2030年這一數字將增加 25%,到2045年將增加51%。同樣,全球糖耐量受損的患病率估計為7.5%(3.74億)預計到2030年將達到8.0%(4.54億),到2045年將達到8.6%(5.48億)。
國際糖尿病聯盟利用WHO(世界衛生組織)數據庫記錄,20-79歲成年人的全因死亡中有8.4%歸因于糖尿病,即近510萬人死亡。將相對風險調整20%的敏感性分析發現,糖尿病所致死亡率的估計值介于總死亡率的5.1%(330萬人死亡)和總死亡率的10.1%(660萬人死亡)之間。總體而言,估計全球每12名成人全因死亡中就有1名是由糖尿病引起的。
糖尿病腎病 (DKD) 是糖尿病的微血管并發癥,也是終末期腎病 (ESKD) 的最常見原因,約30%的患者患有 1型糖尿病 (DM1),約40%的患者患有2型糖尿病DM (DM2) 發展為DKD,如其他文獻所述。DKD是導致糖尿病患者心血管并發癥和高死亡率的原因。在美國,CKD1-5期(不包括 ESKD)未經調整的患病率估計為 14.8%(2011年至2014年),其中3期是最常見的階段。ESKD新病例每年增加1.1%,活躍等待名單是可供供腎數量的2.8倍。
糖尿病腎病的病理生理學
DKD的自然史包括過度濾過、進行性蛋白尿、eGFR(估計腎小球濾過率)下降,以及最終的ESRD。然而,蛋白尿是一個連續體;eGFR惡化可能會在進展為明顯腎病之前開始下降,這可以用其他危險因素來解釋,例如肥胖、高甘油三酯血癥、高血壓和腎小球高濾過。因此,蛋白尿和eGFR可以預測患有DKD的DM1和DM2個體腎損害的進展。
DKD的分類總結如下:
- 1期(腎病前期):正常白蛋白尿(<30g/gCr)且eGFR≥30ml/min/1.73m2,
- 2期(早期腎病):微量白蛋白尿( 30-299g/gCr) 和eGFR≥30
ml/min/1.73m2,
- 第3階段(明顯蛋白尿):大量白蛋白尿 (≥300g/gCr) 或持續性蛋白尿 (≥0.5) 且eGFR≥30?ml/min/1.73
m2,
- 階段4期(腎衰竭):任何蛋白尿狀態且 eGFR<30ml/min/1.73m2,
- 5期(腎臟替代治療):任何持續透析治療的狀態。
在組織學上,與DM相關的代謝變化導致腎小球肥大、腎小球硬化、小動脈透明變性、動脈硬化、腎小管間質炎癥和纖維化。主要的腎小球變化包括腎小球基底膜(GBM)增厚、系膜基質擴張、足細胞蒂萎縮和消失以及彌漫性或結節性毛細血管間腎小球硬化。
代謝失調(高血糖、高脂血癥、胰島素抵抗和β細胞功能障礙)和血流動力學變化(全身性高血壓)導致的全身炎癥環境是DKD病理生理學的特征。此外,DKD與內皮功能障礙有關。總的來說,所有這些機制都會導致DKD進展,并導致功能性(eGFR和蛋白尿下降)和結構性(成纖維細胞積累、系膜細胞擴張和增殖、細胞外基質積累、GBM 增厚、足細胞喪失/功能障礙、腎小管間質功能障礙和內皮細胞功能障礙)。功能障礙)腎臟損害,最終導致全身并發癥(ESKD、心腦血管事件、血管事件、神經病變和死亡)。
治療糖尿病腎病的方法
由于糖尿病在全球范圍內普遍存在,因此在每一步制定具有成本效益的策略至關重要:
- (1) 預防肥胖,
- (2) 在高危人群中篩查和預防糖尿病,
- (3) 糖尿病發生后的血糖控制,
- (4) 一旦發生高血壓,控制血壓 (BP),
- (5) 篩查糖尿病慢性腎病 (CKD),
- (6) 糖尿病CKD患者的RAAS抑制/阻斷,以及
- (7) 控制其他心血管疾病 (CV) ) 危險因素,例如低密度脂蛋白膽固醇 (LDL-C) 的管理。
盡管糖尿病患者接受血管緊張素受體阻滯劑(ARB)治療,但兩年內腎臟疾病進展風險隨著蛋白尿和白蛋白尿的增加以及eGFR的降低而增加。值得注意的是,RAAS抑制在腎臟疾病的早期階段具有顯著的腎臟保護作用,而在晚期階段,該方法的療效較差。然而,ARB和血管緊張素轉換酶 (ACE) 抑制劑的組合是阻斷 RAAS 的有效方法。它與急性腎損傷和高鉀血癥等不良事件風險增加有關。
最近,新藥與臨床獲益相關,在治療DM2患者的決策過程中應考慮這一點。胰高血糖素樣肽1受體激動劑 (GLP1-RA) 和鈉-葡萄糖協同轉運蛋白2抑制劑 (SGLT2i) 可在已確診的動脈粥樣硬化 CV 疾病患者中將動脈粥樣硬化主要不良心血管 (CV) 事件減少至相似程度,而SGLT2i的效果更顯著。對預防心力衰竭住院和DKD進展的作用。
在藥物和生活方式改變的糖尿病腎病的治療環境中,還需要新的方法來阻止糖尿病腎病的進展或再生受損的組織,例如細胞療法。在這篇綜述中,我們將重點關注使用同基因、自體、同種異體或異種間充質干細胞 (MSC) 治療 DKD的體外和體內研究。我們將描述基于MSC的療法在臨床前和臨床研究中的主要發現,并討論該療法在阻止DKD進展方面的益處、結果和挑戰。
自體間充質干細胞治療糖尿病腎病的進展:優點和缺點
BM-MSCs是自體細胞移植治療多種疾病的主要來源,包括DM相關的微血管和大血管并發癥。
優點:自體間充質干細胞的治療引起了極大的興趣,并且對患者來說具有優勢,因為這些細胞很容易獲得。基于間充質干細胞的治療是從患者體內提取這些細胞,在體外擴增,然后注射回患者體內,從而避免因移植排斥和/或需要免疫抑制方案而引起的并發癥。因此,雖然就避免不必要的免疫反應而言,患者來源的(自體)間充質干細胞可能是更安全的選擇,但供者自身的(糖尿病、慢性腎病、高血壓等)和衰老在內的因素可能會阻止這些細胞的使用。
缺點:盡管最近MSC治療在多種疾病中取得了有希望的結果,但應通過尋找高血糖環境引起的內在MSC異常來嚴格評估將這一概念推向DKD,這可能會對糖尿病患者的治療潛力產生不利影響。因此,從糖尿病個體中提取的AT-MSC具有較大的脂肪形成分化能力,但軟骨形成和成骨分化能力較低。
相反,來自糖尿病個體的BM-MSC保留了其多能能力。因此,間充質干細胞的來源可能在治療糖尿病個體的決策中發揮關鍵作用。從表型和功能上與沒有肢體缺血跡象的對照非糖尿病患者相比,從糖尿病患者缺血肢體中分離出的AT-MSC的效力似乎較差。
不僅MSCs的來源,DM的類型也可能影響MSCs的治療潛力。從DM1個體中提取的MSC表現出保留的形態、生長動力學、多能性以及增殖、免疫調節、免疫抑制和遷移能力。
相比之下,從患有DM2的個體中提取的MSC具有更嚴重的衰老、更低的活力、更高的凋亡(促凋亡基因表達增加,如p53、caspase9和BAX,以及低抗凋亡基因表達,如Bcl-2)、增殖潛力較低與倍增時間增加和血管生成潛力降低有關。
總之,盡管基于自體間充質干細胞的療法已被報道可以改善腎損傷,但要成功實施該療法治療DKD還必須克服許多困難。關鍵方面包括糖尿病的類型、由于細胞代謝記憶而診斷后經過的時間以及可能損害間充質干細胞功能特性的細胞來源。
臨床研究
我們以 “間充質干細胞 “或 “間充質基質細胞 “和 “糖尿病 “為關鍵詞查詢了臨床試驗門戶網站(clinicaltrials.gov,2020年1月訪問)。我們將納入標準定義為已在PubMed上報告結果的已完成研究。這些研究主要是單中心前瞻性I/II期臨床試驗,評估了安全性和耐受性,探討了間充質干細胞對β細胞再生的治療效果,以及對空腹血漿葡萄糖(FBG)、HbA1c、內源性胰島素和C肽增量的影響,并探討了每日胰島素需求量減少≥50%的療效水平。
一項劑量遞增(0.3×106/kg、1.0×106/kg或2.0×106/kg)隨機對照試驗評估了在無DKD的DM2患者中靜脈輸注一次MPCs(rexlemestrocel-L)的安全性和有效性。在接受最高劑量治療的患者中,8周后HbA1c顯著下降,33%的患者達到了HbA1c<7%的臨床目標。
值得注意的是,只有一項多中心研究也包括了DKD患者。在這項隨機(1:1:1)、雙盲、連續、劑量遞增(150×106或300×106,單次靜脈注射劑量)、多中心和安慰劑對照試驗中,對患有DKD的2型糖尿病患者(eGFR20-50毫升/分鐘/1.73平方米)進行了成人異體生化細胞(MPCs,rexlemestrocel-L)的安全性和有效性評估。
在安全性方面,沒有患者出現與治療相關的嚴重不良事件,只有一名患者在第4周出現了供體HLA特異性抗體,但在第12周時檢測不到。主要的探索性療效參數包括eGFR,因此第12周時,150×106組和300×106 組經安慰劑調整后的eGFR最小平方均值變化分別為4.4±2.2(p=0.05)和1.6±2.2ml/min/1.73m2(p=0.47)。與安慰劑相比,rexlemestrocel-L150×106組的eGFR趨于穩定,尤其是在12周的主要終點。
重要的是,在進行亞組分析時(GFR≤30或>30ml/min/1.73m2),與對照組相比,接受150×106細胞治療的eGFR >30ml/min/1.73m2亞組在12周時的eGFR下降幅度較小(p=0.04)。此外,與安慰劑組相比,300×106 細胞治療組在第12周時的IL-6中位值有統計學意義上的顯著下降,但其他指標(HbA1c、TNF-α和C反應蛋白)則沒有顯著下降。
在所有驗證這些細胞治療潛力的研究中,基于間充質干細胞的治療被認為是安全的程序。在對1000多名診斷患有其他臨床病癥的個體進行的臨床試驗評估MSC安全性的系統回顧和薈萃分析中,顯示MSC輸注和發燒之間存在顯著關聯。然而,沒有記錄其他直接事件(急性輸注毒性)、器官系統并發癥、感染和長期不良事件(死亡、惡性腫瘤)。
就功效而言,自體和同種異體衍生的間充質干細胞均實現了主要的次要終點,可有效改變糖尿病的代謝特征,例如C-肽合成并減少外源性胰島素需求、FBG和HbA1c,如表中所述?表2和表3, 分別。同樣,同種異體間充質干細胞與自體間充質干細胞一樣,可以有效改善缺血性心肌病患者的最終舒張期容積和左心室射血分數。值得注意的是,接受同種異體MSC的患者的同種免疫反應非常低 (3.7%)。
在腎移植患者中,輸注自體和同種異體MSC被認為是安全有效的。這些數據表明開發同種異體MSC生物庫用于多種病理學治療目的的可能性,因為這些細胞缺乏II類MHC抗原和共刺激分子。值得注意的是,正如最近評論的那樣,供體間異質性的潛在影響和同種異體細胞的潛在免疫原性,取決于培養條件和傳代、微環境和分化狀態,可能會改變免疫原性表型。
| MSC來源 | DM型 | 年齡(歲) | DM時間 | 患者人數 | 注射次數/給藥途徑 | 注射細胞數 | 隨訪(月) | 結果 | 不良事件 | 參考號 |
|---|---|---|---|---|---|---|---|---|---|---|
| BM | 1 | <8歲 | <2個月 | 2 | 單劑量,肝臟 | 180×106/公斤 | 12 | ↑C肽 ↓FBG、HbA1c ICA、GAD和抗胰島素抗體水平為負值 | 沒有任何 | [161] |
| BM | 1 | 18-40 歲 歲 | <3周 | 10例接受胰島素治療,10例接受胰島素+MSC 治療 | 單劑量,靜脈注射 | 2.1-3.6×106/kg(中位數2.75×106/kg) | 12 | ↑混合膳食耐受試驗后的C肽 ?HbA1c、胰島素劑量、空腹C肽 | 沒有任何 | [162] |
| AT-ISC-MSC+BM-HSC 調理 | 1 | 第1組:20±7年 第2組:20±10年 | 第組:8.1±3.4年 第2組:9.9±7.1年 | 第1組:自體AT-ISC-MSC+BM-HSC 第2組:來自健康非糖尿病供體的同種異體 AT-ISC-MSC+BM-HSC(每組n=10) | 單劑量,門靜脈+胸腺內+SC | 第1組:AT-ISC-MSC-2.65±0.8 ×104/kg 第2組:AT-ISC-MSC-2.07±0.67 ×104/kg | 24 | 自體與同種異體: (i) 同種異體:↓6個月內的胰島素需求量以及 ↓第1-24個月的餐后血糖 ( ii) 自體:↑ 第15-24個月的C肽 (iii) 同種異體=自體:↓HbA1c, FBG、GAD 抗體 | 沒有任何 | [157 , 158] |
| BM | 2 | 30-60年 | ≥5年 | BM-MSC與 BM-MNC與對照組(抗糖尿病藥物)(各n= 10) | 單劑量,胰十二指腸上動脈 | MSC:1×106/kg MNC:1×107 | 12 | ↓60%個體的胰島素需求量≥50%,HbA1c(BM-MSC 和BM-MNC) ?HOMA指數 ↑胰島素敏感性指數+肌肉中胰島素受體底物-1基因表達(BM-MSC) ↑第二相C肽高血糖鉗夾期間的反應 (BM-MNC) | 惡心和嘔吐 ( n= 2) | [163] |
| BM | 2 | 37-67 年(52.9 年(52.9 年) 年) | 2-15歲(7.15 歲) 歲) | NPR ( n=19) PR ( n=15) | 單劑量,靜脈注射 | 3.0×106/公斤 | 6 | ↓FBG、超敏 C反應蛋白 ?HbA1c、血漿IL-6 ↓ 黃斑厚度和最佳矯正視力的改善(增殖性視網膜病變組) | 沒有任何 | [164] |
AT-ISC-MSC:脂肪來源的胰島素分泌間充質干細胞;BM-HSC:骨髓來源的造血干細胞;BM-MNC:骨髓來源的單核細胞。β細胞自身抗體:GAD65(谷氨酸脫羧酶)和 IA2 抗體。FBG:空腹血糖;HbA1c:糖化血紅蛋白;NPR:非增殖性視網膜病變;PR:增殖性視網膜病變;SC:皮下注射;IU:國際單位;IV:靜脈注射;w:周;m:月份;y:年。
| MSC來源 | DM型 | 年齡 | DM時間 | 患者人數 | 注射次數/給藥途徑 | 注射細胞數 | 隨訪(月) | 結果 | 不良事件 | 參考號 |
|---|---|---|---|---|---|---|---|---|---|---|
| AT-ISC-MSC+HSC 調理 | 1 | 13-43歲(21歲) | 1-24 年(8.2 年(8.2 年) 年) | 11 | 單劑量,大網靜脈 | 平均移植總細胞量子數:96.3ml (92-118ml) HSC:28×103/μ l (12.2-62.7× 103/μl) MSC:1.2×103/μl (0.5-2.1×103/μl ) | 23 | ↓胰島素需求量,HbA1C ↑C肽 | 沒有任何 | [156] |
| 胎盤素 | 2 | 45-82歲(66歲) | 3-20 年(11 年(11 年) 年) | 10 | 單劑量,靜脈注射 | 1.35×106/公斤(1.22-1.51×106/公斤) | 3 | ↓胰島素需求,HbA1c ↑C肽,胰島素 | 沒有任何 | [165] |
| 沃頓氏果凍-MSC | 1 | 第 1 組 (MSC):17.6 ± 8.7  y y第 2 組(生理鹽水):18.2 ± 7.9  y y | 新發病 | 29 第 1 組:n = 15 第 2 組:n = 14 | 兩劑(間隔 4 周),靜脈注射 | 2.6±1.2×  107 (1.5-3.2×107 ) 107 (1.5-3.2×107 ) | 21 | ?FBG、GAD抗體 ↓胰島素需要量、餐后血糖、HbA1c ↑C肽、C 肽/血糖比 | 沒有任何 | [166 ] |
| 沃頓氏果凍-MSC | 2 | 52.9 ± 10.5 年 年 | 8.7±4.3 年 年 | 22 | 一劑靜脈注射和一劑胰內注射 | 1×106/公斤 | 12 | ↓FBG、餐后血糖、HbA1c、胰島素需要量 ↑ C肽、HOMA-β ↓ 血清 CD3+和 CD4+淋巴細胞 ? 血清 CD8 +淋巴細胞 ↓ 血清 IL-6、IL-1β ? 血清 TNF-α和 IL-10 | 發燒 ( n = 3)、血腫 ( n = 1)、惡心、嘔吐、頭痛 ( n=1) | [ 167 ] |
| BM (rexlemestrocel-L) eGFR:20-50  ml/min/1.73 ml/min/1.73  m 2 m 2 | 2 | 安慰劑:74.8 ± 7.9 歲 歲較低劑量 MSC:70.5 ± 7.4  歲 歲高劑量 MSC:64.8 ± 10.1  歲 歲 | DM時間:N/A | 30個(每個n= 10) | 單劑量,靜脈注射 | 150×106/kg(較低劑量)或300×106/kg(較高劑量) | 12 | ?eGFR、白蛋白尿 ?血脂譜 ?血壓 ?血清C反應蛋白、TNF-α ↓血清IL-6 | 沒有任何 | [ 155 ] |
| UC+自體BM-MNC | 1 | 標準護理:13-27 歲(20.4 歲(20.4 歲) 歲)細胞治療:5-28  歲(18.3 歲(18.3 歲) 歲) | 標準護理:2-13歲(7.0 歲) 歲)細胞治療:2-16歲(9.2  歲) 歲) | 42(每個n= 21) | 每個細胞單劑量,胰背動脈 | UCB:1.1×106/kg BM-MNC:106.8×106/kg | 12 | 細胞療法與標準治療相比: ↑C肽AUC ↑胰島素 AUC ↓FBG、HbA1c ↓空腹C肽 ↓胰島素需求 ↓焦慮評分 ↓抑郁評分 ↑生活質量 | 上呼吸道感染 ( n=7)、出血 ( n= 1)、腹痛 ( n=1) | [ 168 ] |
此外,這些研究還提出了與MSC來源和活力、輸注次數、輸注細胞數量、給藥途徑、MSC遷移到損傷部位的能力、MSC的效力相關的方案的重要問題。在疾病、模型和結果測量的背景下。一個關鍵方面表明,如先前在臨床前研究:小型和大型動物中所討論的,肺內隔離和早期消除可能會降低療效。
未來的方向
基因修飾、培養條件優化和預處理條件等策略可能會改善MSC功能并降低異質性。這些策略包括缺氧培養、藥物制劑、營養因子/細胞因子、小分子、物理因素/材料和基因修飾,這些都可能有助于間充質干細胞介導的更好的組織修復和再生。
結論
間充質干細胞在控制細胞凋亡、自噬、纖維化、炎癥和氧化應激等多種生物過程以及改善腎功能和結構參數方面表現出功效。
在過去的十年中,我們共同構建了從工作臺到病床的途徑。實驗室研究為建立進一步的轉化研究奠定了基礎,包括臨床前開發和模型系統中的概念驗證。
在圖1中,我們總結了臨床前和臨床研究的主要發現。因此,I期臨床試驗(人體安全性研究)已經證實了基于間充質干細胞療法的安全性,而II期臨床試驗(試驗參與者的概念驗證)仍需回答一些重要問題。因此,為了進入III期臨床試驗(顯示顯著療效的大規模試驗),還需要對DM患者的干細胞類型、細胞數量和輸注方法進行精心設計的大規模隨機研究。此外,這一途徑應包括與監管機構的互動,以及新藥研究(IND)申請開發所涉及的協議。
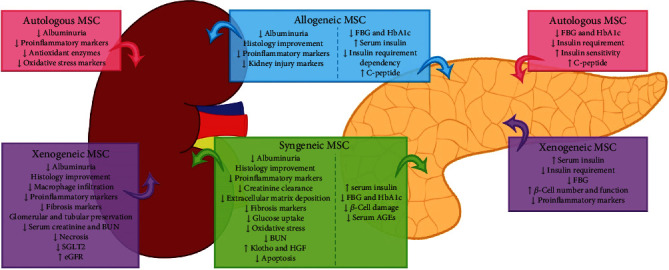
使用間充質干細胞的療法的臨床試驗表明,自體或同種異體MSC的輸注通常具有良好的耐受性。包括更長時間觀察的II期臨床試驗將支持MSC的功效。然而,使用這些細胞治療患有DKD的糖尿病患者還有待臨床驗證。總之,基于MSC的臨床前和I/II期臨床數據鼓勵設計未來的大規模對照臨床試驗,以評估DKD對MSC治療的反應,同時仍需要嚴格的安全性和有效性報告。
參考資料:Sávio-Silva C、Beyerstedt S、Soinski-Sousa PE 等。間充質干細胞治療糖尿病腎病:使用同基因、自體、同種異體和異種細胞的研究綜述。干細胞國際。2020;2020:8833725。DOI:10.1155/2020/8833725。電話號碼:33505469;PMCID:PMC7812547。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信