肝衰竭作為威脅生命的重癥疾病,其治療始終面臨“精準干預不足”“器官短缺嚴峻”“再生能力有限”三大核心挑戰。近年來,隨著多學科交叉創新與前沿技術突破,肝衰竭診療正迎來范式變革。
從病因導向的抗病毒藥物到RNA干擾療法的精準調控,從仿生納米藥物的雙靶向設計到NOXA激動劑的再生賦能,從人工肝系統的迭代升級到基因編輯豬肝移植的全球首例實踐,再到干細胞治療與多米諾體外肝技術的臨床轉化突破,一系列創新成果正在重塑肝衰竭治療的邊界。
本文系統梳理截至2025年10月肝衰竭的5種前沿治療技術突破,涵蓋:病因導向的精準藥物治療、生物制劑與靶向藥物、人工肝與異種移植、干細胞療法以及肝移植優化策略5大前沿進展。
這些技術突破不僅攻克了傳統治療的瓶頸,更通過“藥物-生物-工程-移植”的多維協同,構建了肝衰竭綜合治療的新范式,為全球數億肝病患者帶來新的生存希望。
2025肝衰竭的5種治療方法:從精準藥物到肝移植優化策略的最新突破
一、病因導向的精準藥物治療
1.1 艾米替諾福韋(TMF)
2025年5月7~10日,歐洲肝臟研究學會年會(EASL 2025)在荷蘭阿姆斯特丹及線上隆重召開。翰森制藥自主研發的中國首個原研口服抗乙型肝炎病毒藥物恒沐?(艾米替諾福韋片,TMF)3項學術研究成果在大會上發布,分別涵蓋恒沐?在乙肝病毒(HBV)相關肝硬化及肝衰竭患者中的應用,以及恒沐?抗病毒治療的免疫學機制。[1]
恒沐?通過靶向HBV逆轉錄酶,在肝細胞內實現三磷酸化效率提升3倍,顯著增強抗病毒活性,同時對腎功能影響更小,為重癥乙肝患者提供了兼顧療效與安全性的治療選擇。

在針對HBV相關慢加急性肝衰竭(HBV-ACLF)患者的研究中,TMF與替諾福韋艾拉酚胺(TAF)、恩替卡韋(ETV)的療效和安全性對比研究備受關注。該研究共納入235例患者,其中TMF組41例、TAF組60例、ETV組117例。結果顯示:
- 腎功能安全性:治療后各組腎功能均未惡化,但TAF組和TMF組治療2周后的估算腎小球濾過率(eGFR)水平顯著高于ETV組。此外,三組患者總膽固醇水平均未發生顯著變化。
- 生存率對比:三組患者60天總生存率分別為71.11%(TMF組)、73.77%(TAF組)和73.65%(ETV組),差異無統計學意義。
- 肝功能改善:治療2周后,三組患者的丙氨酸氨基轉移酶(ALT)和天冬氨酸氨基轉移酶(AST)水平均較基線顯著下降,組間差異無統計學意義。
TMF與TAF在HBV-ACLF患者中的60天總生存率與ETV相當,但其在腎功能保護方面表現出顯著優勢,為臨床提供了更優的安全性選擇。這一結果不僅驗證了恒沐?在重癥乙肝患者中的治療潛力,也為中國原研抗病毒藥物的國際認可奠定了重要基礎。
1.2 RNA干擾療法
近期,《中華肝臟病雜志》發表了一篇南開大學第一附屬醫院韓濤教授報告了肝衰竭的診治進展。指南強調 “三早一體系” 管理策略,早期干預可顯著改善預后。[2]

RNA干擾療法的潛在應用方向
- 靶向GSDMD依賴性焦亡:NK細胞介導的GSDMD焦亡是HBV-ACLF的關鍵病理機制。研究發現,通過RNA干擾技術抑制 GSDMD表達,可減少中性粒細胞胞外陷阱(NETs)形成,從而緩解炎癥級聯反應,成為恢復肝功能的潛在策略。
- 免疫調控靶點BTLA:HBV-ACLF患者CD4?T細胞中BTLA表達升高,通過RNA干擾下調BTLA,可逆轉免疫抑制狀態,降低繼發感染風險。
- 肝再生相關基因調控:反義寡核苷酸(ASO)技術在脂肪肝模型中通過靶向SH3BP5基因,逆轉脂肪堆積和纖維化,提示其在肝衰竭再生治療中的潛力。
臨床轉化進展與挑戰
- 早期研究驗證:RNA 干擾藥物 HRX215在I期臨床試驗中顯示良好安全性,靶向MKK4激酶可促進肝再生。
- 技術局限:目前RNA干擾療法多處于臨床前或I/II期,需解決遞送效率、長期安全性及個體化方案優化等問題。
RNA干擾療法通過精準調控 GSDMD 焦亡、BTLA 免疫抑制及肝再生基因,為肝衰竭治療提供了多維度干預策略。盡管現有研究多聚焦 HBV-ACLF 等特定亞型且處于早期階段,但其機制驗證與初步臨床數據已展現出突破性潛力。未來需結合基因遞送技術創新與臨床分層研究,推動 RNA 干擾從實驗室走向臨床應用。
二、生物制劑與靶向藥物
2.1 仿生納米藥物
2025年5月16日,《Advanced Functional Materials》發表重磅研究,提出了一種基于仿生納米藥物的創新療法,通過雙靶向遞送天然抗氧化劑柚皮素(Naringin),顯著緩解肝細胞氧化應激和Kupffer細胞炎癥,在急性肝衰竭小鼠模型中幾乎完全恢復肝功能![3]

該療法利用紅細胞膜包裹納米顆粒的創新設計——新鮮紅細胞膜包裹的fRBLN可精準靶向肝細胞,衰老紅細胞膜包裹的sRBLN則被庫普弗細胞主動攝取,從而同步降低肝細胞氧化損傷并調節庫普弗細胞炎癥反應,最終使肝功能近乎完全恢復。
針對ALF治療窗口狹窄、選擇有限的困境,該設計通過1:1混合注射fRBLN和sRBLN,實現藥物在肝細胞和庫普弗細胞的精準分布,誘導炎癥細胞表型由促炎M1向抑炎M2轉化。
這種雙靶向策略不僅突破了傳統單靶點治療的局限性,更為肝衰竭提供了兼具抗氧化與抗炎協同作用的新型治療范式,具有顯著的臨床轉化潛力。
2.2 NOXA(PMAIP1)激動劑
肝臟再生能力不足是肝衰竭治療的關鍵瓶頸。2025年7月19日,我國多家三甲醫院聯合在《Life Sciences》上發表了一項關于Bcl-2家族蛋白NOXA是一種新型的肝臟再生調節劑的研究。[4]
研究人員通過體內外模型(HGF刺激原代肝細胞、AAV8-shPmaip1介導的NOXA敲除小鼠部分肝切除模型),首次揭示BH3-only蛋白NOXA通過調控促增殖轉錄因子網絡驅動肝細胞周期進程,為肝再生障礙性疾病提供了新干預靶點。

研究團隊利用RNA-seq等技術解析發現,NOXA主要通過調控E2F家族轉錄因子激活細胞周期通路(如G1/S轉換、紡錘體組裝),而非依賴經典凋亡途徑。這一發現顛覆了對NOXA功能的傳統認知,揭示其作為肝臟再生“雙面開關”的特性。
基于AAV基因干預的成功驗證,研究提出可針對肝硬化或高危肝切除患者開發NOXA激動劑,但需警惕其在腫瘤背景下的潛在風險。該成果為肝再生障礙性疾病提供了全新治療靶點,并為臨床轉化奠定了基礎。
三、人工肝與異種移植的革新
3.1 李氏人工肝支持系統(Li-ALS)
2025年3月28日,第34屆亞太肝病學會年會(APASL 2025)在北京開幕。傳染病重癥診治全國重點實驗室主任李蘭娟院士及其團隊受邀參加此次會議,并做多個專題報告,分享介紹了肝衰竭和人工肝治療最新研究進展,為消除與治愈肝病共同探索新路徑、新方法。[5]

從20世紀八十年代起,李蘭娟院士帶領團隊開始研究人工肝治療肝衰竭,不斷改進,開發了一種獨特、有效且技術完善的李氏人工肝支持系統(Li-ALS)用于治療肝衰竭。
經過三個階段的發展,Li-ALS變得更加系統化、標準化和集成化,形成了一個全面升級的體系。從臨床情況來看,Li-ALS治療暫時替代肝臟行使解毒、合成等功能,為受損肝臟創造自我修復時機,是肝衰竭患者等待肝移植的重要橋梁。
3.2 基因編輯豬肝臟
2025年3月26日,《Nature》雜志刊發了一項震撼全球的成果:中國第四軍醫大學西京醫院團隊宣布,成功完成全球首例“基因編輯豬肝異種移植至人體”的臨床實驗。[6]
這是人類第一次將功能性豬肝接入人體血液系統并維持生命支持,為肝衰竭以及終末期肝病患者提供了完全不同的生存可能。

這次震撼全球的突破,并非“概念移植”,而是真實地完成了一個科學上前所未有的嘗試臺經過基因編輯的豬肝,被接入了人體體內循環,并連續支持生命系統21小時,未發生排異或感染。
研究對象為一位腦死亡的終未期肝衰竭患者,其自身肝臟已完全失去功能,無法合成膽紅素、清除代謝產物,在倫理委員會批準下,研究團隊將基因編輯豬肝接入其體內,構建真實人體運行環境。
核心數據如下:
- 所用豬肝來自Egenesis公司培育的69位點基因編輯豬其基因組中去除了3種主要免疫原抗原(GGTA1、CMAH、B4GALNT2),并添加了7個人源免疫調控基因。
- 豬肝在灌注后成功接入人體下腔靜脈與門靜脈系統,構建“外置式肝輔助循環”;
- 21小時內,豬肝持續分泌膽汁,穩定清除血中代謝廢物(如氨與乳酸),指標達到人體肝功能要求;
- 最關鍵的是:全程未觀察到超急性排異反應,也無病毒感染跡象,標志著豬肝與人體間的基礎生物兼容性,首次被實證確認。

這并非“象征性接入”,而是一次有明確功能輸出、持續維持生命支持的器官運行。這是世界上首次實現豬肝異種移植后的人體內短期穩定運行,且由中國團隊率先完成。
3.3 豬肝+體外循環肝(ECL)系統
2025年8月,《美國移植雜志》(AJT) 發表的一篇報道,美國食品藥品監督管理局 (FDA)已批準美國首個使用基因工程豬肝治療嚴重肝衰竭但無法進行肝移植的患者的臨床試驗。

這一創新方案針對因肝功能失代償而病情危重、傳統治療選擇有限的患者,為臨床提供了新的潛在療法。傳統人工肝支持系統(NBAL/BAL)雖然在血液動力學和生化指標上取得一定改善,但其對生存率的影響尚未被充分證實,同時存在細胞來源、保存及成本等限制。相比之下,基因工程豬肝在降低免疫排斥和提供代謝功能方面展現出優勢,為異種肝移植和全器官體外灌注開辟了新的方向。
在臨床前研究中,研究者利用尸體模型驗證了基因工程豬肝結合ECL系統的可行性和安全性,為首次人體試驗奠定基礎。PERFUSE-2研究將在多中心招募ACLF患者,探索豬肝體外灌注的短期支持效果和潛在療效,同時為未來異種肝移植積累重要數據。
專家指出,這一方法不僅能為短期維持肝功能的患者提供幫助,也有望推動人工肝和細胞/異種肝移植技術的發展,為肝衰竭治療帶來突破性進展。
四、細胞治療的臨床轉化突破
4.1 不同來源干細胞治療肝衰竭療效對比
2025年3月,我國科研人員在國際期刊《肝病學年鑒》上發表了一篇關于《肝衰竭干細胞治療的綜合薈萃分析:評估治療效果和治療方式》的研究成果。[7]

本次研究共檢索到2937篇文獻,最終納入8項研究進行分析。這些研究大多關注乙肝病毒相關肝衰竭,且為隨機對照試驗。所有研究均采用間充質干細胞(MSC),其中大多數(62.5%)為異體干細胞。
1.干細胞移植提高肝衰竭患者生存率
多項研究表明,干細胞治療(SCT)聯合標準藥物治療(SMT)或血漿置換(PE)可顯著改善肝衰竭患者的生存率。與單純SMT相比,SCT+SMT組的合并風險比(HR)為0.695,提示聯合治療能有效延長生存時間;而SCT+PE組的合并HR為0.487,進一步驗證了干細胞療法的附加價值。異體干細胞治療效果優于自體干細胞,深靜脈單次注射和外周靜脈多次注射均能顯著提升生存率,但異體干細胞的生存改善更明顯。
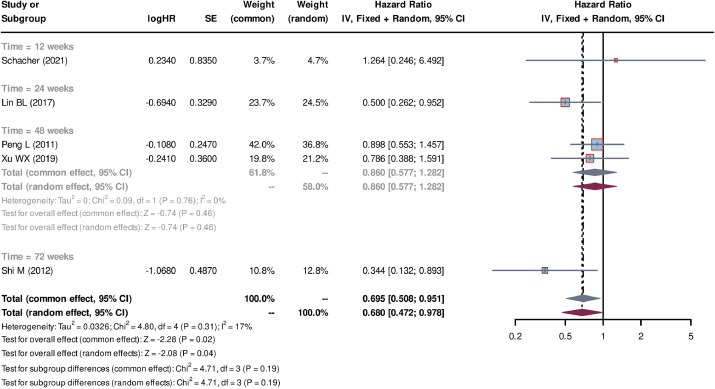
2.干細胞治療對MELD評分的影響
干細胞治療顯著降低了患者的終末期肝病模型(MELD)評分,尤其在短期(≤4周)和長期(24周)隨訪中效果更突出。自體干細胞治療對MELD評分的降低幅度大于異體干細胞,而深靜脈單次注射方式的改善效果優于外周靜脈多次注射。盡管部分研究存在發表偏倚,但通過敏感性分析和修剪填充法修正后,結果仍顯示干細胞治療對MELD評分的積極影響具有統計學意義。
3.干細胞治療對實驗室指標的影響
在肝功能指標中,干細胞治療顯著提升了白蛋白(ALB)水平,尤其在SCT+SMT組表現明顯,而丙氨酸氨基轉移酶(ALT)和總膽紅素(TBIL)未見顯著變化。凝血功能方面,SCT+PE組的國際標準化比值(INR)顯著下降,但SCT+SMT組無明顯差異。盡管部分指標存在發表偏倚風險,修正后的分析仍支持干細胞治療對ALB和INR的改善作用。
綜上所述,干細胞治療在肝衰竭管理中展現出顯著潛力。通過聯合標準藥物治療或血漿置換,干細胞療法不僅能提高患者生存率,還能有效降低MELD評分、改善凝血功能及白蛋白水平,尤其在異體干細胞和深靜脈單次注射方案中效果更為突出。這些發現為干細胞治療提供了堅實的臨床證據,揭示了其在修復肝功能和延緩疾病進展中的核心機制。
4.2 三維培養間充質干細胞治療
2025年4月19日,同濟大學附屬東方醫院/生命科學與技術學院何志穎教授團隊在《Biomaterials》上發表題為“明膠海綿貼片移植微低溫凝膠基三維間充質干細胞以緩解急性肝衰竭”的研究論文。[8]

該研究系統闡明了基于華龕生物3D TableTrix?微載體三維培養的hUCMSCs具有增強功能屬性的分子機制。證實3D TableTrix?微載體培養下hUCMSCs的Hippo信號被抑制同時MAPK通路被激活,從而表現出顯著增強的旁分泌活性(IGF2分泌量提升5.2倍)及抗氧化能力(ROS水平降低42%)。
同時,為了提高hUCMSCs移植后的體內定植效率和定植時間,團隊創新性開發了明膠海綿貼片移植(GSPG)技術,實現了三維培養的hUCMSCs在肝衰竭小鼠模型肝臟內長達6周的駐留。
相較于傳統血管輸注,小鼠生存期延長,血清ALT/AST水平顯著降低。該研究為hUCMSCs治療肝衰竭提供了可規模化生產且具有更優治療潛能的細胞來源,也為高效干細胞移植治療其他實體臟器疾病提供可行的參考借鑒。
詳情請瀏覽:2025年1-5月干細胞治療肝衰竭的臨床最新進展匯總
五、肝移植優化策略
5.1 ACLF患者移植時機重定義
為解決急慢性肝衰竭(ACLF)患者肝移植(LT)后預后差異及免疫機制不明確的問題,2025年7月17日,日本廣島大學醫院團隊開展了一項回顧性隊列研究。通過對比171例ACLF與非ACLF患者的臨床數據,結合CFSE-MLR技術動態監測T細胞反應,觀察兩組5年生存率。[9]

研究發現,盡管ACLF患者術前普遍存在嚴重腎功能衰竭(透析率69.2%)、高MELD評分(33.2)等危重特征,但移植后腎功能可在1年內完全恢復至正常水平,且術后多器官衰竭可被有效逆轉。通過創新應用MLR結合CFSE熒光標記技術,團隊首次揭示ACLF患者特有的”雙相免疫反應”:早期CD8+T細胞主導的高反應性(術后1周達63.6%)導致75%的排斥風險,但經精準免疫調控后2周內即可恢復正常應答,為臨床干預確立關鍵窗口期。
這項突破性研究為肝移植決策帶來三大變革性啟示:
- 活體肝移植更適合ACLF患者(占比76.9%),因其能精準把控手術時機;
- eGFR等腎功能指標不應作為移植禁忌標準;
- 基于MLR的免疫監測可指導個體化抗排斥方案。
值得注意的是,ACLF組術后膽道并發癥發生率反低于對照組(0% vs 19%),提示炎癥狀態下可能存在膽管保護機制。
研究團隊建議未來應擴大樣本量,深入探索先天免疫系統在ACLF移植中的作用,為這類高危患者建立更精準的治療體系。
5.2 多米諾體外肝治療技術
多米諾體外肝治療技術(Domino Ex vivo Liver Support, D-ELST)是一種肝移植的優化策略,通過創新性地利用原本可能被廢棄的肝臟資源,解決了器官短缺與治療瓶頸的雙重難題。其核心在于將“不可移植但功能尚可的肝臟”轉化為臨時的“外掛肝臟”,為肝衰竭患者爭取關鍵的治療窗口期,并為后續肝移植創造條件。[10]
2025年3月,中山大學附屬第一醫院器官移植團隊宣布在全面肝功能替代療法領域取得了重大突破:成功為一名肝衰竭晚期疊加肝移植禁忌患者實施全球首例多米諾體外肝治療技術,幫助患者度過肝衰竭危險期,并在后續順利完成肝移植。
這一創新療法不僅為肝衰患者帶來全新希望,也為全面肝功能替代療法臨床探索開辟全新途徑。
在何曉順教授指導下,在團隊郭志勇教授、唐云華醫生、家澤華博士、張嘉懿博士的共同努力下,患者接受了長達10小時45分鐘的體外肝治療。
此次體外肝支持療效非常顯著。治療后,患者膽紅素水平從554.6umol/L驟降至207.6umol/L,并穩定在300umol/L以下,精神狀態、食欲睡眠及體能均顯著改善。
同時,經過系統抗感染治療,肺部感染亦得到有效控制,成功為后續肝移植創造了有利條件。術后兩周精心護理后,陳先生已完全康復,現已順利出院。
結語
2025年的肝衰竭治療圖譜,正通過多學科技術的交叉融合勾勒出清晰的治愈路徑:從病因阻斷到功能替代,從免疫調控到再生修復,每一項突破都在重塑疾病管理的底層邏輯。
未來,隨著器官芯片技術、類器官培養、人工智能輔助決策等領域的深度融合,肝衰竭治療將加速邁向“個體化精準干預+動態再生修復+器官替代支持”的智慧醫療時代。
而中國學者在基因編輯、干細胞治療、體外肝輔助技術等領域的突破性貢獻,正為全球肝病防治提供兼具科學價值與人文關懷的中國方案。
參考資料:
[1]https://cn.hspharm.com/news/news-detail-513311.htm
[2]https://www.liver.org.cn/usr/70498/File/2025-5/286403936.pdf
[3]J. Shao, M. Wang, J. Huang, Y. Wang, J. Zhao, R. Wang, Z. P. Xu, J. Jiang, L. Zhang, Biomimetic Nanomedicines Deliver Naringin for Enhanced Acute Liver Failure Therapy via Balanced Regulation of Hepatocyte Oxidative Stress and Kupffer Cell Inflammation. Adv. Funct. Mater. 2025, 2502801. https://doi.org/10.1002/adfm.202502801
[4]Hui Liu, Wenjing Ren, Yue Kuang, Shanwen Gong, Zhuang Lin, Wei Gong, Xiulian Miao,The Bcl-2 family protein NOXA is a novel regulator of liver regeneration,Life Sciences,Volume 379,2025,123874,ISSN 0024-3205,https://doi.org/10.1016/j.lfs.2025.123874.
[5]https://mp.weixin.qq.com/s/AbSOAkaT8I4lpqWkwlE7bg
[6]Tao, KS., Yang, ZX., Zhang, X. et al. Gene-modified pig-to-human liver xenotransplantation. Nature 641, 1029–1036 (2025). https://doi.org/10.1038/s41586-025-08799-1
[7]Shenglong Lin, Haibing Gao, Huaxi Ma, Ziyuan Liao, Dongqing Zhang, Jinshui Pan, Yueyong Zhu,
A comprehensive meta-analysis of stem cell therapy for liver failure: Assessing treatment efficacy and modality,Annals of Hepatology,Volume 30, Issue 2,2025,101586,ISSN 1665-2681,https://doi.org/10.1016/j.aohep.2024.101586.[8]Haimeng Song, Xinyue Du, Yuanyuan Zhang, Wei Liu, Yi Luo, Yuxin Liu, Yongjia Xue, Mingyang Xu, Jizhen Lu, Wenwen Jia, Yanan Du, Lining Cao, Jianfeng Lu, Wencheng Zhang, Zhiying He,Gelatin sponge patch grafting of microcryogel-based three-dimensional mesenchymal stem cells to alleviate acute liver failure,
Biomaterials,Volume 321,2025,123324,ISSN 0142-9612,https://doi.org/10.1016/j.biomaterials.2025.123324.[9]Saegusa Y, Ohira M, Honmyo N, Nakano R, Sakai H, Shimizu S, Kuroda S, Tahara H, Ide K, Kobayashi T, Tanaka Y, Ohdan H. Outcomes of Liver Transplantation Among Patients Diagnosed With Acute-on-Chronic Liver Failure: A Single-Center Experience. Transplant Proc. 2025 Jul 17:S0041-1345(25)00321-5. doi: 10.1016/j.transproceed.2025.06.015. Epub ahead of print. PMID: 40681358.
[10]http://www.thejie.com/writing/15254
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信