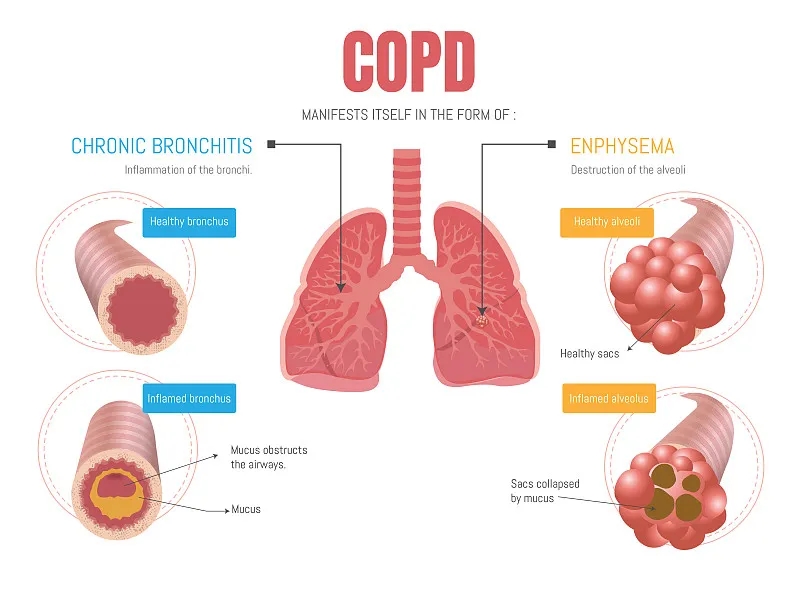
慢性阻塞性肺病的特征是不可逆氣流阻塞的逐漸進展以及氣道和肺實質炎癥的增加,這通常與哮喘引起的炎癥不同。大多數慢性阻塞性肺病與吸煙有關,但職業接觸刺激物和空氣污染也是重要的危險因素。慢性阻塞性肺病患者通常表現為咳嗽、咳痰和勞力性呼吸困難。然而,僅這些發現都不能診斷。
慢性阻塞性肺病全球倡議對慢性阻塞性肺病的診斷標準是一秒用力呼氣容積/用力肺活量之比小于預測值的70%。根據一秒鐘用力呼氣量和癥狀進一步對嚴重程度進行分層。胸片可能會排除其他診斷和合并癥。選定的患者應對α進行檢測1 –抗胰蛋白酶缺乏癥。對于出現嚴重疾病、右心衰竭或嚴重低氧血癥體征的患者,建議進行動脈血氣檢測。慢性阻塞性肺病也是一種全身性疾病,伴有體重減輕以及呼吸和骨骼肌功能障礙。
慢性阻塞性肺病 (COPD) 的全球負擔正在增加;到2020年,該疾病預計將成為全球第三大死亡原因和第五大總體殘疾原因。男性和女性似乎面臨同等風險,COPD導致的死亡率在兩性中都在顯著增加。COPD的經濟后果是巨大的。2002年,美國COPD的社會總成本估計為320億美元。
| 臨床推薦 | 證據等級 | 參考 |
|---|---|---|
| 在評估COPD患者時,應將肺量計用作一線診斷工具。FEV1/FVC比率低于預測值的70%表明存在COPD。 | C | 5、6?_?_ |
| 疑似COPD的患者應接受胸片檢查以排除其他診斷和合并癥。 | C | 6?,?31 |
| 應在特定患者中進行α1 -抗胰蛋白酶缺乏癥檢測(例如,從不吸煙的慢性阻塞性肺病、特發性肝硬化、α1-抗胰蛋白酶缺乏癥家族史、主要為下肺氣腫、“早發性”慢性阻塞性肺病和年輕時難治性哮喘). | C | 15 |
| 如果患者出現右心衰竭或更嚴重的COPD,則應進行ABG檢測。 | C | 5 |
A=一致的、高質量的、以患者為導向的證據;B=不一致或質量有限的以患者為導向的證據;C=共識、以疾病為導向的證據、慣例、專家意見或病例系列。
慢性阻塞性肺病的定義
COPD是一種異質性疾病,包括傳統的臨床實體,如肺氣腫和慢性支氣管炎。慢性阻塞性肺病全球倡議 (GOLD),由國家心肺血液研究所共同努力;美國國立衛生研究院和世界衛生組織將COPD定義為一種通常進行性疾病,氣流受限不完全可逆,并且與肺部對有害顆粒或氣體的異常炎癥反應有關。
COPD患者會出現多種臨床表現,包括慢性支氣管炎和肺氣腫的要素。盡管COPD和哮喘都與氣流阻塞以及肺部和氣道炎癥有關,但與COPD相比,與哮喘相關的氣流阻塞更具可逆性,病程變化更大。
風險因素
接觸煙草煙霧是慢性阻塞性肺病最重要的危險因素,80%至90%的病例可歸因于吸煙。將煙草煙霧暴露與慢性阻塞性肺病聯系起來的證據主要來自基于人群的研究,這些研究一致表明,吸煙與肺功能下降、呼吸道癥狀更頻繁以及與慢性阻塞性肺病相關的死亡增加有關。
吸食煙斗和雪茄與COPD風險增加相關,但風險低于吸香煙。盡管吸煙是慢性阻塞性肺病的重要危險因素,但只有大約20%的吸煙者會發展為具有臨床意義的慢性阻塞性肺病。
COPD的第二個最重要的記錄風險因素是α1–抗胰蛋白酶缺乏癥。盡管α1-抗胰蛋白酶缺乏會增加與吸煙相關的風險,但COPD可在患有α1-抗胰蛋白酶缺乏的從不吸煙者中發展。百分之一的COPD病例可歸因于嚴重的α1-抗胰蛋白酶缺乏癥。
某些職業暴露與COPD風險增加有關(表1)。接觸通常用于室內烹飪和取暖的固體生物質燃料是慢性阻塞性肺病的一個危險因素,尤其是在發展中國家。
| 職業 | 刺激性 |
|---|---|
| 農業工人 | 內毒素 |
| 煤礦工人 | 煤炭粉末 |
| 混凝土工人 | 礦塵 |
| 建筑工人 | 灰塵 |
| 黃金礦工 | 二氧化硅 |
| 硬巖礦工 | 礦塵 |
| 膠工 | 工業化學品 |
自然歷史
COPD患者可能會出現超出正常年齡相關肺功能下降的肺功能喪失。在肺功能下降到閾值以下之后,臨床疾病在病程中相當晚才發展。
25歲以后,不吸煙的成年人的一秒用力呼氣量 (FEV1) 平均每年減少20至40毫升。在一些吸煙者中,FEV1降低了這個數量的兩到五倍,使他們特別容易患上慢性阻塞性肺病。戒煙可能會導致FEV1略有初始改善(第一年約為50mL)。更重要的是,戒煙可以使曾經吸煙的人與從不吸煙的人一樣平均持續喪失肺功能。圖1說明了肺功能在各種情況下的逐漸喪失。
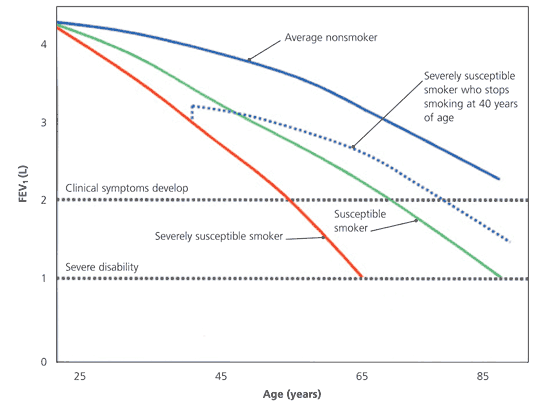
肺功能下降的自然史。與不吸煙者(紅線、綠線和藍線)相比,易受肺損傷的吸煙者與年齡相關的FEV1損失率增加。在肺功能下降到閾值水平后,出現臨床癥狀(黑色虛線)。當吸煙者停止吸煙時,FEV1損失率再次接近于非吸煙者(藍色虛線)。(FEV1=一秒鐘用力呼氣量)
COPD患者通常有至少20包年的吸煙史。當FEV1低于預測值的50%時,通常會出現喘息和勞力性呼吸困難,而當FEV1低于預測值的35%至40%時,通常會出現嚴重的身體殘疾。20多歲開始吸煙并在40多歲時FEV1已經明顯下降的患者如果繼續吸煙,可能會發展為嚴重的COPD。但是,FEV1值正常的40多歲的人可能不會出現有癥狀的疾病。
病理生理學
COPD涉及主要在外周氣道和肺實質中的慢性炎癥過程。氣道刺激導致粘液腺腫大、分泌過多、纖毛功能障礙和病程早期的鱗狀化生。持續的炎癥和修復循環最終會縮小氣道管腔并阻礙氣流。肺氣腫患者的肺泡壁結構成分遭到破壞,導致終末細支氣管遠端的氣腔永久性擴大。在早期COPD中,肺氣腫變化在上肺野最為突出。失去保持氣道暢通的結構支撐會導致細支氣管在呼氣時塌陷;由此產生的無功能肺泡單位減少了可用于氣體交換的肺面積。
COPD患者的氣道和肺實質中的中性粒細胞、巨噬細胞和CD8+T淋巴細胞計數較高。這些細胞釋放炎性細胞因子和蛋白酶,導致健康肺部的促炎性和保護性介質失衡。
慢性阻塞性肺病診斷
COPD的常見鑒別診斷包括哮喘、心力衰竭、支氣管擴張、閉塞性細支氣管炎、囊性纖維化和肺結核(表 2)。臨床病史;身體檢查;和診斷測試,例如肺功能測量,可以幫助診斷COPD。胸片可能會排除其他診斷和合并癥。
| 診斷 | 特征 | 臨床表現 | 肺功能檢查結果 | 胸片檢查結果 | 其他推薦測試 |
|---|---|---|---|---|---|
| 慢性阻塞性肺病 | 中年到晚年發作;隨著惡化穩步進行;與吸煙史有關 | 慢性咳痰、呼吸困難和喘息 | 主要固定氣流阻塞,降低 DLCO | 過度充氣、基底紋理增多、支氣管增厚 | 選定患者的α 1 -抗胰蛋白酶檢測、ABG 檢測和胸部 CT |
| 哮喘 | 通常早年發病;偶發的;與其他過敏性疾病和家族史有關 | 發作性喘息、咳嗽和呼吸困難 | 主要是可逆性氣流阻塞,正常 DLCO | 發作間期正常 | 過敏測試、峰值流量監測 |
| 支氣管擴張癥 | 通常中年發病;進行性加重 | 咳痰伴有濃稠膿性痰;呼吸困難; 喘息 | 阻塞性氣流受限,包括固定的和可逆的 | 局灶性肺炎、肺不張;擴張、增厚的氣道(環形陰影) | 細菌、微生物和真菌痰培養,胸部 CT |
| 閉塞性細支氣管炎 | 任何年齡均可發病;可能與流感樣疾病、膠原血管病或接觸有毒物質的病史有關 | 經常出現呼吸困難、咳嗽和發燒等亞急性表現 | 肺活量下降,DLCO 下降,通常無阻塞性成分 | 多灶性雙側肺泡浸潤 | ESR、高分辨率CT、肺活檢 |
| 充血性心力衰竭 | 中年到晚年發作;與高血壓和冠狀動脈疾病等危險因素相關 | 疲勞、勞力性和陣發性夜間呼吸困難和外周水腫 | DLCO 降低,主要用于排除其他診斷 | 心臟增大、肺血管充血、胸腔積液 | 超聲心動圖、BNP測量、心電圖;選定患者的心導管術 |
| 結核 | 任何年齡均可發病;與接觸史有關 | 咳痰、咯血、發燒和體重減輕 | 不用于診斷 | 浸潤、結節性病變、肺門淋巴結腫大 | 痰AFB培養 |
| 囊性纖維化 | 通常早年發病;進行性加重;與胰腺疾病、發育停滯、腸梗阻、肝硬化和脂肪瀉有關 | 預測性咳嗽伴有膿痰、呼吸困難和喘息 | 主要是固定的氣流阻塞 | 支氣管擴張常見于上葉 | 汗液氯化物試驗(診斷)、細菌痰培養 |
COPD=慢性阻塞性肺病;DLCO=一氧化碳在肺中的擴散;ABG=動脈血氣;CT=計算機斷層掃描;
ESR=紅細胞沉降率;BNP=腦利鈉肽;AFB=抗酸桿菌。
臨床病史
COPD患者通常表現為咳嗽、咳痰和勞力性呼吸困難。如果有大量煙草煙霧暴露史的患者出現這些癥狀,則可能診斷為COPD。COPD患者也可能在躺下后不久出現端坐呼吸,這與心力衰竭患者不同,心力衰竭患者端坐呼吸通常發生在躺下數小時后,此時液體從下肢流動。COPD相關咯血通常由咳嗽引起的氣道粘膜糜爛引起,但應考慮并存癌癥或潛在感染(如結核病)。如果COPD患者出現持續性晨起頭痛,應考慮嚴重的夜間缺氧或高碳酸血癥。
身體檢查
COPD患者通常表現為呼吸音減弱、呼氣時間延長和最初可能僅在用力呼氣時出現的呼氣喘息。體格檢查的其他發現包括肺部過度充氣,前后胸徑增加(“桶狀胸”);使用輔助呼吸肌;和遙遠的心音,有時最好在上腹部聽到。患有更晚期疾病的患者可能有噘唇呼吸或緩解呼吸困難的姿勢(例如,前傾靠在伸出的手掌上)。顯著水腫的存在可能表明嚴重長期慢性阻塞性肺病導致肺動脈高壓的患者存在右心衰竭和肺心病。
關于將患者病史和體格檢查的特定組成部分作為阻塞性氣道疾病預測指標的有效性的文獻價值有限。COPD 病史和顯著吸煙史通常是氣道阻塞的強預測因素,當存在提示COPD的多種癥狀或體征時,COPD的臨床可能性更大。表3列出了檢測氣流阻塞的常見身體癥狀和體征的預測值。
| 體征/癥狀 | 靈敏度 (%) | 特異性(%) | +LR | –LR |
|---|---|---|---|---|
| 無吸煙史與吸煙史 | 92 | 49 | 1.8 | 0.16 |
| ≥70包年對比<70 包年 | 40 | 95 | 8.0 | 0.63 |
| 喘息史 | 51 | 84 | 3.8 | 0.66 |
| 呼吸困難 | 82 | 33 | 1.2 | 0.55 |
| 咳嗽 | 51 | 71 | 1.8 | 0.69 |
| 檢查時喘息 | 15 | 99.6 | 36.0 | 0.85 |
| 檢查時呼吸音減弱 | 37 | 90后 | 3.7 | 0.70 |
診斷測試
評估疑似慢性阻塞性肺病患者的最佳診斷測試是用肺活量測量的肺功能。GOLD指南5根據臨床和肺功能測量來描述COPD的嚴重程度(表4)。
關鍵的肺活量測量可通過便攜式辦公室肺活量計獲得,并應包括強制生命力(FVC)和FEV1.COPD患者通常表現為阻塞性氣流。根據GOLD標準,如果患者的FEV1/FVC比值低于70%,且支氣管擴張后的FEV1低于預測值的80%,則可診斷為COPD.5。重癥患者的FEV1值低于預測值的50%;低于預測值的30%代表非常嚴重的疾病。盡管一些專家建議對45歲以上的高危患者定期進行FEV1測試,以促進危險因素的減少咨詢,但沒有證據支持這一建議。
| 階段 | 描述 | 發現* |
| 0 | 處于危險之中 | 危險因素和慢性癥狀但肺活量測定正常FEV1/FVC比率低于70% |
| Ⅰ | 溫和的 | FEV1/FVC 比率低于70% FEV1至少為預測值的80%可能有癥狀 |
| Ⅱ | 緩和 | FEV1/FVC 比率低于70% FEV1預測值的50%至低于80%可能有慢性癥狀 |
| Ⅲ | 嚴重 | FEV1/FVC比率小于70%FEV1預測值的30%到小于50% 可能有慢性癥狀 |
| Ⅳ | 非常嚴重 | FEV1/FVC 比率低于70% FEV1低于預測值的30% 或者 FEV1低于預測值的50%加上嚴重的慢性癥狀 |
GOLD=慢性阻塞性肺病全球倡議;COPD=慢性阻塞性肺病;FEV1=一秒鐘用力呼氣量;FVC=用力肺活量。
除了辦公室肺活量測試外,完整的肺功能測試可顯示總肺活量、功能殘余量和殘余容積的增加。肺氣腫患者可用于有效氧氣交換的肺表面積大量損失,導致肺內一氧化碳擴散(DLCO)減弱。這一發現可能有助于區分COPD和哮喘,因為哮喘患者的DLCO值通常正常。
慢性阻塞性肺病患者的胸片通常是不正常的,但多達一半的中度患者可能沒有顯示出變化。慢性阻塞性肺病患者的胸片可能顯示出肺部過度充氣,膈肌穹頂變平,肺血管向肺野外圍移動時變細。在慢性支氣管炎患者的胸片上,有時可以看到基底標記的增加(”臟肺”),在肺氣腫患者中可以看到孤立的球狀物。胸部計算機斷層掃描(CT)不應常規用于診斷COPD,但它可能顯示與病理檢查中發現的COPD改變程度高度相關的結果。
對選定的患者進行α1-抗胰蛋白酶缺乏癥的檢測是合適的;檢測包括測量循環中的α1-抗胰蛋白酶水平,如果水平不正常,則進行表型檢測。嚴重的α1-抗胰蛋白酶缺乏癥患者通常是歐洲人后裔,比沒有α1-抗胰蛋白酶缺乏癥的患者早10年左右出現COPD的臨床證據。與嚴重的α1-抗胰蛋白酶缺乏癥相關的肺部變化通常包括下肺野的偏向。應考慮檢測α1-抗胰蛋白酶缺乏癥的臨床情況包括從不吸煙的人患COPD、特發性肝硬化、α1-抗胰蛋白酶缺乏癥家族史、以下肺氣腫為主、”過早 “患COPD和年輕時難治的哮喘。
建議進行動脈血氣測量,以排除疾病較嚴重的患者的明顯低氧血癥(氧分壓低于60mmHg)或高碳酸血癥。這是基于FEV1(低于預測值的40%)、右心衰竭的跡象和低氧血癥的跡象。
臨床亞型
COPD患者也可以根據臨床發現分為臨床亞型。最常見的臨床亞型是慢性支氣管炎和肺氣腫。
氣流受阻的慢性支氣管炎
純慢性支氣管炎在臨床上被定義為連續兩年每年至少三個月的無法解釋的慢性、排痰性咳嗽。如果慢性支氣管炎患者存在固定氣道阻塞,則該患者也患有COPD。百分之八十五的慢性阻塞性肺病患者患有慢性支氣管炎。這些患者會出現明顯的咳嗽和咳痰,并經常在休息時出現缺氧和高碳酸血癥,并在睡眠期間出現明顯的氧飽和度下降。慢性支氣管炎和 COPD 患者常出現肺動脈高壓,導致右心衰竭和肺心病伴明顯外周水腫。
氣腫
呼吸困難是與肺氣腫相關的COPD相關的最突出癥狀。缺氧不如COPD的支氣管炎形式明顯,高碳酸血癥相對少見,直到病程很晚。
肺氣腫相關COPD患者在高肺容量時進行潮式呼吸,以補償高肺殘余容量并打開塌陷的氣道。這會導致肺部和胸部過度充氣,大大增加呼吸所需的總功。與慢性支氣管炎和COPD患者相比,與肺氣腫相關的COPD 患者發生右心衰竭和肺心病的可能性較小。
慢性阻塞性肺病作為一種全身性疾病
COPD越來越多地被認為是一種具有重要非肺部成分的全身性疾病。COPD患者的體重減輕可能與炎癥介質(例如,腫瘤壞死因子α、炎癥細胞因子)的循環水平升高有關。與嚴重COPD相關的肺部惡病質也會導致嚴重的體重減輕,這是獨立于肺功能的死亡風險增加的預測指標。
COPD伴有呼吸肌和骨骼肌異常。COPD患者的呼吸肌長期過度勞累和疲勞,而四肢肌肉往往勞累不足和萎縮。
參考資料:
- Mannino DM, Homa DM, Akinbami LJ, Ford ES, Redd SC. Chronic obstructive pulmonary disease surveillance—United States, 1971–2000. Respir Care. 2002;47:1184-99.
- American Lung Association. Trends in chronic bronchitis and emphysema: morbidity and mortality. Accessed online May 18, 2005, at: http://www.lungusa.org/site/pp.asp?c=dvLUK900E&b=3334.
- Petty TL, Weinmann GG. Building a national strategy for the prevention and management of and research in chronic obstructive pulmonary disease. National Heart, Lung, and Blood Institute Workshop Summary. Bethesda, Maryland, August 29–31, 1995. JAMA. 1997;277:246-53.
- Petty TL. COPD in perspective. Chest. 2002;121(suppl 5):116S-20.
- Global Initiative for Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease [executive summary]. Updated 2004. Accessed online July 5, 2005, at: http://www.goldcopd.com/Guidelineitem.asp?l1=2&l2=1&intId=996.
- Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med. 1995;152(pt 2):77S-121.
- Gross NJ. Chronic obstructive pulmonary disease. Current concepts and therapeutic approaches. Chest. 1990;97(suppl 2):19S-23.
- Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med. 2000;343:269-80.
- Bach PB, Brown C, Gelfand SE, McCrory DC. Management of acute exacerbations of chronic obstructive pulmonary disease: a summary and appraisal of published evidence. Ann Intern Med. 2001;134:600-20.
- Burrows B, Knudson RJ, Cline MG, Lebowitz MD. Quantitative relationships between cigarette smoking and ventilatory function. Am Rev Respir Dis. 1977;115:195-205.
- Carpenter L, Beral V, Strachan D, Ebi-Kryston KL, Inskip H. Respiratory symptoms as predictors of 27 year mortality in a representative sample of British adults. BMJ. 1989;299:357-61.
- Xu X, Dockery DW, Ware JH, Speizer FE, Ferris BG. Effects of cigarette smoking on rate of loss of pulmonary function in adults: a longitudinal assessment. Am Rev Respir Dis. 1992;146(5 pt 1):1345-8.
- Fletcher C, Peto R. The natural history of chronic airflow obstruction. Br Med J. 1977;1:1645-8.
- The Alpha-1-Antitrypsin Deficiency Registry Study Group. Survival and FEV1 decline in individuals with severe deficiency of alpha1-antitrypsin. Am J Respir Crit Care Med. 1998;158:49-59.
- Alpha-1 Foundation. A healthcare provider’s guide to alpha-1 antitrypsin deficiency. Accessed online May 18, 2005, at: http://www.alphaone.org/documents/pdf/11.03_hcpg.pdf.
- Hnizdo E, Sullivan PA, Bang KM, Wagner G. Association between chronic obstructive pulmonary disease and employment by industry and occupation in the US population: a study of data from the Third National Health and Nutrition Examination Survey. Am J Epidemiol. 2002;156:738-46.
- Oxman AD, Muir DC, Shannon HS, Stock SR, Hnizdo E, Lange HJ. Occupational dust exposure and chronic obstructive pulmonary disease. A systematic overview of the evidence. Am Rev Respir Dis. 1993;148:38-48.
- Balmes J, Becklake M, Blanc P, Henneberger P, Kreiss K, Mapp C, et al. American Thoracic Society statement: occupational contribution to the burden of airway disease. Am J Respir Crit Care Med. 2003;167:787-97.
- Sandford AJ, Silverman EK. Chronic obstructive pulmonary disease. 1: susceptibility factors for COPD the genotype–environment interaction. Thorax. 2002;57:736-41.
- Rennard SI, Farmer SG. COPD in 2001: a major challenge for medicine, the pharmaceutical industry, and society. Chest. 2002;121(suppl 5):113S-5.
- Scanlon PD, Connett JE, Waller LA, Altose MD, Bailey WC, Buist AS. Smoking cessation and lung function in mild-to-moderate chronic obstructive pulmonary disease. The Lung Health Study. Am J Respir Crit Care Med. 2000;161(2 pt 1):381-90.
- Doherty DE. Early detection and management of COPD.What you can do to reduce the impact of this disabling disease. Postgrad Med. 2002;111:41-4.
- Mannino DM. COPD: epidemiology, prevalence, morbidity and mortality, and disease heterogeneity. Chest. 2002;121(suppl 5):121S-6.
- Holleman DR, Simel DL. Does the clinical examination predict airflow limitation? [published correction appears in JAMA 1995;273:1334]. JAMA. 1995;273:313-9.
- Rennard SI. Overview of causes of COPD. New understanding of pathogenesis and mechanisms can guide future therapy. Postgrad Med. 2002;111:28-30.
- Straus SE, McAlister FA, Sackett DL, Deeks JJ. The accuracy of patient history, wheezing, and laryngeal measurements in diagnosing obstructive airway disease. CARE-COAD1 Group. Clinical Assessment of the Reliability of the Examination–Chronic Obstructive Airways Disease [published correction appears in JAMA2000;284:181]. JAMA. 2000;283:1853-7.
- Badgett RG, Tanaka DJ, Hunt DK, Jelley MJ, Feinberg LE, Steiner JF, et al. The clinical evaluation for diagnosing obstructive airway disease in high risk patients. Chest. 1994;106:1427-31.
- Badgett RG, Tanaka DJ, Hunt DK, Jelley MJ, Feinberg LE, Steiner JF, et al. Can moderate chronic obstructive pulmonary disease be diagnosed by history and physical findings alone?. Am J Med. 1993;94:188-96.
- American Thoracic Society.. Standardization of spirometry, 1994 update. Am J Respir Crit Care Med. 1995;152:1107-36.
- Cotton DJ, Soparkar GR, Grahan BL. Diffusing capacity in the clinical assessment of chronic airflow limitation. Med Clin North Am. 1996;80:549-64.
- Muller NL, Coxson H. Chronic obstructive pulmonary disease. 4: imaging the lungs in patients with chronic obstructive pulmonary disease. Thorax. 2002;57:982-5.
- Hogg JC, Senior RM. Chronic obstructive pulmonary disease—part 2: pathology and biochemistry of emphysema. Thorax. 2002;57:830-4.
- Wouters EF. Chronic obstructive pulmonary disease. 5:systemic effects of COPD. Thorax. 2002;57:1067-70.
- Agust AG, Gari PG, Sauleda J, Busquets X. Weight loss in chronic obstructive pulmonary disease. Mechanisms and implications. Pulm Pharmacol Ther. 2002;15:425-32.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加微信
掃碼添加微信